1 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(1)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的SiCl4充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(2)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,固体全部溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag |
| 含量(质量分数) | 75.00% |
您最近一年使用:0次
2019-12-15更新
|
496次组卷
|
2卷引用:人教版高中化学(2019)必修第二册第五章《化工生产中的重要非金属元素》检测题
2 . 铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al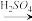 Al3+
Al3+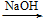
 Al(OH)3↓
Al(OH)3↓
方案2:Al AlO
AlO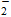
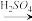 Al(OH)3↓
Al(OH)3↓
方案3: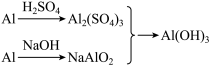
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________ 。
(Ⅱ)工业上冶炼铝的流程图如图所示:
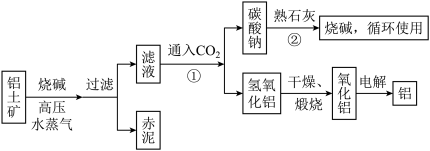
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
(1)书写化学方程式,反应①________ ,反应②________ 。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________ 。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________ t。
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al
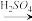 Al3+
Al3+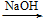
 Al(OH)3↓
Al(OH)3↓方案2:Al
 AlO
AlO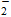
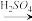 Al(OH)3↓
Al(OH)3↓方案3:
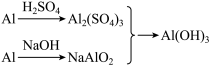
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
Al2O3 | Fe2O3 | 其他杂质 | |
铝土矿 | 55% | 16% | |
赤泥 | 15% | 48% |
(2)电解氧化铝生产铝时,阳极的电极反应式为
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿
您最近一年使用:0次
2019-06-21更新
|
724次组卷
|
5卷引用:苏教版高中化学必修2专题四《化学科学与人类文明》测试卷
苏教版高中化学必修2专题四《化学科学与人类文明》测试卷苏教版高一化学必修2专题4《化学科学与人类文明》测试卷(已下线)2011届四川省南充市高三第二次诊断性考试(理综)化学部分(已下线)2010-2011学年安徽省天长市关塘中学高二下学期月考化学试题云南省通海三中2018-2019学年高一6月份考试化学试题
解题方法
3 . 某铝合金中含有元素铝、镁、铜、硅,为了测定该合金中铝的含量,设计了如下实验,请回答有关问题:
(1)称取样品a g(精确到0.1 g),称量时通常使用的主要仪器的名称是_____ 。
(2)将样品溶解于过量的稀盐酸,过滤并洗涤滤渣。滤液中主要含有________ ,滤渣为________ ,溶解、过滤用到的玻璃仪器是________ 。
(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是________________________________________________________________ 。
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣。有关的离子方程式是______________________________________________________________ 。
(5)将步骤(4)中所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是
_______________________________________________________________________ ,原样品中铝的质量分数是________ 。
(1)称取样品a g(精确到0.1 g),称量时通常使用的主要仪器的名称是
(2)将样品溶解于过量的稀盐酸,过滤并洗涤滤渣。滤液中主要含有
(3)向滤液中加过量的氢氧化钠溶液,过滤并洗涤滤渣。有关的离子方程式是
(4)向步骤(3)的滤液中通入足量的二氧化碳气体,过滤并洗涤滤渣。有关的离子方程式是
(5)将步骤(4)中所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是
您最近一年使用:0次
2018-09-04更新
|
191次组卷
|
2卷引用:2018-2019学年人教版高中化学必修一:18-19 章末综合测评3 金属及其化合物
4 . 铁是人体必需的微量元素之一,没有铁,血红蛋白就不能结合氧分子进行输氧,所以缺少铁元素,人体易患的疾病为贫血,医学上经常用硫酸亚铁糖衣片给这种病人补铁。小陈同学对这种糖衣片产生了兴趣,进行探究实验如下:
(1)提出问题
这种糖衣片中是否含有硫酸亚铁,若有,含量是多少?
(2)查阅资料
①亚铁离子遇具有氧化性的物质时易被氧化。如氢氧化亚铁为白色沉淀,在空气中会迅速被氧化成红褐色的氢氧化铁沉淀,这是氢氧化亚铁的典型特征。
②亚铁盐溶于水时,会产生少量氢氧根离子而产生沉淀(溶液浑浊)。
(3)实验验证
①鉴定硫酸亚铁的成分时需加水溶解,加1滴稀盐酸的作用是___________ ,能否用稀硫酸代替(填“能”或“不能”)_________ 。
②为了不影响后续检验亚铁盐,检验硫酸盐可用的试剂是(选填“A”或“B”)______ 。
A.用硝酸酸化的硝酸钡溶液
B.用盐酸酸化的氯化钡溶液
③检验亚铁盐可用的试剂是______ ,现象为_____________ 。
(4)含量测定
①取十粒糖衣片,称其质量为5g,溶于20 g水中;溶解药品时用到玻璃棒的作用是_______ 。
②向所配溶液中滴加氯化钡溶液至略过量;证明溶液过量的操作为:静置,向上层清液中滴加__________ 溶液,若现象为______________ ,则溶液已过量。
③过滤、洗涤、干燥;洗涤沉淀的操作:用玻璃棒(填一操作名)__________ ,向过滤器中加入蒸馏水至淹没沉淀,待液体滤出。重复操作2~3次。证明沉淀已洗净的方法是_______ 。
④称量得,沉淀质量为4.66 g,列式计算该糖衣片中硫酸亚铁的质量分数____ 。
(5)总结反思
对硫酸亚铁来说,药片的糖衣起到的作用是____________ 。
(1)提出问题
这种糖衣片中是否含有硫酸亚铁,若有,含量是多少?
(2)查阅资料
①亚铁离子遇具有氧化性的物质时易被氧化。如氢氧化亚铁为白色沉淀,在空气中会迅速被氧化成红褐色的氢氧化铁沉淀,这是氢氧化亚铁的典型特征。
②亚铁盐溶于水时,会产生少量氢氧根离子而产生沉淀(溶液浑浊)。
(3)实验验证
①鉴定硫酸亚铁的成分时需加水溶解,加1滴稀盐酸的作用是
②为了不影响后续检验亚铁盐,检验硫酸盐可用的试剂是(选填“A”或“B”)
A.用硝酸酸化的硝酸钡溶液
B.用盐酸酸化的氯化钡溶液
③检验亚铁盐可用的试剂是
(4)含量测定
①取十粒糖衣片,称其质量为5g,溶于20 g水中;溶解药品时用到玻璃棒的作用是
②向所配溶液中滴加氯化钡溶液至略过量;证明溶液过量的操作为:静置,向上层清液中滴加
③过滤、洗涤、干燥;洗涤沉淀的操作:用玻璃棒(填一操作名)
④称量得,沉淀质量为4.66 g,列式计算该糖衣片中硫酸亚铁的质量分数
(5)总结反思
对硫酸亚铁来说,药片的糖衣起到的作用是
您最近一年使用:0次
2018-12-04更新
|
207次组卷
|
7卷引用:2020年春季苏教版高中化学必修1专题三《从矿物到基础材料》测试卷
5 . 实验室有一瓶失去标签的某白色固体X,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且其成分单一。
Ⅰ.现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定:
实验方法及现象:_______________ 。
结论:此白色固体是钠盐。
(2)阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
Ⅱ.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤i:称取样品1.000 g。
步骤ii:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii:移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤ⅲ所发生反应的离子方程式___________ 。
(2)在配制0.01 mol·L-1的KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量____ (填“偏大”“偏小”或“无影响”)。
(3)滴定结果如下表所示:
则该变质固体中X的质量分数为____ 。
Ⅰ.现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定:
实验方法及现象:
结论:此白色固体是钠盐。
(2)阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
Ⅱ.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤i:称取样品1.000 g。
步骤ii:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii:移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤ⅲ所发生反应的离子方程式
(2)在配制0.01 mol·L-1的KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量
(3)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
您最近一年使用:0次
9-10高一·全国·单元测试
名校
解题方法
6 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)补全上述①②③④各步反应的离子方程式
① Mg+2H+=Mg2++H2↑ ,___________________________
②_______________________ , _______________________ ,Mg2++OH-=Mg(OH)2↓
③______________________________ ,CO2+H2O+ A1O2-=Al(OH)3↓+3HCO3-
④2A1(OH)3=Al2O3+H2O
(2)该样品中铝的质量分数是( )
(3)第②步中加入NaOH溶液不足时,会使测定结果( )
第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果( )
第④步对沉淀灼烧不充分时,会使测定结果( )
A.偏高 B.偏低 C.不影响

(1)补全上述①②③④各步反应的离子方程式
① Mg+2H+=Mg2++H2↑ ,
②
③
④2A1(OH)3=Al2O3+H2O
(2)该样品中铝的质量分数是
(3)第②步中加入NaOH溶液不足时,会使测定结果
第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果
第④步对沉淀灼烧不充分时,会使测定结果
A.偏高 B.偏低 C.不影响
您最近一年使用:0次
21-22高一下·全国·单元测试
解题方法
7 . 硝酸( )
)
(1)物理性质:无色、_______ 气味、_______ 挥发液体,能与水以任意比例互溶,常用浓硝酸的质量分数大约为69%。
(2)化学性质
硝酸为_______ 酸,具有以下性质:
①具有酸的通性;
②不稳定性:_______ ;
③强氧化性:无论浓、稀硝酸均具有强氧化性,与金属反应时不放出_______ 。
A.与金属反应:
铜与浓硝酸:_______ ;
铜与稀硝酸:_______ ;
银与浓硝酸:_______ ;
常温下浓硝酸与铁、铝发生_______ 。
B.与非金属反应:
碳与浓硝酸:_______ 。
C.与其他还原剂反应,如H2S、SO2、Fe2+等。
D.与有机物反应:硝化反应、酯化反应、与蛋白质发生颜色反应等。
(3)制法
①实验室制法:硝酸盐与浓硫酸微热,_______ (不能用强热和稀硫酸);
②工业制法:
氨的催化氧化法:_______ ;_______ ;_______ ;
尾气处理:_______ (用NaOH溶液吸收尾气)。
(4)用途:_______ 等。
 )
)(1)物理性质:无色、
(2)化学性质
硝酸为
①具有酸的通性;
②不稳定性:
③强氧化性:无论浓、稀硝酸均具有强氧化性,与金属反应时不放出
A.与金属反应:
铜与浓硝酸:
铜与稀硝酸:
银与浓硝酸:
常温下浓硝酸与铁、铝发生
B.与非金属反应:
碳与浓硝酸:
C.与其他还原剂反应,如H2S、SO2、Fe2+等。
D.与有机物反应:硝化反应、酯化反应、与蛋白质发生颜色反应等。
(3)制法
①实验室制法:硝酸盐与浓硫酸微热,
②工业制法:
氨的催化氧化法:
尾气处理:
(4)用途:
您最近一年使用:0次
名校
解题方法
8 . 某化学学习小组为了探究铁质材料碳素钢(仅含有C和Fe)和浓硫酸反应的气体产物,利用下列装置(部分夹持仪器已省略)进行了如下实验探究活动:
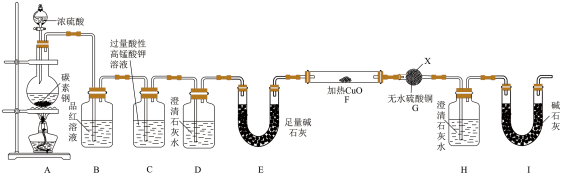
回答下列问题:
(1)仪器X的名称为_______ 。
(2)能证明实验生成SO2的实验现象为_______ ;SO2进入装置C中被氧化为 ,
, 被还原为Mn2+,试写出该反应的离子方程式:
被还原为Mn2+,试写出该反应的离子方程式:_______ 。
(3)实验过程中观察到G中无水硫酸铜由白色变成蓝色,F中发生反应的化学方程式为_______ ;产生该气体的原因为_______ 。
(4)若装置D中澄清石灰水变浑浊,装置H中澄清石灰水未变浑浊,再结合(3)推知碳素钢与浓硫酸反应产生的气体中除了含有SO2外,还有_______ (填化学式);铁质材料中碳与浓硫酸反应的化学方程式为_______ 。装置H后增加装置I的目的是_______ 。
(5)称量23 g该材料进行实验,完全反应后,装置D与E的总质量增加0.44 g(忽略水的干扰),则原碳索钢中铁的质量分数为_______ (结果保留两位小数)。

回答下列问题:
(1)仪器X的名称为
(2)能证明实验生成SO2的实验现象为
 ,
, 被还原为Mn2+,试写出该反应的离子方程式:
被还原为Mn2+,试写出该反应的离子方程式:(3)实验过程中观察到G中无水硫酸铜由白色变成蓝色,F中发生反应的化学方程式为
(4)若装置D中澄清石灰水变浑浊,装置H中澄清石灰水未变浑浊,再结合(3)推知碳素钢与浓硫酸反应产生的气体中除了含有SO2外,还有
(5)称量23 g该材料进行实验,完全反应后,装置D与E的总质量增加0.44 g(忽略水的干扰),则原碳索钢中铁的质量分数为
您最近一年使用:0次
2023-01-15更新
|
679次组卷
|
3卷引用:章末检测卷(三) 物质的性质与转化
解题方法
9 . 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要原料。现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下不同的实验方案:
方案1:铝镁合金与足量盐酸反应,测定气体在标准状况下的体积V1L。
方案2:铝镁合金与足量氢氧化钠溶液反应,过滤、洗涤、烘干,测定剩余固体质量w1 g。
方案3:铝镁合金与过量的盐酸反应,在溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧,测定固体的质量w2 g。
(1)某化学实验小组利用如图所示的装置,按照方案1进行了实验。
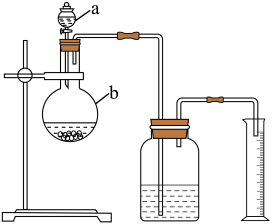
①装置中仪器a、b的名称分别是_______ 、_______ 。
②实验装置中有两处明显错误,请指出:_______ 、_______ ;绘出正确的装置图_______ 。
(2)方案2中的离子方程式为_______ 。
(3)方案3中“过滤”操作中用到玻璃棒,玻璃棒的作用是_______ ,若按方案3进行实验,测得的镁的质量分数为_______ 。
(4)请你设计一个不同于上述方案的实验方案,简述实验原理:_______ 。
方案1:铝镁合金与足量盐酸反应,测定气体在标准状况下的体积V1L。
方案2:铝镁合金与足量氢氧化钠溶液反应,过滤、洗涤、烘干,测定剩余固体质量w1 g。
方案3:铝镁合金与过量的盐酸反应,在溶液中加入过量的氢氧化钠溶液,过滤、洗涤、灼烧,测定固体的质量w2 g。
(1)某化学实验小组利用如图所示的装置,按照方案1进行了实验。

①装置中仪器a、b的名称分别是
②实验装置中有两处明显错误,请指出:
(2)方案2中的离子方程式为
(3)方案3中“过滤”操作中用到玻璃棒,玻璃棒的作用是
(4)请你设计一个不同于上述方案的实验方案,简述实验原理:
您最近一年使用:0次
21-22高一下·全国·单元测试
解题方法
10 . 新型无机非金属材料
(1)硅单质
①Si位于元素周期表第_______ 周期,第_______ 族,处于金属与非金属过渡位置,为半导体材料。硅在地壳中含量仅次于氧,居第2位。
②硅在自然界的存在形态:没有游离态,只有化合态_______ 、硅酸盐。
③用途:主要用来做集成电路、晶体管、硅整流器等_______ 材料,还可以制成太阳能电池、硅的合金可用来制造变压器铁芯等。
(2)二氧化硅(硅石)
①SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫_______ ;结晶的二氧化硅叫_______ 。二氧化硅可以用来制造_______ ,具有优良的性能。
②光导纤维主要特性:①抗干扰性能好,不发生辐射;②通讯质量好;③质量轻、耐腐蚀。
(1)硅单质
①Si位于元素周期表第
②硅在自然界的存在形态:没有游离态,只有化合态
③用途:主要用来做集成电路、晶体管、硅整流器等
(2)二氧化硅(硅石)
①SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫
②光导纤维主要特性:①抗干扰性能好,不发生辐射;②通讯质量好;③质量轻、耐腐蚀。
您最近一年使用:0次



