1 . 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴试剂1是__________ 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是______________________________________ 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)_______________
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为_______ 。

⑴试剂1是
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的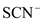 被过量的氯水氧化 被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式是_______ ;可观察到的实验现象是_______ (填字母序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积_______ L;原混合气体的中CO2和H2O的分子数比为_______ 。
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
(1)将一小块金属钠投入水中,发生反应的离子方程式是
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
| A.取a g混合物充分加热,质量减少b g |
| B.取a g混合物与足量NaOH溶液充分反应,得到b g溶液 |
| C.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b g固体 |
| D.取a g混合物与足量稀硫酸反应,逸出气体经干燥后用碱石灰吸收,质量增加b g |
您最近一年使用:0次
2022-11-29更新
|
537次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
解题方法
3 . 完成下列问题
Ⅰ.化合物X,Y,Z含有相同元素,其中一种元素为金属。分别将其隔绝空气煅烧,完全分解后得到固体剩余物和气体(反应①~③)。所得数据如下表。
(1)通过计算和推理,求出X,Y,Z的化学式。X_______ 、Y_______ 、Z_______
(2)写出反应②的方程式_______ 。
Ⅱ.化合物Z和NO在光照条件下经两步反应生成暗绿色挥发性固体A,已知总反应物质的量比为1∶6(反应④)。反应经过一个中间产物B( )。
)。
(3)写出A和B的化学式。A_______ ,B_______
Ⅲ.化合物Z和 在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧
在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧 反应生成暗红色粉末C(
反应生成暗红色粉末C(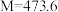 )。已知C中存在
)。已知C中存在 单元以六齿配体形式存在。
单元以六齿配体形式存在。
(4)给出C的化学式_______ ,画出C的结构_______ 。
Ⅳ.化合物Z的类似物D为淡黄色液体。D与 在THF中反应后,再在
在THF中反应后,再在 中与
中与 反应生成化合物E(
反应生成化合物E(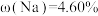 )。D的三聚物F与KOH在
)。D的三聚物F与KOH在 中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与
中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与 在
在 中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与
中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与 在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(
在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(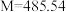 ,反应⑦),I易升华,在1810和
,反应⑦),I易升华,在1810和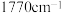 存在
存在 键的吸收峰。
键的吸收峰。
(5)写出D、E、F、G、H、I的化学式。D_______ ,E_______ ,F_______ ,G_______ ,H_______ ,I_______
(6)写出反应⑤⑦的方程式。⑤_______ ,⑦_______
Ⅰ.化合物X,Y,Z含有相同元素,其中一种元素为金属。分别将其隔绝空气煅烧,完全分解后得到固体剩余物和气体(反应①~③)。所得数据如下表。
| 物质 | 原物质质量/g | 固体剩余物质量/g | 气体体积/mL(标况) |
| X | 1.000 | 0.617 | 194.8 |
| Y | 1.000 | 0.497 | 313.3 |
| Z | 1.000 | 0.282 | 574.4 |
(2)写出反应②的方程式
Ⅱ.化合物Z和NO在光照条件下经两步反应生成暗绿色挥发性固体A,已知总反应物质的量比为1∶6(反应④)。反应经过一个中间产物B(
 )。
)。(3)写出A和B的化学式。A
Ⅲ.化合物Z和
 在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧
在THF中加热反应后生成红色阴离子,然后在环己烷中与脱氧 反应生成暗红色粉末C(
反应生成暗红色粉末C(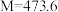 )。已知C中存在
)。已知C中存在 单元以六齿配体形式存在。
单元以六齿配体形式存在。(4)给出C的化学式
Ⅳ.化合物Z的类似物D为淡黄色液体。D与
 在THF中反应后,再在
在THF中反应后,再在 中与
中与 反应生成化合物E(
反应生成化合物E(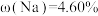 )。D的三聚物F与KOH在
)。D的三聚物F与KOH在 中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与
中反应生成G(其中过渡金属元素的质量分数为30.25%,反应⑤),G继续与 在
在 中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与
中反应生成H(反应⑥),H与E中的阴离子相同。D中的金属元素的单质与 在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(
在丙酮中反应生成其二碘化物,再与该单质和NO在丙酮中反应生成固体I(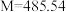 ,反应⑦),I易升华,在1810和
,反应⑦),I易升华,在1810和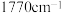 存在
存在 键的吸收峰。
键的吸收峰。(5)写出D、E、F、G、H、I的化学式。D
(6)写出反应⑤⑦的方程式。⑤
您最近一年使用:0次
解题方法
4 . Ⅰ.颜料是指不溶解、只能以微粒状态分散于粘合剂中的着色剂。颜料混合时的三原色是红、黄、蓝,通过三原色可以调出其他所有颜色。物质A,B,C的溶液颜色类似于这三种颜色。
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
(1)①推出物质A,B,C,X,Y,Z的化学式,A______ ,B______ ,C______ ,X______ ,Y______ ,Z______
②写出反应①、②、④、⑤的方程式。①______ ,②______ ,④______ ,⑤______
(2)指出物质A、B、C的颜色。A______ ,B______ ,C______ ,
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。 、
、 、
、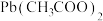 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(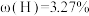 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
(3)①通过计算和推理写出物质D、E、F的化学式。D______ ,E______ ,F______ ,
②写出反应⑨的方程式。______
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。______ ,
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓
 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。(1)①推出物质A,B,C,X,Y,Z的化学式,A
②写出反应①、②、④、⑤的方程式。①
(2)指出物质A、B、C的颜色。A
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。
 、
、 、
、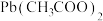 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(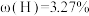 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。(3)①通过计算和推理写出物质D、E、F的化学式。D
②写出反应⑨的方程式。
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。
您最近一年使用:0次
名校
解题方法
5 . 下列实验方案中,不能测定 和
和 混合物中
混合物中 质量分数的是
质量分数的是
 和
和 混合物中
混合物中 质量分数的是
质量分数的是| A.取ag混合物与足量稀硫酸充分反应,逸出气体干燥后用碱石灰吸收,增重bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 |
| C.取ag混合物充分加热,固体质量减少bg |
D.取ag混合物与足量 溶液充分反应,得bg溶液 溶液充分反应,得bg溶液 |
您最近一年使用:0次
2022-11-05更新
|
394次组卷
|
4卷引用:甘肃省天水市2023-2024学年高一上学期10月份化学竞赛试卷
解题方法
6 . 为了减少煤燃烧产生的二氧化硫的排放,可以采取各种方法,其中一种方法是使用微生物脱硫技术。煤炭中以FeS2形式存在的硫,在有水和空气存在的条件下,用脱硫微生物起氧化还原作用:在细菌作用下FeS2 中的硫元素首先被氧化最高价态,然后亚铁离子继续被氧化成高价铁离子。
(1)请分别写出上述过程总离子反应方程式___________ 。
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸___________ 吨;硫酸铁___________ 吨。
(1)请分别写出上述过程总离子反应方程式
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸
您最近一年使用:0次
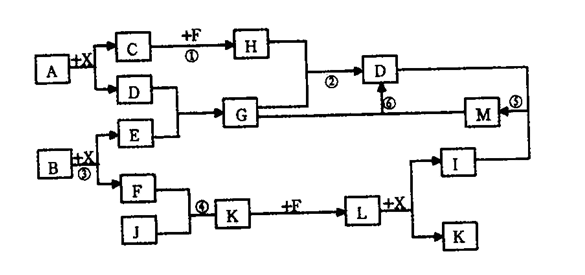
7 . 已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为25% ,B的焰色反应呈黄色,C、J、X是同周期的元素的氢化物,X为无色液体,C、J为气体,D是一种不溶于水的白色固体。在一定条件下,它们有如图所示的转化关系。
试回答下列问题:
(1)写出化学式:A_______ ,E_______ ,L_______ 。
(2)在反应①~⑥中,属于氧化还原反应的是_______ 。
(3)反应③的化学方程式为_______ 。
(4)写出下列离子反应方程式:
反应②_______ ;
反应⑥_______ 。
(5)将3.4gJ气体与足量的F反应,生成 一种单质和X,恢复到25°C放出a kJ热量,写出该反应的热化学方程式:_______ 。

试回答下列问题:
(1)写出化学式:A
(2)在反应①~⑥中,属于氧化还原反应的是
(3)反应③的化学方程式为
(4)写出下列离子反应方程式:
反应②
反应⑥
(5)将3.4gJ气体与足量的F反应,生成 一种单质和X,恢复到25°C放出a kJ热量,写出该反应的热化学方程式:
您最近一年使用:0次
名校
解题方法
8 . 将a g CuO和铜粉的混合物样品加入到体积为1L的H2SO4和Fe2(SO4)3的混合溶液中,样品完全溶解,溶液中只有Fe2+、Cu2+、H+三种阳离子,且三种阳离子物质的量之比为5︰3︰1(不考虑盐的水解及溶液体积的变化)。若测得反应后溶液的c(H+)=0.1 mol/L,下列说法正确的是
| A.原溶液中c(H2SO4)为0.05 mol/L |
| B.向反应前的溶液中加入足量铁粉,产生的气体体积为4.48L |
| C.混合物中铜的质量分数为60% |
| D.将足量的H2通入灼热的混合物,反应结束后,混合物的质量减少了0.8g |
您最近一年使用:0次
2021-08-06更新
|
1247次组卷
|
10卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
2023年广西高中学生竞赛(高一、高二同卷)化学试题2023年第37届中国化学奥林匹克广西预选赛化学试题重庆市南开中学2020-2021学年高一上学期期末考试化学试题(已下线)专题六 铁及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)江苏省泰州中学2021-2022学年高一上学期第二次月度检测化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题重庆市第七中学校2021-2022高一上学期第四次月检测化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题
9 . 由铜粉、铁粉、无水硫酸铜粉末组成的混合物22.4g,等分为两份。第一份投入有足量水的甲烧杯后充分搅拌,最终剩下8.00g 固体;第二份置于乙烧杯中,加入足量的91.5g稀硫酸,搅拌并充分反应后,杯中留有2.50g红色固体和100g浅绿色溶液(溶液中只含有一种溶质FeSO4)。求:
(1)原22.4g混合物中CuSO4的质量___________
(2)乙烧杯溶液中FeSO4的质量分数___________ 。
(1)原22.4g混合物中CuSO4的质量
(2)乙烧杯溶液中FeSO4的质量分数
您最近一年使用:0次
2021-08-04更新
|
718次组卷
|
4卷引用:第24届(2010年)全国高中学生化学竞赛广西赛区初赛试题
第24届(2010年)全国高中学生化学竞赛广西赛区初赛试题(已下线)单科化学-2021年秋季高三开学摸底考试卷03(课标全国专用)浙江省舟山市2021-2022学年高三下学期第二次模拟考试化学试题(已下线)第三章 金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)
10 . 欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:①反应中除生成NO2气体外还会有少量的NO生成;②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如图所示的实验装置。
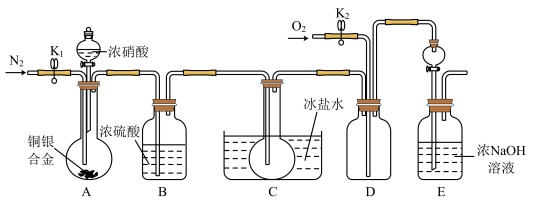
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___________ 。
(2)写出A瓶中Cu与硝酸可能反应的离子方程式___________ 。
(3)装置中B瓶的作用是___________ 。
(4)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是___________ 。
(5)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___________ 。
(6)C装置烧瓶中的物质是___________ ,用简单的实验证实你的判断:___________ 。
(7)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是___________ 。
(8)若实验只测定Cu的质量分数,不验证NO的产生,则在铜银合金与浓硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程:___________ 。

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是
(2)写出A瓶中Cu与硝酸可能反应的离子方程式
(3)装置中B瓶的作用是
(4)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是
(5)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
(6)C装置烧瓶中的物质是
(7)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是
(8)若实验只测定Cu的质量分数,不验证NO的产生,则在铜银合金与浓硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程:
您最近一年使用:0次



