名校
1 . 中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
I.
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和 ClO-的物质的量分数(α)随pH变化的关系如图所示。
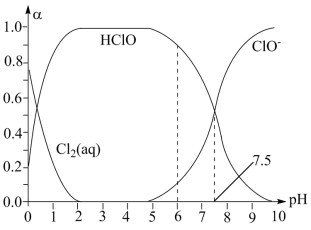
由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=___________ 时杀菌效果强;当pH=7.5时,氯水中含氯元素的微粒有HClO、ClO-和___________ 。
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是___________ ;在使用时不能与洁厕灵(主要成分为盐酸)混合使用,混合时会产生黄绿色的有毒气体,其反应的离子方程式为___________ 。
(3) 是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为:
是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为: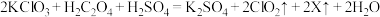 ,X的化学式为
,X的化学式为___________ ,每生成1mol ClO2,反应中转移电子___________ mol。
II.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。
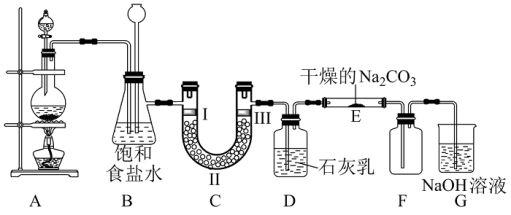
(4)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为___________ 。
(5)装置E中潮湿的Cl2与Na2CO3以物质的量比2:1反应,生成Cl2O气体,试写出该反应的化学方程式:___________ 。
I.
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气—氯水体系,该体系中Cl2(aq)、HClO和 ClO-的物质的量分数(α)随pH变化的关系如图所示。

由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是
(3)
 是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为:
是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为: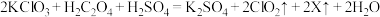 ,X的化学式为
,X的化学式为II.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。

(4)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为
(5)装置E中潮湿的Cl2与Na2CO3以物质的量比2:1反应,生成Cl2O气体,试写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 合成氨是重要的研究课题。粮食生产依赖于合成氨工业,氨也被认为是一种具有潜在应用前景的能源载体。
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。

①加热氯化铵和石灰反应的化学方程式是_______ 。
②将方框中的收集装置补充完整_______ 。
③用湿润的红色石蕊试纸检验NH3,_______ (填现象),说明检出NH3。
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:

①上述过程中吸收能量的是_______ (填写序号)。
②工业合成氨的化学方程式是:_______ 。
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:
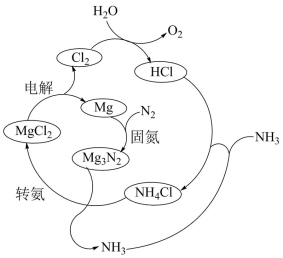
①合成氨的总反应方程式是_______ 。
②实验研究:查阅资料,同位素示踪法可以证实 中的氮元素在“转氨”过程中能转变为氨。
中的氮元素在“转氨”过程中能转变为氨。
实验:将_______ (填化学式)两种物质混合,充分反应。
检测结果:经探测仪器检测,所得氨气中存在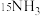 。
。
③测量 的转化率:取固体
的转化率:取固体 、NH4Cl的混合物
、NH4Cl的混合物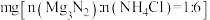 ,混匀,充分反应。生成的NH3与
,混匀,充分反应。生成的NH3与 的H2SO4恰好完全反应。
的H2SO4恰好完全反应。 的转化率为
的转化率为_______ 。( 摩尔质量为
摩尔质量为 、
、 摩尔质量为
摩尔质量为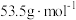 )
)
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。

①加热氯化铵和石灰反应的化学方程式是
②将方框中的收集装置补充完整
③用湿润的红色石蕊试纸检验NH3,
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:

①上述过程中吸收能量的是
②工业合成氨的化学方程式是:
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:

①合成氨的总反应方程式是
②实验研究:查阅资料,同位素示踪法可以证实
 中的氮元素在“转氨”过程中能转变为氨。
中的氮元素在“转氨”过程中能转变为氨。实验:将
检测结果:经探测仪器检测,所得氨气中存在
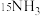 。
。③测量
 的转化率:取固体
的转化率:取固体 、NH4Cl的混合物
、NH4Cl的混合物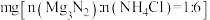 ,混匀,充分反应。生成的NH3与
,混匀,充分反应。生成的NH3与 的H2SO4恰好完全反应。
的H2SO4恰好完全反应。 的转化率为
的转化率为 摩尔质量为
摩尔质量为 、
、 摩尔质量为
摩尔质量为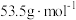 )
)
您最近一年使用:0次
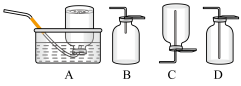
3 . 如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
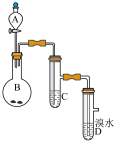
(1)实验开始前,首先进行的操作是___ ;
(2)实验室制备乙炔的方程式为___ ;
(3)仪器A在安装前必须进行的操作是___ ,为防止气体生成的速率过快,由A滴入B的试剂为___ 。
(4)装置C可选用的试剂为___ (写出一种即可),其作用为___ ;
(5)反应开始后,D中的现象为___ ,所发生反应的反应类型为___ ;
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___ 。

(1)实验开始前,首先进行的操作是
(2)实验室制备乙炔的方程式为
(3)仪器A在安装前必须进行的操作是
(4)装置C可选用的试剂为
(5)反应开始后,D中的现象为
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是

您最近一年使用:0次
2019-11-13更新
|
863次组卷
|
4卷引用:安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题
安徽省合肥市第八中学2021-2022学年高二下学期实验班开学考化学试题云南省云天化中学2019-2020学年高二上学期期中考试化学试题(已下线)2.2.2 炔烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)第二章 烃
名校
4 . I.对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混合物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘______ 。
(2)除去食盐溶液中的水______ 。
(3)淡化海水______ 。
(4)KCl中含有KClO3______ 。
II.根据以下装置图,回答下列问题:
写出仪器名称②______ ③ ______ ;仪器①~④中,使用时必须检查是否漏水的有 ______ (填序号)。
III.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。
(1)过氧化钠与水反应的化学方程式是______ 。
(2)装置I是制备纯净的______ (填化学式)。则装置I中最适宜的试剂组合是 __ (填字母) 。
a. 稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是______ ;
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是______ 。
(1)提取碘水中的碘
(2)除去食盐溶液中的水
(3)淡化海水
(4)KCl中含有KClO3
II.根据以下装置图,回答下列问题:

写出仪器名称②
III.某课外活动小组设计下列实验装置,验证“二氧化碳与水接触时才能和过氧化钠反应”。

(1)过氧化钠与水反应的化学方程式是
(2)装置I是制备纯净的
a. 稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)实验时,应先打开弹簧夹K2,关闭K1,观察到预期现象后,打开K1,再关闭K2。
(4)实验过程中将带火星的木条置于a口,观察到带火星的木条始终不复燃。
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2参与了反应,原因是
您最近一年使用:0次
解题方法
5 . 元素的价类二维图是学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图象(如图)。依据图中氮及其化合物的转化关系,回答下列问题:

(1)如图中,X的化学式为___________ ;写出 与
与 催化氧化生成NO的化学方程式
催化氧化生成NO的化学方程式___________ 。
(2)铜与浓硝酸反应的实验现象为:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。铜与浓硝酸反应的离子方程式为___________ ,某同学推测反应后溶液呈绿色的原因是 在溶液中达到饱和,
在溶液中达到饱和, 的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。请你设计实验验证他的猜想:
的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。请你设计实验验证他的猜想:___________ 。
(3)为了有效实现NO和 的相互转化,设计如下实验:按如图组装好实验装置,并检查装置气密性,实验前用排水法在烧瓶中收集半瓶NO气体。打开止水夹a,缓慢推动针筒活塞,使适量氧气进入烧瓶。关上止水夹a,预测烧瓶中的现象是
的相互转化,设计如下实验:按如图组装好实验装置,并检查装置气密性,实验前用排水法在烧瓶中收集半瓶NO气体。打开止水夹a,缓慢推动针筒活塞,使适量氧气进入烧瓶。关上止水夹a,预测烧瓶中的现象是___________ 。


(1)如图中,X的化学式为
 与
与 催化氧化生成NO的化学方程式
催化氧化生成NO的化学方程式(2)铜与浓硝酸反应的实验现象为:反应剧烈进行,铜丝逐渐变细,溶液变绿,试管上方出现红棕色气体。铜与浓硝酸反应的离子方程式为
 在溶液中达到饱和,
在溶液中达到饱和, 的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。请你设计实验验证他的猜想:
的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。请你设计实验验证他的猜想:(3)为了有效实现NO和
 的相互转化,设计如下实验:按如图组装好实验装置,并检查装置气密性,实验前用排水法在烧瓶中收集半瓶NO气体。打开止水夹a,缓慢推动针筒活塞,使适量氧气进入烧瓶。关上止水夹a,预测烧瓶中的现象是
的相互转化,设计如下实验:按如图组装好实验装置,并检查装置气密性,实验前用排水法在烧瓶中收集半瓶NO气体。打开止水夹a,缓慢推动针筒活塞,使适量氧气进入烧瓶。关上止水夹a,预测烧瓶中的现象是
您最近一年使用:0次
名校
6 . 无机非金属材料与人类社会的发展与进步息息相关,硅元素更是无机非金属材料的主角,地壳质量的90%以上是二氧化硅和硅酸盐。回答下列问题:
(1)烧制普通玻璃的原料是纯碱、石灰石和石英砂,它们在玻璃窑中发生化学变化生成CaSiO3和Na2SiO3的化学方程式为______ 、______ 。
(2)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,请设计实验验证水玻璃与盐酸反应产生少量硅酸时,形成的分散系属于胶体:______ (写出实验操作、现象和结论)。
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐。某种黏土的主要成分为Al2Si2O5(OH)4,将其表示为氧化物的形式为xAl2O3·ySiO2·zH2O,则x:y:z=_____ 。
(4)高纯度单晶硅可以按下列方法制备:SiO2 Si(粗)
Si(粗) SiHCl3
SiHCl3 高纯度单晶硅
高纯度单晶硅
①写出SiO2转化为Si(粗)的化学方程式:_____ 。
②SiHCl3被H2还原为Si(纯)的基本反应类型为_____ 。
③写出高纯度单晶硅在信息技术或新能源技术等领域的应用:_____ (任写一种)。
(1)烧制普通玻璃的原料是纯碱、石灰石和石英砂,它们在玻璃窑中发生化学变化生成CaSiO3和Na2SiO3的化学方程式为
(2)工业上可利用水玻璃和盐酸反应制备硅酸凝胶后,进一步脱水处理可得到硅胶,请设计实验验证水玻璃与盐酸反应产生少量硅酸时,形成的分散系属于胶体:
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐。某种黏土的主要成分为Al2Si2O5(OH)4,将其表示为氧化物的形式为xAl2O3·ySiO2·zH2O,则x:y:z=
(4)高纯度单晶硅可以按下列方法制备:SiO2
 Si(粗)
Si(粗) SiHCl3
SiHCl3 高纯度单晶硅
高纯度单晶硅①写出SiO2转化为Si(粗)的化学方程式:
②SiHCl3被H2还原为Si(纯)的基本反应类型为
③写出高纯度单晶硅在信息技术或新能源技术等领域的应用:
您最近一年使用:0次
名校
7 . 硫及其化合物在生产中应用广泛。
(1)古文献《新修本草》关于绿矾 的记载:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中记录:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
的记载:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中记录:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
①实验室检验绿矾变质的试剂是___________ (填化学式,下同)溶液。
②“青矾厂气”中一定含有___________ ,赤色固体可能是___________ 。
(2)“价类二维”和“性质决定用途”是化学学科的两种重要思维方式。部分含硫物质的分类与相应硫元素的化合价关系如图所示。
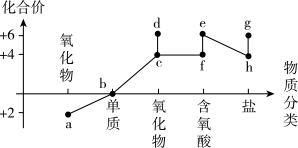
①下列物质能与d反应,但不属于氧化还原反应的是___________ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. D.
D. 溶液
溶液
②f的钠盐长期放置容易变质,原因为___________ (用化学方程式表示)。
③为确认工业废气中含有c和d,将其通入依次以下装置。
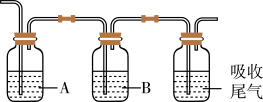
A、B中供选择的试剂有:a.品红 b. c.
c. d.
d. e.浓硫酸
e.浓硫酸
B中溶液为___________ (填标号),可观察到A中的现象为___________ 。
(3)硫酸的产量是衡量一个国家无机化工发展水平的标志。甲、乙两位同学用铜和硫酸作原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即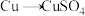 。
。
方案乙: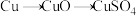 。
。
①方案甲中,铜和浓硫酸发生反应的化学方程式是___________ 。该反应体现了浓硫酸的___________ 。
②这两种方案,你认为哪一种方案更合理?___________ 。理由是___________ 。
(1)古文献《新修本草》关于绿矾
 的记载:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中记录:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
的记载:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中记录:“青矾厂气熏人,衣服当之易烂。栽木不茂”。①实验室检验绿矾变质的试剂是
②“青矾厂气”中一定含有
(2)“价类二维”和“性质决定用途”是化学学科的两种重要思维方式。部分含硫物质的分类与相应硫元素的化合价关系如图所示。

①下列物质能与d反应,但不属于氧化还原反应的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. D.
D. 溶液
溶液②f的钠盐长期放置容易变质,原因为
③为确认工业废气中含有c和d,将其通入依次以下装置。

A、B中供选择的试剂有:a.品红 b.
 c.
c. d.
d. e.浓硫酸
e.浓硫酸B中溶液为
(3)硫酸的产量是衡量一个国家无机化工发展水平的标志。甲、乙两位同学用铜和硫酸作原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即
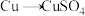 。
。方案乙:
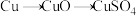 。
。①方案甲中,铜和浓硫酸发生反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
您最近一年使用:0次
解题方法
8 . 部分含铜物质的分类与相应化合价关系如图1所示, 胆矾受热分解过程的热重曲线(样品质量随温度变化的曲线)如图2所示。回答下列问题:
胆矾受热分解过程的热重曲线(样品质量随温度变化的曲线)如图2所示。回答下列问题:

(1)将图1中可溶性的f与a同时加入含 的电镀废液中,可将
的电镀废液中,可将 转化为沉淀而除去,该反应的离子方程式为
转化为沉淀而除去,该反应的离子方程式为_______ 。
(2)图1中d的新制悬浊液可用于测定血液中葡萄糖的含量,该反应的现象为_______ 。
(3)综合考虑环保和成本,设计由图1中a制备硫酸盐溶液的合理实验方案:_______ 。
(4)结合图2信息推测:b和c中,高温下更稳定的是_______ (填化学式),其理由为_______ 。
(5)由图2推断: 时固体物质的化学式为
时固体物质的化学式为_______ 。
(6)胆矾中水分子与铜离子的结合方式_______ (填“相同”或“不同”),其理由为_______ 。
 胆矾受热分解过程的热重曲线(样品质量随温度变化的曲线)如图2所示。回答下列问题:
胆矾受热分解过程的热重曲线(样品质量随温度变化的曲线)如图2所示。回答下列问题:
(1)将图1中可溶性的f与a同时加入含
 的电镀废液中,可将
的电镀废液中,可将 转化为沉淀而除去,该反应的离子方程式为
转化为沉淀而除去,该反应的离子方程式为(2)图1中d的新制悬浊液可用于测定血液中葡萄糖的含量,该反应的现象为
(3)综合考虑环保和成本,设计由图1中a制备硫酸盐溶液的合理实验方案:
(4)结合图2信息推测:b和c中,高温下更稳定的是
(5)由图2推断:
 时固体物质的化学式为
时固体物质的化学式为(6)胆矾中水分子与铜离子的结合方式
您最近一年使用:0次
9 . 某化学实验小组拟用下图装置进行钠与氧气反应的实验。
(1)将一小块钠放在石棉网上加热,能观察到的实验现象有______________________ , 写出发生反应的化学方程式:________________ 。
(2)上述实验中还观察到有黑色固体物质生成,其原因可能为2Na+CO2 C+Na2O2或4Na+3CO2
C+Na2O2或4Na+3CO2 C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的
C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的__________ 反应,也属于__________ (填“氧化还原”或“非氧化还原”)反应。

(1)将一小块钠放在石棉网上加热,能观察到的实验现象有
(2)上述实验中还观察到有黑色固体物质生成,其原因可能为2Na+CO2
 C+Na2O2或4Na+3CO2
C+Na2O2或4Na+3CO2 C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的
C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的
您最近一年使用:0次
2019-09-25更新
|
947次组卷
|
9卷引用:安徽省滁州市定远县炉桥中学2020-2021学年高一上学期第二次月考化学试题
安徽省滁州市定远县炉桥中学2020-2021学年高一上学期第二次月考化学试题人教版新教材化学同步2.1.1 活泼的金属单质——钠 练习(1)(已下线)2.1.1 活泼的金属单质——钠 练习(2)——《高中新教材同步备课》(人教版 必修第一册)(已下线)2.1.1 活泼的金属单质----钠(精练)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)2.1.1 活泼的金属单质----钠(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)专题2.1.1 钠及其氧化物(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)第2章第一节第1课时活泼的金属单质——钠(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)新疆巴楚县第一中学2021-2022学年高一上学期期中考试化学试题【定心卷】2.2.1 活泼的金属单质—钠随堂练习-人教版2023-2024学年必修第一册
10 . 根据如图所示装置(部分仪器已略去)回答下列有关问题。

(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________ (填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是________ ,通过实验甲可证明______ (填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:_________ ,棉花着火说明该反应的特点是_________
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为_________ 。

(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为
您最近一年使用:0次
2019-11-26更新
|
575次组卷
|
14卷引用:2018-2019学年人教版高中化学必修一:18-19 章末综合测评3 金属及其化合物
2018-2019学年人教版高中化学必修一:18-19 章末综合测评3 金属及其化合物安徽省定远县育才学校2020-2021学年高一上学期11月质量检测化学试题(已下线)2012-2013学年福建省师大附中度高一上学期期末考试化学试卷内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(B卷)云南省玉溪市江川二中2019-2020学年高一上学期期中考试化学试题(已下线)2.1.2 钠的几种化合物 焰色试验(精练)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)黑龙江省肇东市第四中学校2020-2021学年高一上学期期中考试化学试题山东省临沂外国语学校2020-2021学年高一上学期10月月考化学试题海南省东方市八所中学2020-2021学年高一上学期期中考试化学试题江西省上饶市铅山县第一中学2020-2021学年高一上学期联考(统招班)化学试题浙江省平湖市当湖高级中学2021-2022学年高一上学期第一次月考化学试题云南省玉龙县第一中学2021-2022学年高一下学期3月份考试化学试题湖南省张家界市慈利县2020-2021学年高一上学期期中教学质量检测化学试题(已下线)专题01钠及其重要化合物 一题多问



