解题方法
1 . 某研究小组用工业钛白副产品为原料制备纳米级电池材料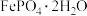 ,按如下流程开展实验。
,按如下流程开展实验。 ,含少量的
,含少量的 、
、 、
、 等杂质。
等杂质。
②已知 和
和 的氧化性随酸性的增强而增强。
的氧化性随酸性的增强而增强。
请回答:
(1)常温下步骤Ⅰ所得料液其pH___________ 7(填“>”、“<”)。
(2)下列说法不正确 的是___________。
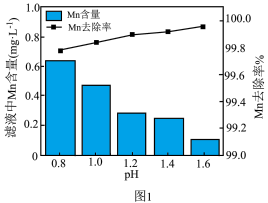
(3)步骤Ⅴ中Mn元素的去除率及滤液中Mn元素含量随着溶液pH值的关系如图1所示,___________ 。
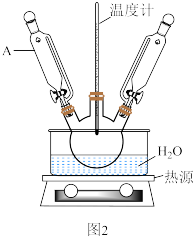
(4)步骤Ⅵ操作之一采用如图2所示装置进行(忽略夹持装置),仪器A的名称是___________ ;该操作不宜用酒精灯直接加热的原因是___________ 。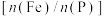 是衡量磷酸铁品质最关键的指标。
是衡量磷酸铁品质最关键的指标。
Fe元素的定量测定:①配置一系列pH=3~5, 浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺(
浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺( )溶液,调pH=3~5,加入邻菲罗啉。③进行比色
)溶液,调pH=3~5,加入邻菲罗啉。③进行比色
①通过比色能获得Fe元素浓度的原理是___________ 。
②测得产品中铁磷比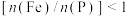 ,可能原因是
,可能原因是___________ 。
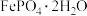 ,按如下流程开展实验。
,按如下流程开展实验。
 ,含少量的
,含少量的 、
、 、
、 等杂质。
等杂质。②已知
 和
和 的氧化性随酸性的增强而增强。
的氧化性随酸性的增强而增强。请回答:
(1)常温下步骤Ⅰ所得料液其pH
(2)下列说法
| A.步骤Ⅱ,加入Fe粉的目的是调节溶液pH值,以便Ti元素水解沉淀 |
B.步骤Ⅲ,加入 的目的是除去Mg元素 的目的是除去Mg元素 |
| C.为了提高实验效率,可以将Ⅱ、Ⅲ、Ⅴ的过滤操作合并 |
D.步骤Ⅳ中过量的 可在步骤Ⅴ中被氧化去除 可在步骤Ⅴ中被氧化去除 |
(3)步骤Ⅴ中Mn元素的去除率及滤液中Mn元素含量随着溶液pH值的关系如图1所示,
(4)步骤Ⅵ操作之一采用如图2所示装置进行(忽略夹持装置),仪器A的名称是
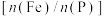 是衡量磷酸铁品质最关键的指标。
是衡量磷酸铁品质最关键的指标。Fe元素的定量测定:①配置一系列pH=3~5,
 浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺(
浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺( )溶液,调pH=3~5,加入邻菲罗啉。③进行比色
)溶液,调pH=3~5,加入邻菲罗啉。③进行比色①通过比色能获得Fe元素浓度的原理是
②测得产品中铁磷比
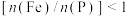 ,可能原因是
,可能原因是
您最近一年使用:0次
2 . 以锗石矿A(化学式为 )为原料,可以实现如下转化。
)为原料,可以实现如下转化。
请回答:
(1)D的化学式为___________ ,液体E的沸点___________  (填“高于”或“低于”)。
(填“高于”或“低于”)。
(2)下列说法不正确 的是___________。
(3)已知液体E以物质的量之比1∶1与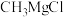 反应,该反应可用来构建
反应,该反应可用来构建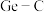 键,写出步骤Ⅲ的化学方程式
键,写出步骤Ⅲ的化学方程式___________ 。
(4)写出溶液G中所有的阴离子___________ ,设计实验证明溶液G中含有Cu元素___________ 。
 )为原料,可以实现如下转化。
)为原料,可以实现如下转化。
请回答:
(1)D的化学式为
 (填“高于”或“低于”)。
(填“高于”或“低于”)。(2)下列说法
| A.气体B是形成酸雨的成分之一 | B.固体C中可能含有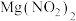 |
C. 也能与浓盐酸反应 也能与浓盐酸反应 | D.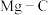 键强于 键强于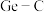 键 键 |
(3)已知液体E以物质的量之比1∶1与
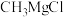 反应,该反应可用来构建
反应,该反应可用来构建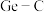 键,写出步骤Ⅲ的化学方程式
键,写出步骤Ⅲ的化学方程式(4)写出溶液G中所有的阴离子
您最近一年使用:0次
名校
3 . 高纯镓广泛用于半导体、光电材料等领域。可以利用炼锌渣(主要含ZnO、CuO、 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应: 。
。
③室温时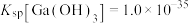 ;
;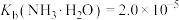 。
。
④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1) 的价层电子排布式为
的价层电子排布式为_____ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为_____ 。
(2)黄钠铁矾的化学式为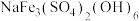 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式_____ 。
(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成 胶体,不容易过滤;②
胶体,不容易过滤;②_____ ;③_____ 。
(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是_____ 。
(5) 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是_____ 。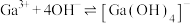 ,
,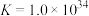 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应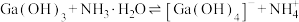 的平衡常数为
的平衡常数为_____ 。
(7)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为_____ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示: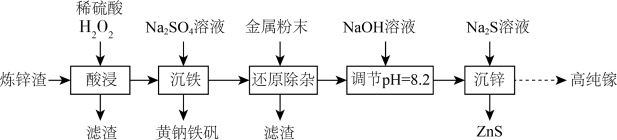
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应:
 。
。③室温时
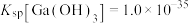 ;
;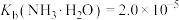 。
。④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1)
 的价层电子排布式为
的价层电子排布式为 中含有σ键的物质的量为
中含有σ键的物质的量为(2)黄钠铁矾的化学式为
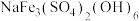 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成
 胶体,不容易过滤;②
胶体,不容易过滤;②(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是
(5)
 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是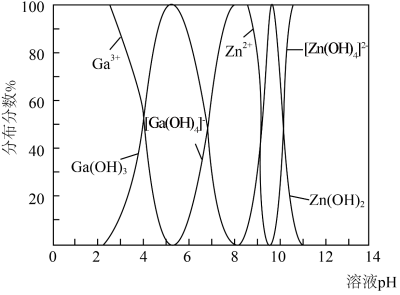
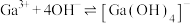 ,
,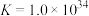 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解 ,反应
,反应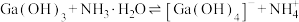 的平衡常数为
的平衡常数为(7)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。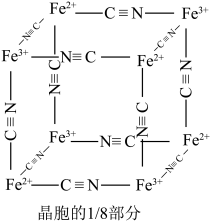
您最近一年使用:0次
4 . 碲(Te)是元素周期表中第ⅥA元素,广泛应用于半导体材料、特殊合金等领域。从碲铜渣中(含 及少量
及少量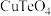 、Pb等化合物)可提取单质碲。
、Pb等化合物)可提取单质碲。
Ⅰ.干法炼碲
(1)将碲铜渣加热熔化后,向其中分批加入一定量还原碳粉,控制反应温度400~500℃,发生反应 。每消耗
。每消耗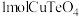 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为___________ mol。
(2)已知:常温下硫磺、单质碲的沸点分别为445℃、1390℃。将还原后的碲铜渣与稍过量硫磺混合加热,得到Cu2S、Te和硫磺混合物。将混合物置于真空炉中,控制蒸馏温度1050℃,可收集得到较纯净的Te.在真空炉中进行蒸馏的原因是___________ 。
Ⅱ.湿法提碲
(3)已知 能溶于水,
能溶于水, 难溶于水。
难溶于水。
①将一定量粉碎后的碲铜渣与NaOH、 溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。
溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。 与NaOH、
与NaOH、 反应生成
反应生成 、
、 、NaCl的离子方程式为
、NaCl的离子方程式为___________ ,滴液漏斗中的溶液是___________ 。 ,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀
,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀 充分反应后过滤(杂质不参加反应),用
充分反应后过滤(杂质不参加反应),用 的EDTA溶液滴定
的EDTA溶液滴定 至终点(EDTA与
至终点(EDTA与 反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,
反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,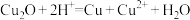 ),用相同浓度的EDTA溶液滴定
),用相同浓度的EDTA溶液滴定 至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数
至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数___________ 。(写出计算过程)
(4)已知:①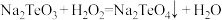 ;
;
②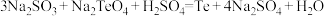 。
。
补充完整利用碱浸后含 和
和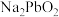 的滤液制备高纯碲的实验方案:取碱浸后的滤液,
的滤液制备高纯碲的实验方案:取碱浸后的滤液,___________ ,将所得固体烘干。(必须使用的试剂:10% 溶液,
溶液,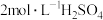 溶液,
溶液,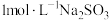 溶液,去离子水,
溶液,去离子水,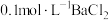 溶液)
溶液)
 及少量
及少量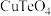 、Pb等化合物)可提取单质碲。
、Pb等化合物)可提取单质碲。Ⅰ.干法炼碲
(1)将碲铜渣加热熔化后,向其中分批加入一定量还原碳粉,控制反应温度400~500℃,发生反应
 。每消耗
。每消耗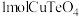 ,反应中转移电子的物质的量为
,反应中转移电子的物质的量为(2)已知:常温下硫磺、单质碲的沸点分别为445℃、1390℃。将还原后的碲铜渣与稍过量硫磺混合加热,得到Cu2S、Te和硫磺混合物。将混合物置于真空炉中,控制蒸馏温度1050℃,可收集得到较纯净的Te.在真空炉中进行蒸馏的原因是
Ⅱ.湿法提碲
(3)已知
 能溶于水,
能溶于水, 难溶于水。
难溶于水。①将一定量粉碎后的碲铜渣与NaOH、
 溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。
溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题图),90℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应后过滤。 与NaOH、
与NaOH、 反应生成
反应生成 、
、 、NaCl的离子方程式为
、NaCl的离子方程式为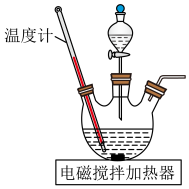
 ,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀
,可通过还原熔炼回收Cu。为确定还原剂添加量,现通过如下实验测定滤渣中各组分的质量分数:称取0.5000g样品,分成两等份。一份加入足量稀 充分反应后过滤(杂质不参加反应),用
充分反应后过滤(杂质不参加反应),用 的EDTA溶液滴定
的EDTA溶液滴定 至终点(EDTA与
至终点(EDTA与 反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,
反应的化学计量比为1:1),平均消耗EDTA溶液30.00mL;另一份加入足量稀盐酸溶解后过滤(杂质不参加反应,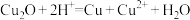 ),用相同浓度的EDTA溶液滴定
),用相同浓度的EDTA溶液滴定 至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数
至终点,平均消耗EDTA溶液20.00mL。通过计算确定滤渣中CuO的质量分数(4)已知:①
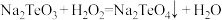 ;
;②
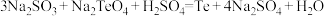 。
。补充完整利用碱浸后含
 和
和 的滤液制备高纯碲的实验方案:取碱浸后的滤液,
的滤液制备高纯碲的实验方案:取碱浸后的滤液, 溶液,
溶液,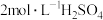 溶液,
溶液,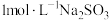 溶液,去离子水,
溶液,去离子水,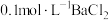 溶液)
溶液)
您最近一年使用:0次
5 . 硫代碳酸钠( )在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组利用以下实验装置测定
)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组利用以下实验装置测定 的浓度。
的浓度。 和
和 均有毒;②
均有毒;② 不溶于水,沸点为
不溶于水,沸点为 ,具有很强的挥发性,在常温下能迅速挥发为气体;
,具有很强的挥发性,在常温下能迅速挥发为气体; 与
与 的某些性质相似,与
的某些性质相似,与 作用生成
作用生成 和
和 。回答下列问题。
。回答下列问题。
(1) 的性质与
的性质与 相似,A中发生反应的化学方程式为
相似,A中发生反应的化学方程式为_______ 。
(2)上述装置按气流方向连接合理的顺序为_______ (填接口字母)。组装好仪器后,必须要进行的操作是_______ 。
(3)反应开始前,打开 ,先通入氮气一段时间,目的是
,先通入氮气一段时间,目的是_______ 。
(4)当A中反应完全后,关闭 ,打开
,打开 ,缓缓通入热
,缓缓通入热 (高于
(高于 )一段时间,其目的是
)一段时间,其目的是_______ 。
(5)为了计算该 溶液的浓度,可测定C中生成沉淀的质量。若C中生成沉淀的质量为
溶液的浓度,可测定C中生成沉淀的质量。若C中生成沉淀的质量为 ,则该
,则该 溶液的物质的量浓度是
溶液的物质的量浓度是_______ 。有同学认为也可以通过测定D中溶液质量的增加量来计算 溶液的浓度,计算结果会
溶液的浓度,计算结果会_______ (填“偏高”或“偏低”),改进的方法是_______ 。
 )在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组利用以下实验装置测定
)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组利用以下实验装置测定 的浓度。
的浓度。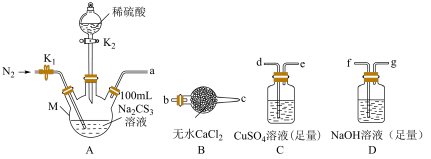
 和
和 均有毒;②
均有毒;② 不溶于水,沸点为
不溶于水,沸点为 ,具有很强的挥发性,在常温下能迅速挥发为气体;
,具有很强的挥发性,在常温下能迅速挥发为气体; 与
与 的某些性质相似,与
的某些性质相似,与 作用生成
作用生成 和
和 。回答下列问题。
。回答下列问题。(1)
 的性质与
的性质与 相似,A中发生反应的化学方程式为
相似,A中发生反应的化学方程式为(2)上述装置按气流方向连接合理的顺序为
(3)反应开始前,打开
 ,先通入氮气一段时间,目的是
,先通入氮气一段时间,目的是(4)当A中反应完全后,关闭
 ,打开
,打开 ,缓缓通入热
,缓缓通入热 (高于
(高于 )一段时间,其目的是
)一段时间,其目的是(5)为了计算该
 溶液的浓度,可测定C中生成沉淀的质量。若C中生成沉淀的质量为
溶液的浓度,可测定C中生成沉淀的质量。若C中生成沉淀的质量为 ,则该
,则该 溶液的物质的量浓度是
溶液的物质的量浓度是 溶液的浓度,计算结果会
溶液的浓度,计算结果会
您最近一年使用:0次
解题方法
6 . 铍是航天航空、火箭导弹和原子能工业不可替代的材料,有“超级金属”之称。某厂以硅铍石(主要含有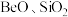 ,还有少量
,还有少量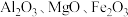 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以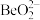 的形式存在;
的形式存在;
②氯化铍在熔融态时较难电离;
③ 为离子化合物,熔点为
为离子化合物,熔点为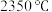 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;
④不同金属离子在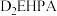 中的溶解性如表所示:
中的溶解性如表所示:
(1)“滤渣”的主要成分为_______ (填化学式)。
(2)“萃取分液”除去的离子主要是_______ 。若铍的萃取按如下反应式进行: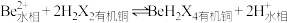 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为_______ 。
(3)“煮沸”时,发生反应的离子方程式为_______ 。
(4)写出高温条件下“转化”的化学方程式:_______ 。
(5)“电解”制铍时,加入与 等物质的量的
等物质的量的 的作用是
的作用是_______ ,不用电解 的方法制金属铍的原因是
的方法制金属铍的原因是_______ 。
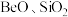 ,还有少量
,还有少量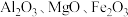 )为原料提取铍,具体流程如图。
)为原料提取铍,具体流程如图。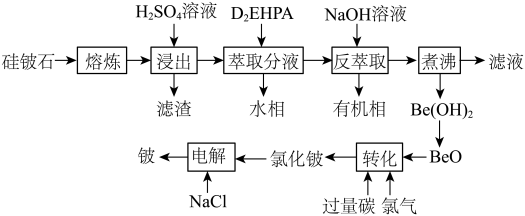
 为两性氢氧化物,在强碱溶液中以
为两性氢氧化物,在强碱溶液中以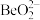 的形式存在;
的形式存在;②氯化铍在熔融态时较难电离;
③
 为离子化合物,熔点为
为离子化合物,熔点为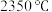 ,等物质的量的
,等物质的量的 和
和 的固体混合物在
的固体混合物在 即可熔化;
即可熔化;④不同金属离子在
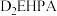 中的溶解性如表所示:
中的溶解性如表所示:金属离子 |
|
|
|
|
| 易溶 | 难溶 | 微溶 | 微溶 |
(1)“滤渣”的主要成分为
(2)“萃取分液”除去的离子主要是
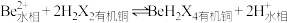 ,则“反萃取”时要加入足量
,则“反萃取”时要加入足量 溶液,发生的主要反应的化学方程式为
溶液,发生的主要反应的化学方程式为(3)“煮沸”时,发生反应的离子方程式为
(4)写出高温条件下“转化”的化学方程式:
(5)“电解”制铍时,加入与
 等物质的量的
等物质的量的 的作用是
的作用是 的方法制金属铍的原因是
的方法制金属铍的原因是
您最近一年使用:0次
7 . 工业上利用锌焙砂(主要成分为  ,含有少量
,含有少量  等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
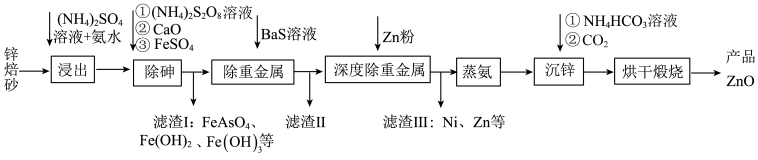
(1)用足量 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。
①“浸出”前,锌焙砂预先粉碎的目的是___________ 。
②通过“浸出”步骤,锌焙砂中的 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(2)“浸出”时 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为___________
(3)“除重金属”时,加入 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是___________ 和  。
。
(4)“蒸氨”时会出现白色固体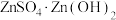 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:___________ 。
(5)“沉锌”步骤①中加入足量 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为___________ 。
(6)煅烧”步骤中,在一定温度下,煅烧 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为___________  (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。
(7)该流程中可循环利用的物质有___________ (答出任意 2 种即可)
 ,含有少量
,含有少量  等)生产高纯
等)生产高纯  的流程示意图如下。
的流程示意图如下。
(1)用足量
 溶液和氨水 “浸出” 锌焙砂。
溶液和氨水 “浸出” 锌焙砂。①“浸出”前,锌焙砂预先粉碎的目的是
②通过“浸出”步骤,锌焙砂中的
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为(2)“浸出”时
 转化为
转化为  。“除砷”步骤①中用
。“除砷”步骤①中用  作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为
作氧化剂,步骤①反应中的氧化剂与还原剂物质 的量之比为(3)“除重金属”时,加入
 溶液。滤渣II中含有的主要物质是
溶液。滤渣II中含有的主要物质是 。
。(4)“蒸氨”时会出现白色固体
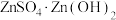 ,运用平衡移动原理解释原因:
,运用平衡移动原理解释原因:(5)“沉锌”步骤①中加入足量
 溶液将白色固体转化为
溶液将白色固体转化为  的离子方程式为
的离子方程式为(6)煅烧”步骤中,在一定温度下,煅烧
 一定时间后固体失重质量分数为
一定时间后固体失重质量分数为  ,则
,则  的分解率 为
的分解率 为 (保留到小数点后一位)。已知: 固体失重质量分数
(保留到小数点后一位)。已知: 固体失重质量分数  。
。(7)该流程中可循环利用的物质有
您最近一年使用:0次
8 . 碘化亚铜(CuI)是一种难溶于水的白色固体,能被O2氧化。
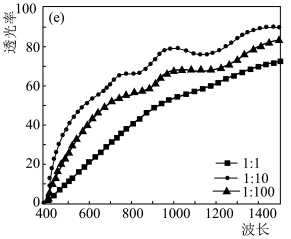
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是___________ 。
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为___________ 。___________ 。其他条件不变,溶液中铜元素的质量随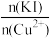 变化情况如图所示,当
变化情况如图所示,当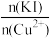 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是___________ 。 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是___________ 。
(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,___________ 。(实验中须使用的试剂和仪器有:SO2、I2、0.1 mol·L−1 NaOH、乙醇、真空干燥箱)。
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为___________ (保留一位小数)。
(1)一种碘化亚铜薄膜透光性高、电阻率低,常用于LED等光电子器件中。其简要制备方法:真空中,在硅衬底镀一层铜膜,然后碘蒸汽与铜膜反应得碘化亚铜薄膜。
①在真空中镀铜膜目的是
②实验测得不同铜碘比发生反应得到的CuI薄膜在不同波长下的透光率如图所示。合适的铜碘比为

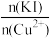 变化情况如图所示,当
变化情况如图所示,当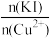 >2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是
>2.2时,随着n(KI)/n(Cu2+)增大,铜元素的质量增大,其可能原因是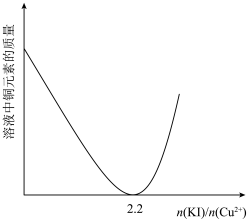
 溶液洗涤沉淀的目的是
溶液洗涤沉淀的目的是(3)硫酸铜为原料制备碘化亚铜。
补充完整制取碘化亚铜的实验方案:取25 mL 0.4mol·L−1 CuSO4溶液于三颈烧瓶中,
(4)已知荧光强度比值与Cu2+浓度关系如图所示。取0.0001 g CuI粗产品,经预处理,将Cu元素全部转化为Cu2+并定容至1000.00 mL。取1.00 mL所配溶液,测得荧光强度比值为10.2,则产品中CuI的纯度为

您最近一年使用:0次
名校
9 . 硫化钡(BaS)是一种用于制取含钡化合物和含硫化合物的化工原料。一种以BaS为原料生产氢氧化钡并获得某种副产品X和硫代硫酸钠( )的工艺流程如下:
)的工艺流程如下:
Ⅰ. 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。
Ⅱ. 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。
回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石( ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入 可发生反应生成
可发生反应生成 和
和 。下图是
。下图是 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中_______ (填“甲”或“乙”)代表 的溶解度曲线。
的溶解度曲线。 中的x可变,当
中的x可变,当 时,
时,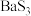 晶体的晶胞如下:
晶体的晶胞如下: ,则
,则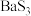 的密度为
的密度为_______  (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。
(4) 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有_______ (填标号)。
a.NaClO溶液 b.稀 溶液 c.KI溶液
溶液 c.KI溶液
(5)往母液A中加入 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为_______ 。已知温度较低时, 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是_______ 。
(6)在碱性条件下往母液B中通入 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:_______ 。
 )的工艺流程如下:
)的工艺流程如下: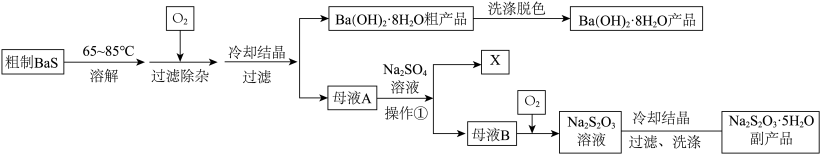
Ⅰ.
 是黄色的离子,其化学性质与
是黄色的离子,其化学性质与 类似,具有一定的还原性,在酸性环境下会分解。
类似,具有一定的还原性,在酸性环境下会分解。Ⅱ.
 在碱性环境下稳定,在酸性环境下会分解。
在碱性环境下稳定,在酸性环境下会分解。 在水中溶解度很小。
在水中溶解度很小。回答下列问题:
(1)制备BaS的方法是在高温下用无烟煤粉(主要成分为C)还原重晶石(
 ),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为
),在某温度下反应,硫元素全部被还原为最低价,同时产生两种常见气体,若两种气体在同一条件下的体积比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(2)粗制BaS溶解于温热水中配制成BaS溶液,往其中通入
 可发生反应生成
可发生反应生成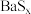 和
和 。下图是
。下图是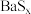 和
和 的溶解度随温度变化曲线,根据后面的流程推测,图中
的溶解度随温度变化曲线,根据后面的流程推测,图中 的溶解度曲线。
的溶解度曲线。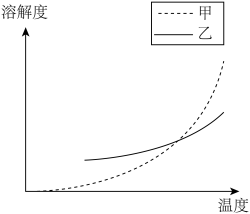
 中的x可变,当
中的x可变,当 时,
时, 晶体的晶胞如下:
晶体的晶胞如下:
 ,则
,则 的密度为
的密度为 (用含a、b、c、
(用含a、b、c、 的式子表示)。
的式子表示)。(4)
 粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有
粗产品需要进行洗涤脱色以得到较为洁净的产品,推测下列物质可以用来作为脱色剂的有a.NaClO溶液 b.稀
 溶液 c.KI溶液
溶液 c.KI溶液(5)往母液A中加入
 溶液可得到副产品X,X的化学式为
溶液可得到副产品X,X的化学式为 在水中溶解度会迅速减小。在这一步操作中
在水中溶解度会迅速减小。在这一步操作中 的用量一般为略微过量,原因是
的用量一般为略微过量,原因是(6)在碱性条件下往母液B中通入
 可将
可将 氧化为
氧化为 ,若
,若 (即用
(即用 表示
表示 ),请写出该反应的离子方程式:
),请写出该反应的离子方程式:
您最近一年使用:0次
名校
10 . 利用含锌废水制备ZnCO3·2Zn(OH)2的工艺流程如图,下列有关说法正确的是
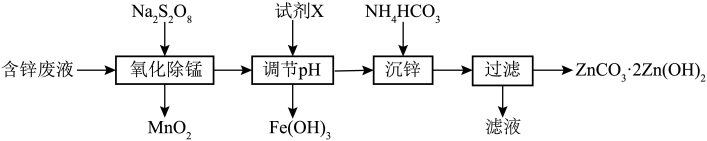
已知:①
②Zn2+ 可以与氨水反应生成[ Zn(NH3)4 ]2+

已知:①
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| Ksp | 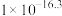 | 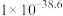 | 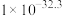 | 1.2 x 10-17 |
| A.Na2S2O8中硫元素的化合价为+7价 |
| B.氧化除锰步骤中氧化剂和还原剂的物质的量之比为2:1 |
C.沉锌时发生反应的离子方程式主要是: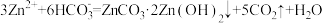 |
| D.调节pH值除铁时,应选用的试剂X为氨水,调节pH值应大于9,以便将铁完全沉淀。 |
您最近一年使用:0次






