名校
解题方法
1 . 氮循环为动植物的生长提供所需的营养物质,对生物和人类活动具有重要意义。游离态的氮气很难被植物吸收,将空气中的游离态氮转化为化合态氮的过程称为固氮,固氮的方式主要有天然固氮和人工固氮。
(1)N原子的结构示意图为_____ ,15N核内有_____ 个中子。
(2)大气固氮是在放电或高温下,空气中的N2最终转化为HNO3的过程,请将该转化过程补充完整。
(填化学式):N2→_____ HNO3.
人工固氮目前主要通过工业合成氨来实现。合成氨工业的巨大成功,改变了世界粮食生产的历史,解决了人类因人口增长所需要的粮食。1754年,人类首次在实验室制出了氨,直到1913年,才实现了合成氨的工业化生产。
(3)氨分子的电子式为_____ 。
在Haber-Bosch工艺开发前,Frank于1908年开发了一种通过碳化钙合成氨的方法。
CaCO3(s)+ C(s)=CaC2(s)+
C(s)=CaC2(s)+ CO2(g) ΔH=557.8kJ·mol
CO2(g) ΔH=557.8kJ·mol
CaC2(s)+N2(g)=CaCN2(s)+C(s) ΔH=﹣288.4kJ·mol-1
CaCN2(s)+3H2O(l)=2NH3(g)+CaCO3(s) ΔH=﹣94.2kJ·mol-1
(4)写出以N2、H2O和C为原料合成NH3的反应热化学方程式_____ 。
(5)根据热化学方程式,说明碳化钙合成氨的方法的缺点_____ 。
1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(6)关于该反应的ΔH与ΔS判断正确的是_____(单选)。
(7)将N2与H2以体积比1∶3置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____(双选)。
(8)请从化学反应速率与化学平衡的角度,分析工业合成氨条件选择的原因_____ 。
化合态的氮元素在微生物等的作用下最终返回大气,如此反复循环,建立起平衡。
(9)水体中的 ,在反硝化菌作用下与
,在反硝化菌作用下与 反应生成N2,写出发生反应的离子方程式
反应生成N2,写出发生反应的离子方程式_____ 。
(1)N原子的结构示意图为
(2)大气固氮是在放电或高温下,空气中的N2最终转化为HNO3的过程,请将该转化过程补充完整。
(填化学式):N2→
人工固氮目前主要通过工业合成氨来实现。合成氨工业的巨大成功,改变了世界粮食生产的历史,解决了人类因人口增长所需要的粮食。1754年,人类首次在实验室制出了氨,直到1913年,才实现了合成氨的工业化生产。
(3)氨分子的电子式为
在Haber-Bosch工艺开发前,Frank于1908年开发了一种通过碳化钙合成氨的方法。
CaCO3(s)+
 C(s)=CaC2(s)+
C(s)=CaC2(s)+ CO2(g) ΔH=557.8kJ·mol
CO2(g) ΔH=557.8kJ·molCaC2(s)+N2(g)=CaCN2(s)+C(s) ΔH=﹣288.4kJ·mol-1
CaCN2(s)+3H2O(l)=2NH3(g)+CaCO3(s) ΔH=﹣94.2kJ·mol-1
(4)写出以N2、H2O和C为原料合成NH3的反应热化学方程式
(5)根据热化学方程式,说明碳化钙合成氨的方法的缺点
1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)(6)关于该反应的ΔH与ΔS判断正确的是_____(单选)。
| A.ΔH与ΔS均大于0 | B.ΔH与ΔS均小于0 |
| C.ΔH大于0,ΔS小于0 | D.ΔH小于0,ΔS大于0 |
| A.体系压强保持不变 |
| B.混合气体密度保持不变 |
| C.N2和H2的体积比保持不变 |
| D.混合气体的平均相对分子质量保持不变 |
化合态的氮元素在微生物等的作用下最终返回大气,如此反复循环,建立起平衡。
(9)水体中的
 ,在反硝化菌作用下与
,在反硝化菌作用下与 反应生成N2,写出发生反应的离子方程式
反应生成N2,写出发生反应的离子方程式
您最近一年使用:0次
名校
2 . 尿素 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ: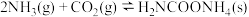 (氨基甲酸铵)
(氨基甲酸铵)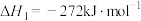
反应Ⅱ: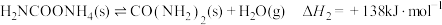
总反应Ⅲ: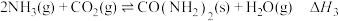
1. 的电子式为
的电子式为___________ ;
2.反应 的熵变
的熵变
___________  (填“>”“=”"或“<”),反应Ⅲ的
(填“>”“=”"或“<”),反应Ⅲ的
___________ 。
3.下列关于尿素合成的说法正确的是__________
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为 的密闭容器中,在
的密闭容器中,在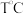 下分解:
下分解: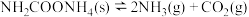 ,
, 时达到化学平衡。
时达到化学平衡。 随时间
随时间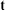 变化曲线如图所示。
变化曲线如图所示。
5.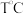 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为___________ 。
6.在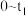 时间内该化学反应速率
时间内该化学反应速率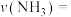
___________ 。
7.若其他条件不变, 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出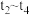 时间内
时间内 随时间
随时间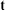 变化的曲线
变化的曲线___________ 。
 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:反应Ⅰ:
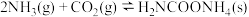 (氨基甲酸铵)
(氨基甲酸铵)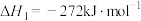
反应Ⅱ:
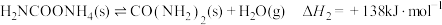
总反应Ⅲ:
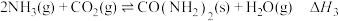
1.
 的电子式为
的电子式为2.反应
 的熵变
的熵变
 (填“>”“=”"或“<”),反应Ⅲ的
(填“>”“=”"或“<”),反应Ⅲ的
3.下列关于尿素合成的说法正确的是__________
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
D.保持压强不变,降低氨碳比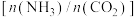 可提高反应 可提高反应 中 中 的平衡转化率 的平衡转化率 |
 的密闭容器中,在
的密闭容器中,在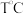 下分解:
下分解: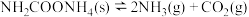 ,
, 时达到化学平衡。
时达到化学平衡。 随时间
随时间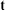 变化曲线如图所示。
变化曲线如图所示。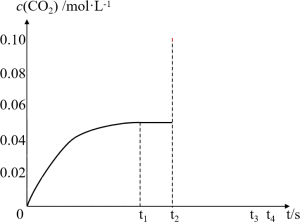
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
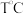 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为6.在
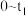 时间内该化学反应速率
时间内该化学反应速率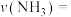
7.若其他条件不变,
 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出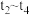 时间内
时间内 随时间
随时间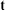 变化的曲线
变化的曲线
您最近一年使用:0次
3 . 四川广汉“三星堆”遗址出土了大量距今3000多年前的象牙,科考人员采用纤维布和聚氨酯树脂混合制成的医用高分子绷带固定保存。合成聚氨酯的一种原料是多异氰酸酯。一种异氰酸酯分子的键线式如下图。

【资料】表示有机化合物的组成和结构时,若将碳、氢元素符号省略,只表示分子中键的链接情况和官能团,每个拐点或终点均表示一个碳原子,则得到键线式。如丙烯可表示为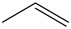 ,乙醇可表示为
,乙醇可表示为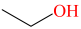 。
。
下列说法不正确的是

【资料】表示有机化合物的组成和结构时,若将碳、氢元素符号省略,只表示分子中键的链接情况和官能团,每个拐点或终点均表示一个碳原子,则得到键线式。如丙烯可表示为
 ,乙醇可表示为
,乙醇可表示为 。
。下列说法不正确的是
| A.N在元素周期表中位于第二周期ⅤA族 |
B.图中所示分子的分子式为 |
C.基团“-N=C=O”的电子式为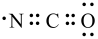 |
D.图中所示分子存在含氨基(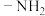 )、碳碳双键、醛基的同分异构体 )、碳碳双键、醛基的同分异构体 |
您最近一年使用:0次
名校
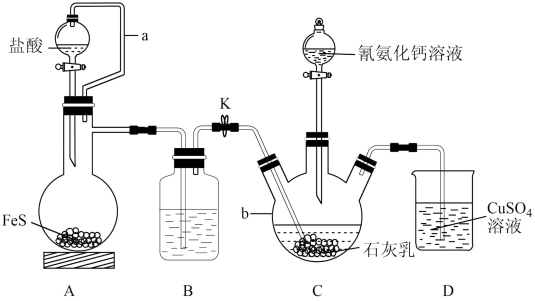
4 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(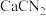 )与
)与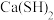 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
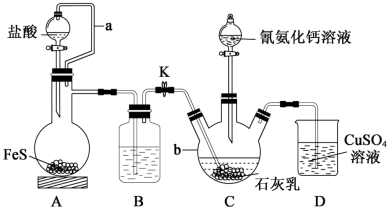
回答下列问题:
(1)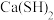 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为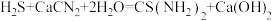 ,若反应分两步进行,写出第二步生成硫脲的化学方程式
,若反应分两步进行,写出第二步生成硫脲的化学方程式_______ 。
(5)装置D的作用为:_______ 。
(6)硫氰化铵(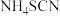 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(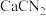 )与
)与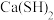 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
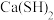 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
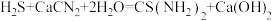 ,若反应分两步进行,写出第二步生成硫脲的化学方程式
,若反应分两步进行,写出第二步生成硫脲的化学方程式(5)装置D的作用为:
(6)硫氰化铵(
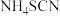 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
解题方法
5 . 丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用乙烯、丙烯等石油化工产品为原料进行合成。

(1)无机物M的电子式为___________ 。
(2)有机物B中含有的官能团是___________ (填名称),可以检验其中含氧官能团的试剂有___________ (填字母序号)。
a.Mg b.NaOH溶液 c.银氨溶液 d.石蕊试液
(3)A与B反应生成丙烯酸乙酯的化学方程式为___________ ,反应类型是___________ 。
(4)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物有较好的弹性,可用于生产织物和皮革处理剂。该聚合物的结构简式为___________ 。

(1)无机物M的电子式为
(2)有机物B中含有的官能团是
a.Mg b.NaOH溶液 c.银氨溶液 d.石蕊试液
(3)A与B反应生成丙烯酸乙酯的化学方程式为
(4)久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物有较好的弹性,可用于生产织物和皮革处理剂。该聚合物的结构简式为
您最近一年使用:0次
2022-07-02更新
|
189次组卷
|
2卷引用:河南省开封市2021-2022学年高一下学期期末调研考试化学试题
解题方法
6 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料,生物医学等领域引起广泛关注。
(1)Se在元素周期表中的位置为______ ,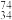 Se和
Se和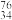 Se互为
Se互为______ ,这两种原子中子数之差的绝对值为_______ 。
(2)H2Se是一种有恶臭的气体,与H2O相比,沸点H2Se_______ H2O(填“>”或“<”,下同),原因是______ ;热稳定性:H2Se_______ H2O。
(3)较高浓度的Na2SeO2能促进细胞DNA的增殖活性,延缓细胞衰老。Na、Se、O形成的简单离子的半径由大到小的顺序为______ (填离子符号)。
(4)一种合成含Se的新型AIE分子的原料结构如图:
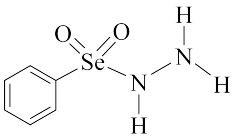
肼(N2H4)的结构与上述分子部分结构十分相似,N2H4的电子式为_______ 。
(1)Se在元素周期表中的位置为
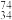 Se和
Se和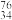 Se互为
Se互为(2)H2Se是一种有恶臭的气体,与H2O相比,沸点H2Se
(3)较高浓度的Na2SeO2能促进细胞DNA的增殖活性,延缓细胞衰老。Na、Se、O形成的简单离子的半径由大到小的顺序为
(4)一种合成含Se的新型AIE分子的原料结构如图:

肼(N2H4)的结构与上述分子部分结构十分相似,N2H4的电子式为
您最近一年使用:0次
名校
解题方法
7 . 硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1) 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为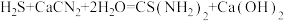 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:_______ 。
(5)装置D中可能出现的现象是_______ 。
(6)硫氰化铵( )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙( )与
)与 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
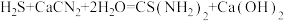 ,若反应分两步进行,写出第二步生成硫脲的化学方程式:
,若反应分两步进行,写出第二步生成硫脲的化学方程式:(5)装置D中可能出现的现象是
(6)硫氰化铵(
 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
2022-04-16更新
|
440次组卷
|
3卷引用:河北省名校联盟2021-2022学年高三下学期4月质量检测化学试题
名校
8 . 次氯酸可以和丙烯发生加成反应CH3CH=CH2+HClO→CH3CH(OH)CH2Cl,以CH3CH(OH)CH2Cl为原料可以合成CH3CH(OH)COOH,进一步合成新型降解材料聚乳酸。下列化学用语表示正确的是
A.原子核内有8个中子的碳原子: | B.丙烯分子的球棍模型: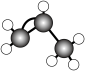 |
C.次氯酸的电子式: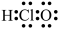 | D.聚乳酸的结构简式: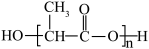 |
您最近一年使用:0次
解题方法
9 . I.回答下列问题:
(1)Sn为IVA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为____ 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为____ (填化学式,下同),还原性由强到弱的顺序为____ ,键角由大到小的顺序为____ 。
II.回答下列问题:
(3)气态氢化物热稳定性HF大于HCl的主要原因是____ 。
(4)CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是____ 。
(5)常温下,在水中的溶解度乙醇大于氯乙烷,原因是____ 。
III.回答下列问题:
(6)比较给出H+能力的相对强弱:H2O____ C2H5OH(填“>”“<”或“=”);用一个化学方程式说明OH-和C2H5O-结合H+能力的相对强弱:____ 。
(7)CaC2是离子化合物,各原子均满足8电子稳定结构.写出CaC2的电子式:____ 。
(8)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高,主要原因是____ 。
IV.研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(9)CO2和CH3OH分子中C原子的杂化形式分别为____ 和____ 。
(10)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____ ,原因是____ 。
(11)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____ 。
(1)Sn为IVA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为
(2)NH3、PH3、AsH3的沸点由高到低的顺序为
II.回答下列问题:
(3)气态氢化物热稳定性HF大于HCl的主要原因是
(4)CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是
(5)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
III.回答下列问题:
(6)比较给出H+能力的相对强弱:H2O
(7)CaC2是离子化合物,各原子均满足8电子稳定结构.写出CaC2的电子式:
(8)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高,主要原因是
IV.研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(9)CO2和CH3OH分子中C原子的杂化形式分别为
(10)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(11)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
您最近一年使用:0次
名校
解题方法
10 . 氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生产氮肥的原料。氮及其部分化合物的转化关系如图所示,回答下列问题:
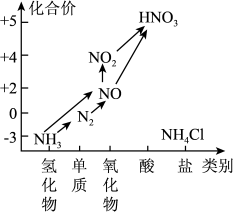
(1)下列反应中,不属于氮的固定的是_______
(2)氨的电子式是_______ 。
(3)在物质转化图中的各气体,可用排水法收集的气体是_______ (填化学式,下同),既可以用浓硫酸干燥,又可以用碱石灰干燥的是气体是_______ 。
(4)实验室常用NH4Cl与Ca(OH)2制取氨气,请写出该反应的化学方程式_______ 。而工业上则由氮气和氢气直接合成氨,该反应的化学方程式为_______ 。
(5)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是_______ 。
(6)氮的一种化合物肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量是_______ kJ。


(1)下列反应中,不属于氮的固定的是_______
| A.N2和H2在一定条件下合成NH3 |
| B.豆科植物把空气中的氮气转化为化合态的氮 |
| C.雷电时,空气中的N2与O2反应生成NO |
| D.由NH3制碳酸氢铵 |
(3)在物质转化图中的各气体,可用排水法收集的气体是
(4)实验室常用NH4Cl与Ca(OH)2制取氨气,请写出该反应的化学方程式
(5)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是
(6)氮的一种化合物肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量是

您最近一年使用:0次



