2024·上海·模拟预测
1 . 钯催化剂(主要成分为Pd、α-Al2O3,还含少量铁、铜等)是石油化工中催化加氢和催化氧化等反应的重要催化剂。一种从废钯催化剂中回收海绵钯的工艺流程如下:
②常温下,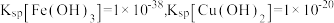 。
。
回答下列问题:
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原___________ (填化学式)。
(2)“酸浸”过程中Pd转化的离子方程式为___________ 。
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”最佳条件为___________ 。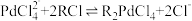 ,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是
,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是___________ 。
(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4 (稀溶液) [Pd(NH3)4]Cl2 (稀溶液)
[Pd(NH3)4]Cl2 (稀溶液) [Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为
[Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为___________ (填化学式)。
(6)N2H4的电子式为___________ 。
(7)“还原Ⅱ”过程中产生无毒无害气体。由[Pd(NH3)2]Cl2生成海绵钯的化学方程式为___________ 。
(8)H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。下列说法不正确的是 。
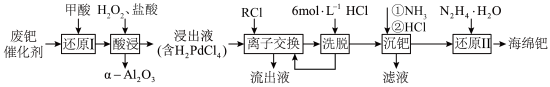
②常温下,
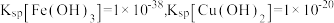 。
。回答下列问题:
(1)“还原Ⅰ”过程中加入甲酸的主要目的是还原
(2)“酸浸”过程中Pd转化的离子方程式为
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”最佳条件为

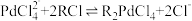 ,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是
,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。若假设流出液中各金属离子的浓度均为0.01 mol/L,常温下,需要调节pH的范围是(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4 (稀溶液)
 [Pd(NH3)4]Cl2 (稀溶液)
[Pd(NH3)4]Cl2 (稀溶液) [Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为
[Pd(NH3)2]Cl2(沉淀)。则滤液中溶质的主要成分为(6)N2H4的电子式为
(7)“还原Ⅱ”过程中产生无毒无害气体。由[Pd(NH3)2]Cl2生成海绵钯的化学方程式为
(8)H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。下列说法不正确的是 。

| A.H2O2中存在极性键和非极性键 |
| B.[PdCl4]2-中Pd2+提供空轨道形成配位键 |
| C.反应①、②、③均属于氧化还原反应 |
| D.等物质的量的H2和O2发生反应时,反应①和反应②转移的电子数之比为1:1 |
您最近一年使用:0次
名校
2 . 酸性条件下,砷酸具有较强氧化性,能被正四价硫、碘离子等还原为正三价砷。某工厂以废渣(主要含 )制备砷的流程如下:
)制备砷的流程如下:
(1)砷的原子结构示意图为_______ 。 的结构简式为
的结构简式为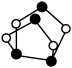 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为_______ mol。
(2)“碱浸”后溶液中含有 、
、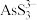 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为______________ 。
(3)“沉砷”时,加入试剂A的作用为_______ ;结合必要的化学用语说明为了提高 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是_______ 。
(4)滤渣1含硫酸钙和沉淀a,实验室里,用_______ 试剂除去试管壁上的沉淀a。
(5)加热时“再还原”的化学方程式为_______ 。“还原”中,氧化产物与还原产物的物质的量之比为_______ 。
(6)该流程中可以循环使用的物质为_______ 。
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素_______ 。
 )制备砷的流程如下:
)制备砷的流程如下: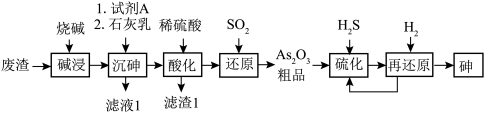
(1)砷的原子结构示意图为
 的结构简式为
的结构简式为 ,0.5mol
,0.5mol  所含有S-S键的物质的量为
所含有S-S键的物质的量为(2)“碱浸”后溶液中含有
 、
、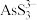 ,则该工序主反应的化学方程式为
,则该工序主反应的化学方程式为(3)“沉砷”时,加入试剂A的作用为
 的产率,加石灰乳时控制温度45℃~85℃的目的是
的产率,加石灰乳时控制温度45℃~85℃的目的是(4)滤渣1含硫酸钙和沉淀a,实验室里,用
(5)加热时“再还原”的化学方程式为
(6)该流程中可以循环使用的物质为
(7)设计实验检验“还原”后的溶液中是否存在正五价砷元素
您最近一年使用:0次
名校
3 . 氯化氰 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为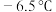 ,沸点为
,沸点为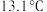 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。
(1)D装置中盛放 的仪器名称为
的仪器名称为_______ ,检验A装置气密性的方法是_______ 。
(2)A装置中发生反应生成 的离子方程式为
的离子方程式为_______ , 的作用是
的作用是_______ 。
(3)B、C装置中盛放的试剂相同,其作用是_______ 。F装置的作用是降低温度,其中干冰起作用的原因是_______ 。
(4)在 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为_______ ,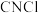 的电子式为
的电子式为_______ 。
(5)上述实验中, 完全反应时收集到
完全反应时收集到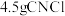 ,则产率为
,则产率为_______ %(保留2位小数)。
 ,又名氯甲氰,熔点为
,又名氯甲氰,熔点为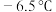 ,沸点为
,沸点为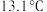 ,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知:
,剧毒,可溶于水、乙醇、乙醚等,受热易分解,易与水发生剧烈反应。某小组制备氯化氰并探究其性质的实验装置如图所示。已知: 具有较强的还原性。
具有较强的还原性。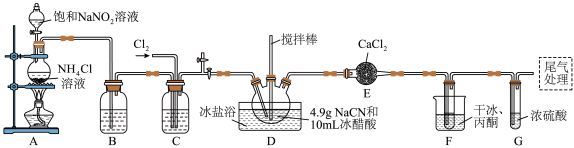
(1)D装置中盛放
 的仪器名称为
的仪器名称为(2)A装置中发生反应生成
 的离子方程式为
的离子方程式为 的作用是
的作用是(3)B、C装置中盛放的试剂相同,其作用是
(4)在
 条件下,由
条件下,由 和
和 制备氯化氰的化学方程式为
制备氯化氰的化学方程式为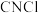 的电子式为
的电子式为(5)上述实验中,
 完全反应时收集到
完全反应时收集到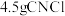 ,则产率为
,则产率为
您最近一年使用:0次
解题方法
4 . 下表为元素周期表的一部分。请回答下列问题:
(1)写出X元素的元素符号:______ 。
(2)C、N两种元素中,原子半径较小的是______ (填元素符号)。
(3)元素Y在元素周期表中的位置为______ 。
(4)写出Z的气态氢化物的电子式:______ 。
碳 | 氮 | Y | |
X | 硫 | Z |
(2)C、N两种元素中,原子半径较小的是
(3)元素Y在元素周期表中的位置为
(4)写出Z的气态氢化物的电子式:
您最近一年使用:0次
2024·上海·模拟预测
5 . MnCl2溶液与 溶液混合可制备
溶液混合可制备 晶体。
晶体。
(1)基态Mn原子的电子排布式是___________ 。
(2) 的性质与卤素离子相近,被称为拟卤离子,
的性质与卤素离子相近,被称为拟卤离子, 被称为拟卤素。
被称为拟卤素。
i. 与
与 反应的生成物的结构式分别是
反应的生成物的结构式分别是 、
、___________ 。
ii. 有酸性但乙炔无明显酸性,
有酸性但乙炔无明显酸性, 的酸性比乙炔的强的原因是
的酸性比乙炔的强的原因是___________ 。
(3)为防止晶体缺陷过多,制备时反应需缓慢且平稳。先将MnCl2溶液与柠檬酸钠______________________________________________________ 。
(4)钠离子电池的正极材料 在充、放电过程中某时刻的晶胞示意图如下。
在充、放电过程中某时刻的晶胞示意图如下。 中存在的化学键有配位键、
中存在的化学键有配位键、___________ 。
②该时刻的晶胞所示的 中,
中,
___________ 。
 溶液混合可制备
溶液混合可制备 晶体。
晶体。(1)基态Mn原子的电子排布式是
(2)
 的性质与卤素离子相近,被称为拟卤离子,
的性质与卤素离子相近,被称为拟卤离子, 被称为拟卤素。
被称为拟卤素。i.
 与
与 反应的生成物的结构式分别是
反应的生成物的结构式分别是 、
、ii.
 有酸性但乙炔无明显酸性,
有酸性但乙炔无明显酸性, 的酸性比乙炔的强的原因是
的酸性比乙炔的强的原因是(3)为防止晶体缺陷过多,制备时反应需缓慢且平稳。先将MnCl2溶液与柠檬酸钠
(4)钠离子电池的正极材料
 在充、放电过程中某时刻的晶胞示意图如下。
在充、放电过程中某时刻的晶胞示意图如下。
 中存在的化学键有配位键、
中存在的化学键有配位键、②该时刻的晶胞所示的
 中,
中,
您最近一年使用:0次
解题方法
6 . 利用零价铁(Fe)耦合过硫酸盐( )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。 的结构式是
的结构式是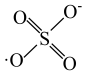 ,则
,则 的结构式是
的结构式是___________ 。
(2)过程ⅰ中反应的离子方程式是___________ 。
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)___________ 。
(4)探究零价铁和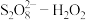 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。
Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·
a.X中加入的是___________ (填“甲醇”或“叔丁醇")。
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是___________ 。
Ⅱ.探究混合氧化剂中 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的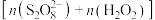 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。
a.从①到④,TOC去除率升高的原因是___________ 。
b.从④到⑦,TOC去除率下降的原因是___________ 。
 )和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基
)和过氧化氢产生自由基去除污水中的有机化合物是目前研究的热点。其中自由基 和HO·产生的机理如图所示。
和HO·产生的机理如图所示。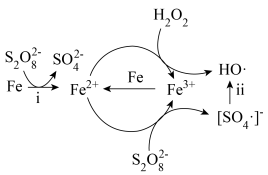
 的结构式是
的结构式是 ,则
,则 的结构式是
的结构式是(2)过程ⅰ中反应的离子方程式是
(3)过程ⅱ会导致溶液酸性增强,其中硫元素在反应前后均为+6价。该过程参与反应的物质还有(填化学式)
(4)探究零价铁和
 混合氧化剂体系降解水样中有机化合物M的能力。
混合氧化剂体系降解水样中有机化合物M的能力。Ⅰ.通过加入甲醇或叔丁醇探究不同自由基降解M的能力。测得M的残留百分含量随时间变化如图所示。
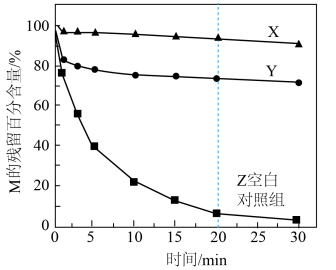
 ,叔丁醇只消耗HO·
,叔丁醇只消耗HO·a.X中加入的是
b.0~20min,Z中降解M的自由基主要是HO·,判断依据是
Ⅱ.探究混合氧化剂中
 的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的
的物质的量分数对水样中总有机碳(TOC)去除率的影响。实验开始时,水样的pH=7且加入的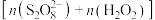 相同,其他条件不变。在相同时间内测得的实验数据如图所示。
相同,其他条件不变。在相同时间内测得的实验数据如图所示。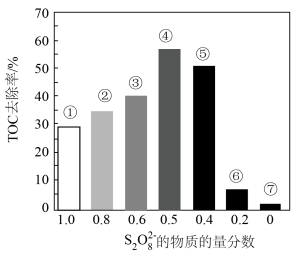
a.从①到④,TOC去除率升高的原因是
b.从④到⑦,TOC去除率下降的原因是
您最近一年使用:0次
名校
7 . 下表为元素周期表的一部分。____ 的非金属性最强;元素____ 的金属性最强;元素____ 的单质在室温下呈液态。(填元素符号)
(2)表中元素③的原子结构示意图是____ 。
(3)表中元素⑥⑦的氢化物的稳定性顺序为_____ >_____ 。(填化学式)
(4)表中元素最高价氧化物的水化物的酸性最强的是_____ (填化学式)。

(2)表中元素③的原子结构示意图是
(3)表中元素⑥⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物的水化物的酸性最强的是
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)工业以煤为燃料时,会产生大量的羰基硫 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
i氢解反应:
ii水解反应: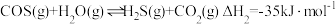
请回答下列问题:
① 的电子式为
的电子式为_________ ,分子中碳元素的化合价为_________ 。
②已知: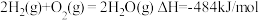
写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________________________ 。
(2)①常温下,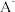 水解常数
水解常数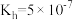 ,若
,若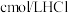 与
与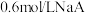 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
_________ 。
②已知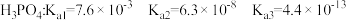 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在_________ 土壤中(填“酸性”、“中性”或“碱性”)。通过计算说明判断的依据是__________________ 。
(3)用间接电解法对 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。

①电极I的电极反应式为__________________ 。
②每处理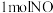 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为_________ g。
(1)工业以煤为燃料时,会产生大量的羰基硫
 ,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
,能引起催化剂中毒、化学产品质量下降、环境污染等不利影响。羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:i氢解反应:

ii水解反应:
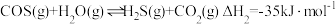
请回答下列问题:
①
 的电子式为
的电子式为②已知:
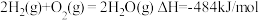
写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:(2)①常温下,
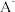 水解常数
水解常数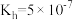 ,若
,若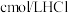 与
与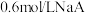 溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
溶液等体积混合后溶液呈中性(假设溶液体积具有加和性)。则
②已知
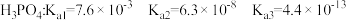 ,小王网购了一盆杜鹃花,客服告诉小王要定期施用
,小王网购了一盆杜鹃花,客服告诉小王要定期施用 肥料。由此可知,杜鹃花适宜种植在
肥料。由此可知,杜鹃花适宜种植在(3)用间接电解法对
 进行无害化处理,其原理如图所示。
进行无害化处理,其原理如图所示。
①电极I的电极反应式为
②每处理
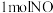 ,电解池中产生的氧气的质量为
,电解池中产生的氧气的质量为
您最近一年使用:0次
9 . 利用下图,可以从不同角度研究含硫物质的性质及其转化关系,图中物质甲~己中均含有硫元素.回答下列问题:
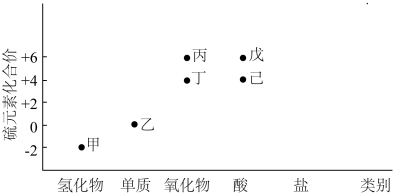
(1)写出甲的电子式:_______ ,该物质中的硫元素可表现出___________ (填“氧化性”或“还原性”);利用高温热分解甲可以获得乙,该方法的优点是______________ ,缺点是_____________ .
(2)黄铁矿(主要成分为 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是__________ (填“丙”或“丁”),该物质与水化合生成___________ (填化学名称).
(3)① 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为_______________________________ .
②同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为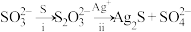 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为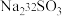 和
和 ,过程ii含硫产物是
,过程ii含硫产物是_____________ (标记出同位素原子).

(1)写出甲的电子式:
(2)黄铁矿(主要成分为
 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是(3)①
 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为②同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为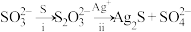 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为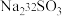 和
和 ,过程ii含硫产物是
,过程ii含硫产物是
您最近一年使用:0次
解题方法
10 . X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为 ,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为___________ ;元素Z的离子结构示意图为___________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为___________ 。
(3)元素W位于周期表的第___________ 族,其非金属性比R弱,用原子结构的知识解释原因:___________ 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:___________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
 ,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为
 ,则该反应的化学方程式为
,则该反应的化学方程式为
您最近一年使用:0次



