名校
1 . 天空课堂第二课中航天员展示了金属锆(40Zr)在无容器实验柜中从液体变成固体时的“再辉”现象。以锆英石(主要成分是ZrSiO4,还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产锆的流程如图所示:
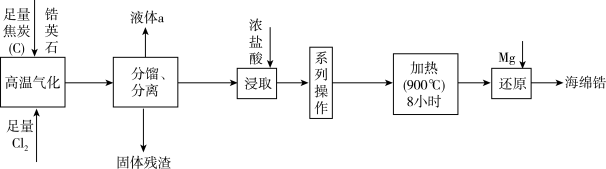
已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是_______ 。
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是_______ 。液体a的电子式是_______ 。
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是_______ 。
(4)“还原”中氧化剂是_______ (填化学式)。
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用_______
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3) Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是_______ 。
③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是_______ 。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是_______ 。

已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
(1)“高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是
(2)分馏过程中,为防止产品变质,过程中一定需要注意的是
(3)实验室中洗涤ZrOCl2·8H2O沉淀操作是
(4)“还原”中氧化剂是
(5)由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)
 Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是
您最近一年使用:0次
名校
解题方法
2 . 某课外活动小组利用下图所示装置探究甲烷与氯气的反应,回答下列问题:

(1)实验中可观察到的实验现象有:气体颜色逐渐变浅,量筒内壁出现油状液滴_______ ,_______ 等。
(2)反应后量筒内气体产物的电子式为____ ,油状液滴中非极性分子的空间构型为_____ 。
(3)实验室制备甲烷的反应方程式_______ 。
(4)从平衡移动的角度解释用排饱和食盐水的方法收集Cl2的原因_______ 。
(5)实验中生成的油状液滴中的氯仿能被空气氧化,产生剧毒气体——光气,反应的方程式为2CHCl3+O2=2COCl2+2HCl,为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是_______。
(6)若用乙烷代替甲烷进行实验,则有机产物有_______ 种。

(1)实验中可观察到的实验现象有:气体颜色逐渐变浅,量筒内壁出现油状液滴
(2)反应后量筒内气体产物的电子式为
(3)实验室制备甲烷的反应方程式
(4)从平衡移动的角度解释用排饱和食盐水的方法收集Cl2的原因
(5)实验中生成的油状液滴中的氯仿能被空气氧化,产生剧毒气体——光气,反应的方程式为2CHCl3+O2=2COCl2+2HCl,为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是_______。
| A.氢氧化钠溶液 | B.硝酸银溶液 | C.稀盐酸 | D.湿润的蓝色石蕊试纸 |
您最近一年使用:0次
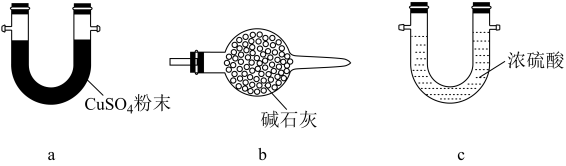
3 . 二氯化二硫 是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。
是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。

已知: 遇水发生反应
遇水发生反应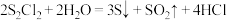 ;热稳定性差;能被
;热稳定性差;能被 氧化为
氧化为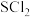 ;硫黄的熔点为113℃,沸点为445℃,
;硫黄的熔点为113℃,沸点为445℃,
回答下列问题:
(1) 电子式为
电子式为___________ 。
(2)制备 的实验步骤如下:
的实验步骤如下:
步骤1:检查装置气密性,加入硫黄,通氮气;
步骤2:一段时间后加热A中三颈烧瓶至110℃~115℃,使硫黄熔化;
步骤3:改通氯气,于115℃~125℃氯化一段时间后改通氮气;
步骤4:......;
步骤5:停止加热,持续通氮气至冷却。
①步骤1开始时需打开___________ 关闭___________ (填“ ”、“
”、“ ”或“
”或“ ”)。通氮气的目的是
”)。通氮气的目的是___________ ;步骤4是___________ 。
②证明有 生成的现象是
生成的现象是___________ 。反应过程应控制 的量,原因是
的量,原因是___________ ;装置C可选择___________ (填标号)。
(3)为测定产物纯度,实验操作如下:
Ⅰ.实验前称重B装置为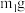 ,实验后称重为
,实验后称重为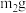 (均不包含冰盐水),取出
(均不包含冰盐水),取出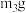 产品备用,剩余产品进行后续实验;
产品备用,剩余产品进行后续实验;
Ⅱ.撤掉装置A、C和B中冰盐水,重新更换足量的NaOH溶液,直接连接装置B、D;
Ⅲ.打开 、
、 、
、 ,并不断向B中通入水蒸气、将
,并不断向B中通入水蒸气、将 和
和 全部赶出;
全部赶出;
Ⅳ.实验结束后,取下锥形瓶,滴加几滴酚酞,用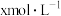 盐酸标准溶液滴定剩余的
盐酸标准溶液滴定剩余的 溶液,消耗盐酸
溶液,消耗盐酸 ;
;
Ⅴ.不加样品,做空白对照实验,消耗盐酸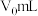 。
。
①产品中 的纯度为
的纯度为___________ (写出表达式)。
②下列操作可能会导致测定结果偏高的是___________ (填标号)。
a.水蒸气的通入时间较短
b.操作Ⅳ滴定后仰视滴定管读数
c.操作Ⅴ滴定前滴定管尖嘴处有气泡,滴定后无气泡
 是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。
是一种金黄色油状液体(沸点138℃),用作除草剂、橡胶硫化剂等。制备装置如图(夹持和加热装置略)。
已知:
 遇水发生反应
遇水发生反应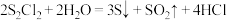 ;热稳定性差;能被
;热稳定性差;能被 氧化为
氧化为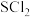 ;硫黄的熔点为113℃,沸点为445℃,
;硫黄的熔点为113℃,沸点为445℃,回答下列问题:
(1)
 电子式为
电子式为(2)制备
 的实验步骤如下:
的实验步骤如下:步骤1:检查装置气密性,加入硫黄,通氮气;
步骤2:一段时间后加热A中三颈烧瓶至110℃~115℃,使硫黄熔化;
步骤3:改通氯气,于115℃~125℃氯化一段时间后改通氮气;
步骤4:......;
步骤5:停止加热,持续通氮气至冷却。
①步骤1开始时需打开
 ”、“
”、“ ”或“
”或“ ”)。通氮气的目的是
”)。通氮气的目的是②证明有
 生成的现象是
生成的现象是 的量,原因是
的量,原因是
(3)为测定产物纯度,实验操作如下:
Ⅰ.实验前称重B装置为
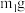 ,实验后称重为
,实验后称重为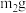 (均不包含冰盐水),取出
(均不包含冰盐水),取出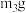 产品备用,剩余产品进行后续实验;
产品备用,剩余产品进行后续实验;Ⅱ.撤掉装置A、C和B中冰盐水,重新更换足量的NaOH溶液,直接连接装置B、D;
Ⅲ.打开
 、
、 、
、 ,并不断向B中通入水蒸气、将
,并不断向B中通入水蒸气、将 和
和 全部赶出;
全部赶出;Ⅳ.实验结束后,取下锥形瓶,滴加几滴酚酞,用
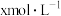 盐酸标准溶液滴定剩余的
盐酸标准溶液滴定剩余的 溶液,消耗盐酸
溶液,消耗盐酸 ;
;Ⅴ.不加样品,做空白对照实验,消耗盐酸
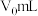 。
。①产品中
 的纯度为
的纯度为②下列操作可能会导致测定结果偏高的是
a.水蒸气的通入时间较短
b.操作Ⅳ滴定后仰视滴定管读数
c.操作Ⅴ滴定前滴定管尖嘴处有气泡,滴定后无气泡
您最近一年使用:0次
名校
4 . 在饲料添加剂中常用到碘酸钙,制备碘酸钙晶体的流程如下:

已知:碘酸钙在不同温度下的存在形态
(1)KOH的电子式为_______ 。
(2)反应1在85℃中进行,应当选用的加热方法为_______ 。温度不能太高的原因是_______ 。反应Ⅰ的其中一种产物是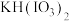 ,写出反应1的化学方程式
,写出反应1的化学方程式_______ 。
(3)操作2的名称为_______ ;醇洗的目的是_______ 。
(4)测定产品纯度的实验步骤如下:
准确称取产品mg,置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入500mL容量瓶中,用水稀释至刻度,摇匀,得试液。
准确量取所得试液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL,3g碘化钾(足量),盖上瓶塞,在暗处放置3分钟,加50mL水,用浓度为0.1000mol/L 标准溶液滴定至浅黄色,加入
标准溶液滴定至浅黄色,加入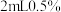 淀粉溶液,继续滴定至终点,重复实验2次,平均消耗
淀粉溶液,继续滴定至终点,重复实验2次,平均消耗 ,标准溶液nmL。
,标准溶液nmL。
滴定过程中发生的反应如下: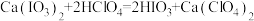 、
、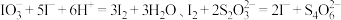
①滴定至终点的现象是_______ 。
②该样品中纯度为_______ 。(用含m、n的式子表示)

已知:碘酸钙在不同温度下的存在形态
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
(1)KOH的电子式为
(2)反应1在85℃中进行,应当选用的加热方法为
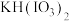 ,写出反应1的化学方程式
,写出反应1的化学方程式(3)操作2的名称为
(4)测定产品纯度的实验步骤如下:
准确称取产品mg,置于100mL烧杯中,加1:1高氯酸20mL,微热溶解试样,冷却后移入500mL容量瓶中,用水稀释至刻度,摇匀,得试液。
准确量取所得试液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL,3g碘化钾(足量),盖上瓶塞,在暗处放置3分钟,加50mL水,用浓度为0.1000mol/L
 标准溶液滴定至浅黄色,加入
标准溶液滴定至浅黄色,加入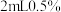 淀粉溶液,继续滴定至终点,重复实验2次,平均消耗
淀粉溶液,继续滴定至终点,重复实验2次,平均消耗 ,标准溶液nmL。
,标准溶液nmL。滴定过程中发生的反应如下:
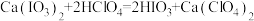 、
、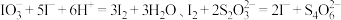
①滴定至终点的现象是
②该样品中纯度为
您最近一年使用:0次
名校
5 . 草酸(H2C2O4)及其盐类化合物在化学工业中有重要作用。请回答下列问题:
(1)实验室中可以在50℃左右,用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如下图。
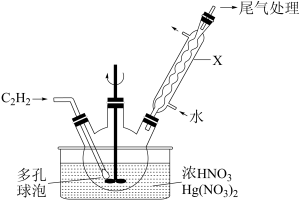
C2H2的电子式为____ ;仪器X的名称为____ ;装置中浓硝酸的还原产物为NO2,生成草酸的化学方程式为____ ,若反应温度高于50℃,生成草酸的速率会减慢,主要原因是____ 。
(2)三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用(NH4)2Fe(SO4)2·6H2O为原料制备三草酸合铁酸钾的步骤如下:
①称取5g(NH4)2Fe(SO4)2·6H2O固体,溶解,加硫酸酸化,搅拌下加入25mL1mol·L-1H2C2O4溶液,静置,析出黄色的FeC2O4·2H2O沉淀,过滤并洗涤沉淀2~3次。
②将上述FeC2O4·2H2O沉淀溶解在10mL饱和草酸钾溶液中,再加入20mL饱和H2C2O4溶液,保持溶液温度40℃左右,缓慢滴加3%H2O2溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾30min,再加入8~9mL草酸溶液,控制pH在3~4,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体2~3次,干燥、称量。
其中,生成FeC2O4·2H2O的化学方程式为____ ;保持溶液温度40℃所采用的加热方法是____ ,加热至沸腾30min的目的是____ ;洗涤晶体所用试剂为____ 。
(3)制得的三草酸合铁酸钾晶体中往往会混有少量草酸。为测定K3[Fe(C2O4)3]·3H2O(M=491g/mol)的纯度,进行如下实验:
称取样品10.72g,加稀硫酸溶解后配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol·L-1的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:5H2C2O4+2 +6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为
+6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为_______ (保留两位小数)。
(1)实验室中可以在50℃左右,用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如下图。

C2H2的电子式为
(2)三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用(NH4)2Fe(SO4)2·6H2O为原料制备三草酸合铁酸钾的步骤如下:
①称取5g(NH4)2Fe(SO4)2·6H2O固体,溶解,加硫酸酸化,搅拌下加入25mL1mol·L-1H2C2O4溶液,静置,析出黄色的FeC2O4·2H2O沉淀,过滤并洗涤沉淀2~3次。
②将上述FeC2O4·2H2O沉淀溶解在10mL饱和草酸钾溶液中,再加入20mL饱和H2C2O4溶液,保持溶液温度40℃左右,缓慢滴加3%H2O2溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾30min,再加入8~9mL草酸溶液,控制pH在3~4,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体2~3次,干燥、称量。
其中,生成FeC2O4·2H2O的化学方程式为
(3)制得的三草酸合铁酸钾晶体中往往会混有少量草酸。为测定K3[Fe(C2O4)3]·3H2O(M=491g/mol)的纯度,进行如下实验:
称取样品10.72g,加稀硫酸溶解后配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol·L-1的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:5H2C2O4+2
 +6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为
+6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为
您最近一年使用:0次
2022-05-03更新
|
1075次组卷
|
2卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
名校
6 . 过氧化钙晶体(CaO2 8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
轻质CaCO3粉末 滤液
滤液 白色结晶体
白色结晶体 目标产物
目标产物
回答下列问题:
(1)CaO2电子式:_________________ 。
(2)反应①的离子方程式为_________________ ;过滤过程中用到的玻璃仪器有_________ 。
(3)用上述方法制取CaO2 8H2O的化学方程式为
8H2O的化学方程式为___________________________________ 。
(4)操作②温度不宜过高,其可能原因是___________________________________________ 。
(5)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:5CaO2+8H2SO4+2KMnO4=5CaSO4+2MnSO4+5O2 +8H2O+K2SO4
+8H2O+K2SO4
,某同学准确称取ag产品于有塞锥形瓶中,用适量酸溶解,加入cmLbmol L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为________ (用含a、b、c的代数式表示)。
 8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。轻质CaCO3粉末
 滤液
滤液 白色结晶体
白色结晶体 目标产物
目标产物回答下列问题:
(1)CaO2电子式:
(2)反应①的离子方程式为
(3)用上述方法制取CaO2
 8H2O的化学方程式为
8H2O的化学方程式为(4)操作②温度不宜过高,其可能原因是
(5)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:5CaO2+8H2SO4+2KMnO4=5CaSO4+2MnSO4+5O2
 +8H2O+K2SO4
+8H2O+K2SO4,某同学准确称取ag产品于有塞锥形瓶中,用适量酸溶解,加入cmLbmol
 L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
您最近一年使用:0次
名校
解题方法
7 . 在饲料添加剂中常常用到碘酸钙,制备碘酸钙晶体的流程如图:
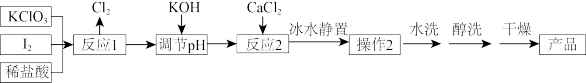
已知:碘酸钙在不同温度下的存在形态
(1)CaCl2的电子式为___ 。
(2)反应1在85℃水浴加热中进行,温度不能太高的原因是___ 。反应1的一种产物是KH(IO3)2,写出反应1的化学方程式___ 。
(3)“调节pH”中发生的化学反应方程式___ 。
(4)操作2的名称为___ ;醇洗的目的是___ 。
(5)测定产品纯度的实验步骤如下:准确称取产品ag,置于100mL烧杯中,加1∶1高氯酸20mL,微热溶解试样,冷却后移入250mL容量瓶中,用水稀释至刻度,摇匀,得试液。
准确量取所得试液50.00mL置于250mL碘量瓶中,加入1∶1高氯酸2mL,3g碘化钾(足量),盖上瓶塞,在暗处放置3分钟,加50mL水,用浓度为0.1000mol/LNa2S2O3标准溶液滴定至浅黄色,加入2mL0.5%淀粉溶液,继续滴定至终点,重复实验2次,平均消耗Na2S2O3标准溶液bmL。滴定过程中发生的反应如下:Ca(IO3)2+2HClO4=2HIO3+Ca(ClO4)2,IO +5I-+6H+=3I2+3H2O,I2+2S2O
+5I-+6H+=3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O
①滴定至终点的现象是___ 。
②该样品的纯度为___ 。(用含a、b的式子表示)
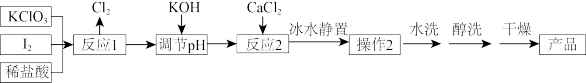
已知:碘酸钙在不同温度下的存在形态
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定的温度区域 | >57.5℃ | 32—57.5℃ | <32℃ |
(2)反应1在85℃水浴加热中进行,温度不能太高的原因是
(3)“调节pH”中发生的化学反应方程式
(4)操作2的名称为
(5)测定产品纯度的实验步骤如下:准确称取产品ag,置于100mL烧杯中,加1∶1高氯酸20mL,微热溶解试样,冷却后移入250mL容量瓶中,用水稀释至刻度,摇匀,得试液。
准确量取所得试液50.00mL置于250mL碘量瓶中,加入1∶1高氯酸2mL,3g碘化钾(足量),盖上瓶塞,在暗处放置3分钟,加50mL水,用浓度为0.1000mol/LNa2S2O3标准溶液滴定至浅黄色,加入2mL0.5%淀粉溶液,继续滴定至终点,重复实验2次,平均消耗Na2S2O3标准溶液bmL。滴定过程中发生的反应如下:Ca(IO3)2+2HClO4=2HIO3+Ca(ClO4)2,IO
 +5I-+6H+=3I2+3H2O,I2+2S2O
+5I-+6H+=3I2+3H2O,I2+2S2O =2I-+S4O
=2I-+S4O
①滴定至终点的现象是
②该样品的纯度为
您最近一年使用:0次
名校
解题方法
8 . X是一种日常生活中常见的金属,它既能与盐酸反应生成X3+和H2,又能与烧碱溶液反应生成XO2-和H2O.X的氢氧化物具有两性,但不与氨水反应;而Zn(OH)2与氨水反应生成[Zn(NH3)4]2+.试回答下列问题:
(1)X元素在元素周期表中的位置是______ 。
(2)X的氧化物也具有两性,写出其溶于烧碱溶液的离子方程式:_______ 。
(3)分离X3+与Zn2+的最佳方法是加入过量的____________ 。
(4)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,Z还可形成多种氢化物及其微粒,如Z2H4、Z2H5+、ZH4+等.
①写出Z2H4的电子式:________ 。
工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(Z2H4·H2O)、Na2CO3等产物,则该反应的化学方程式为_________ 。
查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜。取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在搞完下恰好完全反应生成氮气等产物,写出该反应的化学方程式:_______ 。
②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为______ .
(1)X元素在元素周期表中的位置是
(2)X的氧化物也具有两性,写出其溶于烧碱溶液的离子方程式:
(3)分离X3+与Zn2+的最佳方法是加入过量的
(4)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,Z还可形成多种氢化物及其微粒,如Z2H4、Z2H5+、ZH4+等.
①写出Z2H4的电子式:
工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(Z2H4·H2O)、Na2CO3等产物,则该反应的化学方程式为
查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜。取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在搞完下恰好完全反应生成氮气等产物,写出该反应的化学方程式:
②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为
您最近一年使用:0次



