1 . 常温下ClO2为气体,具有强氧化性,易溶于水且不与水反应,可作为自来水的消毒剂与食品漂白剂。ClO2可通过如下反应制备:第一步反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,第二步,将生成的混合气体通过装有亚氯酸钠(NaClO2)的干燥管,可吸收Cl2并生成ClO2.现往足量NaClO3中通入56LHCl(标况)气体制ClO2,请计算:
(1)通入的HCl气体物质的量为_______ mol。
(2)至少需要NaClO3的物质的量为_______ mol。
(3)通过两步制备共产生ClO2质量为_______ 克。
(1)通入的HCl气体物质的量为
(2)至少需要NaClO3的物质的量为
(3)通过两步制备共产生ClO2质量为
您最近一年使用:0次
2023·上海·模拟预测
2 . 常温常压下,下列物质的物理量中前者是后者两倍的是
A.28 g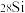 和28g 和28g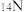 中所含的中子数 中所含的中子数 |
B.2.24 L 和2.24 L 和2.24 L 原子数 原子数 |
C.1mol 和2mol 和2mol 的密度 的密度 |
D.0.1mol·L  和0.1 mol·L 和0.1 mol·L  的 的 |
您最近一年使用:0次
3 . 宏观物质的计量与微观粒子的计量间可通过物质的量联系在一起。下列说法正确的是
A. 的摩尔质量是 的摩尔质量是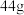 |
B.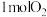 的体积是 的体积是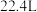 |
C.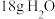 含有的分子总数约为 含有的分子总数约为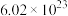 |
D.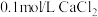 溶液中, 溶液中, 的物质的量浓度为 的物质的量浓度为 |
您最近一年使用:0次
真题
名校
4 . 我国古代四大发明之一黑火药的爆炸反应为: 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 。设
。设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.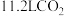 含 含 键数目为 键数目为 | B.每生成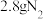 转移电子数目为 转移电子数目为 |
C.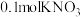 晶体中含离子数目为 晶体中含离子数目为 | D.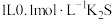 溶液中含 溶液中含 数目为 数目为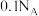 |
您最近一年使用:0次
2023-06-13更新
|
12629次组卷
|
26卷引用:T5-阿伏伽德罗常数
(已下线)T5-阿伏伽德罗常数(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题03 阿伏伽德罗常数的应用(已下线)专题03 阿伏伽德罗常数的应用(已下线)专题03 阿伏伽德罗常数的应用(已下线)第3讲 氧化还原反应(已下线)考点06 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点02 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第8讲 物质的量与气体摩尔体积(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型02 阿伏加德罗常数的判断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2023年高考辽宁卷化学真题江西省清江中学2022-2023学年高二下学期期末考试化学试题吉林省长春外国语学校2023-2024学年高三上学期开学考试化学试题福建省宁德第一中学2024届高三上学期第一次检测化学试题湖北省恩施一中、建始一中、咸丰一中三校2023-2024学年高二上学期9月联考化学试题湖南省 邵阳市第二中学2023-2024学年高二上学期1月期末化学试题甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题湖南省长沙市弘益高级中学2023-2024学年高三上学期第四次月考化学试卷山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题(已下线)测试辽宁化学 请勿下载广东省江门市新会第一中学2023-2024学年高三下学期热身考试化学试题
5 . 在潜水艇和消防员的呼吸面具中,常用 粉末作为氧气的来源。已知每人每小时消耗的
粉末作为氧气的来源。已知每人每小时消耗的 在标准状况下的体积约为
在标准状况下的体积约为 。请计算:
。请计算:
(1)每人每小时消耗 的物质的量约为
的物质的量约为_______  ;
;
(2)假设所需的氧气全部由 来提供,则每位消防员工作1小时所消耗
来提供,则每位消防员工作1小时所消耗 的质量为
的质量为_______  ;
;
(3)取久置呼吸面具中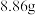 粉末溶于水(杂质为
粉末溶于水(杂质为 ),加入
),加入 盐酸完全反应至溶液呈中性,共消耗
盐酸完全反应至溶液呈中性,共消耗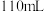 盐酸,则该呼吸面具中的
盐酸,则该呼吸面具中的 的质量分数为
的质量分数为_______ 。
 粉末作为氧气的来源。已知每人每小时消耗的
粉末作为氧气的来源。已知每人每小时消耗的 在标准状况下的体积约为
在标准状况下的体积约为 。请计算:
。请计算:(1)每人每小时消耗
 的物质的量约为
的物质的量约为 ;
;(2)假设所需的氧气全部由
 来提供,则每位消防员工作1小时所消耗
来提供,则每位消防员工作1小时所消耗 的质量为
的质量为 ;
;(3)取久置呼吸面具中
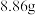 粉末溶于水(杂质为
粉末溶于水(杂质为 ),加入
),加入 盐酸完全反应至溶液呈中性,共消耗
盐酸完全反应至溶液呈中性,共消耗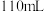 盐酸,则该呼吸面具中的
盐酸,则该呼吸面具中的 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法不正确的是
| 元素 | X | Y | Z | W | |
| 最高价氧化物的水化物 | 分子式 | H3ZO4 | |||
| 25℃时,0.1mol·L-1溶液对应的pH | 1.00 | 13.00 | 1.57 | 0.70 | |
| A.YX3用于汽车防撞气囊,是离子晶体 |
B.简单氢化物分子内的键角: |
| C.足量的锌与W最高价氧化物的水化物的浓溶液充分反应,还原产物有2种 |
| D.31gZ4分子中含有1.5molσ键 |
您最近一年使用:0次
名校
解题方法
7 . 碘酸钙为白色固体,微溶于水,是一种无机精细与专用化学品。一种制备并测定六水合碘酸钙含量的实验设计如下。
步骤Ⅰ:碘酸氢钾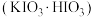 的制备
的制备
在三颈烧瓶中加入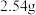 碘、
碘、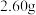 氯酸钾和
氯酸钾和 水,滴加
水,滴加 的盐酸至
的盐酸至 ,控制温度
,控制温度 左右,装置如图。
左右,装置如图。
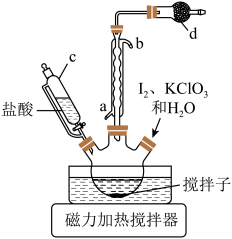
步骤Ⅱ:碘酸钙晶体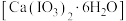 的制备
的制备
将步骤Ⅰ反应后的溶液转入烧杯中,加入 溶液调节
溶液调节 ;继续滴加
;继续滴加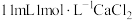 溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体
溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体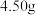 。
。
步骤Ⅲ:产品中碘酸钙晶体含量测定
①准确称取 粗产品,置于烧杯中,加入
粗产品,置于烧杯中,加入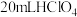 溶解样品,转移到
溶解样品,转移到 容量瓶中定容。量取
容量瓶中定容。量取 溶液于碘量瓶中,加入稍过量的
溶液于碘量瓶中,加入稍过量的 ,然后用
,然后用 标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去
标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 标准溶液。
标准溶液。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗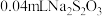 标准溶液。
标准溶液。
已知: ,
, ,
,
请回答下列问题:
(1)仪器 的名称为
的名称为___________ ,步骤Ⅰ中有黄绿色气体产生,则制备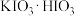 反应的化学方程式为
反应的化学方程式为___________ , 的作用是
的作用是___________ 。
(2)步骤Ⅰ中温度不宜过高的原因是___________ ,判断反应结束的实验现象是___________ 。
(3)步骤Ⅱ中用少量无水乙醇洗涤的目的是___________ 。
(4)步骤Ⅲ中空白实验的主要目的是___________ 。
(5)下列关于滴定分析的操作,不正确的是___________ 。
A.用量筒量取 待测液转移至碘量瓶中
待测液转移至碘量瓶中
B.滴定过程中用少量蒸馏水将锥形并瓦内壁附着的溶液冲下
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“零刻度以下
(6)碘酸钙晶体中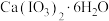 (相对分子质量为498)的纯度为
(相对分子质量为498)的纯度为___________ (计算结果保留两位小数)。
步骤Ⅰ:碘酸氢钾
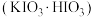 的制备
的制备在三颈烧瓶中加入
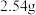 碘、
碘、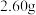 氯酸钾和
氯酸钾和 水,滴加
水,滴加 的盐酸至
的盐酸至 ,控制温度
,控制温度 左右,装置如图。
左右,装置如图。
步骤Ⅱ:碘酸钙晶体
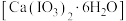 的制备
的制备将步骤Ⅰ反应后的溶液转入烧杯中,加入
 溶液调节
溶液调节 ;继续滴加
;继续滴加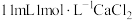 溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体
溶液,充分反应后用冰水冷却,抽滤、用少量冰水洗涤、再用少量无水乙醇洗涤,干燥,得粗产品碘酸钙晶体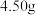 。
。步骤Ⅲ:产品中碘酸钙晶体含量测定
①准确称取
 粗产品,置于烧杯中,加入
粗产品,置于烧杯中,加入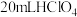 溶解样品,转移到
溶解样品,转移到 容量瓶中定容。量取
容量瓶中定容。量取 溶液于碘量瓶中,加入稍过量的
溶液于碘量瓶中,加入稍过量的 ,然后用
,然后用 标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去
标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 标准溶液。
标准溶液。②空白实验:不取产品,其余试剂用量和步骤相同,消耗
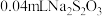 标准溶液。
标准溶液。已知:
 ,
, ,
,
请回答下列问题:
(1)仪器
 的名称为
的名称为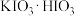 反应的化学方程式为
反应的化学方程式为 的作用是
的作用是(2)步骤Ⅰ中温度不宜过高的原因是
(3)步骤Ⅱ中用少量无水乙醇洗涤的目的是
(4)步骤Ⅲ中空白实验的主要目的是
(5)下列关于滴定分析的操作,不正确的是
A.用量筒量取
 待测液转移至碘量瓶中
待测液转移至碘量瓶中B.滴定过程中用少量蒸馏水将锥形并瓦内壁附着的溶液冲下
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“零刻度以下
(6)碘酸钙晶体中
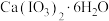 (相对分子质量为498)的纯度为
(相对分子质量为498)的纯度为
您最近一年使用:0次
解题方法
8 . 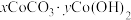 是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为
是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为 ,含
,含 以及
以及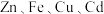 (镉)等的化合物]为原料回收
(镉)等的化合物]为原料回收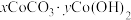 并利用副产物制备绿矾的工艺流程如下:
并利用副产物制备绿矾的工艺流程如下:

回答下列问题:
(1)“控电位浸出”时 与稀硫酸反应转化为
与稀硫酸反应转化为 ,同时有气体物质生成,写出该反应的化学方程式:
,同时有气体物质生成,写出该反应的化学方程式:__________ ;钴在溶液中的存在形式与电位E和 的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是
的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是__________ (填标号)。
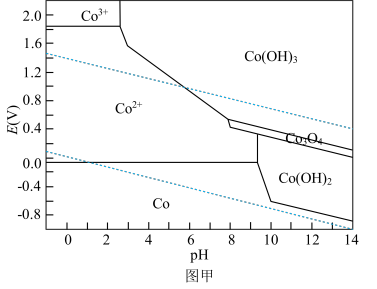
A.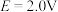
 B.
B.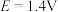

C.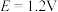
 D.
D.

(2)有关金属离子沉淀的相关 见下表:
见下表:
“中和除铁”时 的理论范围是
的理论范围是_________ ;试剂 为
为_________ (填化学式)。
(3)一定条件下,试剂B的用量对锌钴分离的影响如图乙所示。 的用量在
的用量在_________  时效果最好,理由是
时效果最好,理由是__________________ 。

(4)取所得产品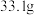 (忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为
(忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为 ,则产品
,则产品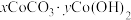 中
中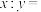
_________ 。据此计算结果写出“沉钴”的离子方程式:_________ 。
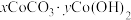 是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为
是制备高纯钴系列产品的中间物料,以高钴渣[主要成分为 ,含
,含 以及
以及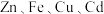 (镉)等的化合物]为原料回收
(镉)等的化合物]为原料回收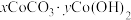 并利用副产物制备绿矾的工艺流程如下:
并利用副产物制备绿矾的工艺流程如下:
回答下列问题:
(1)“控电位浸出”时
 与稀硫酸反应转化为
与稀硫酸反应转化为 ,同时有气体物质生成,写出该反应的化学方程式:
,同时有气体物质生成,写出该反应的化学方程式: 的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是
的关系如图甲所示,下列条件能实现“控电位浸出”时发生目标反应的是
A.
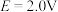
 B.
B.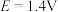

C.
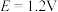
 D.
D.

(2)有关金属离子沉淀的相关
 见下表:
见下表:离子 |
|
|
|
|
|
开始沉淀时的 | 6.2 | 5.3 | 2.1 | 7.1 | 7.2 |
沉淀完全时的 | 8.2 | 6.7 | 3.2 | 9.3 | 9.4 |
 的理论范围是
的理论范围是 为
为(3)一定条件下,试剂B的用量对锌钴分离的影响如图乙所示。
 的用量在
的用量在 时效果最好,理由是
时效果最好,理由是
(4)取所得产品
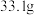 (忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为
(忽略杂质的影响),在隔绝空气条件下高温充分煅烧,冷却后剩余固体的质量为 ,则产品
,则产品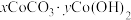 中
中
您最近一年使用:0次
名校
解题方法
9 . 甘氨酸亚铁[(H2NCH2COO)2Fe]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
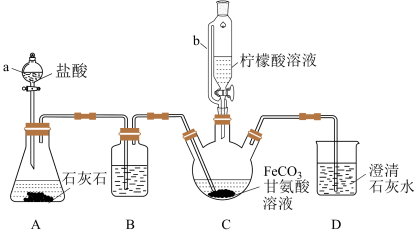
已知:①反应原理为2H2NCH2COOH+FeCO3 (H2NCH2COO)2Fe+CO2↑+H2O。
(H2NCH2COO)2Fe+CO2↑+H2O。
②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:I.装置C中盛有过量的FeCO3和200mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌;然后向三颈烧瓶中滴加柠檬酸溶液。
II.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B中的试剂为_______ 。
(2)装置A制备CO2的用途是_______ 。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为_______ 。
(4)过程I加入柠檬酸溶液促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,pH过高导致产率下降的原因是_______ 。
②柠檬酸溶液除了起酸性作用外,还有的作用是_______ 。
(5)过程II中加入无水乙醇的目的是_______ 。
(6)本实验制得15.3 g甘氨酸亚铁(Mr=204g/mol),则其产率是_______ %。

已知:①反应原理为2H2NCH2COOH+FeCO3
 (H2NCH2COO)2Fe+CO2↑+H2O。
(H2NCH2COO)2Fe+CO2↑+H2O。②甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:I.装置C中盛有过量的FeCO3和200mL 1.0 mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中的空气排净后,加热并不断搅拌;然后向三颈烧瓶中滴加柠檬酸溶液。
II.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)装置B中的试剂为
(2)装置A制备CO2的用途是
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为
(4)过程I加入柠檬酸溶液促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,pH过高导致产率下降的原因是
②柠檬酸溶液除了起酸性作用外,还有的作用是
(5)过程II中加入无水乙醇的目的是
(6)本实验制得15.3 g甘氨酸亚铁(Mr=204g/mol),则其产率是
您最近一年使用:0次
名校
解题方法
10 . 设NA为阿伏加德罗常数的值。下列说法不正确的是
A.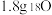 中含有的中子数为NA 中含有的中子数为NA |
B.标准状况下,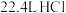 气体中含有的 气体中含有的 数目为NA 数目为NA |
C.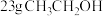 中 中 杂化的原子数为1.5 NA 杂化的原子数为1.5 NA |
D. 和 和 的混合气体中含有的C原子数为2 NA 的混合气体中含有的C原子数为2 NA |
您最近一年使用:0次
2023-05-31更新
|
406次组卷
|
4卷引用:第9讲 物质的量浓度







