解题方法
1 . 3-硝基苯甲酰氯(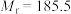 )能用于制染料和有机合成,一种实验室制备原理如图所示:
)能用于制染料和有机合成,一种实验室制备原理如图所示: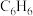 、
、 的沸点分别为80℃、78.6℃;②
的沸点分别为80℃、78.6℃;② 和3-硝基苯甲酰氯均易与水反应。
和3-硝基苯甲酰氯均易与水反应。
实验步骤:
ⅰ.在三颈烧瓶中加入3-硝基苯甲酸26.72g( )、50 mL
)、50 mL (0.42 mol)和200 mL无水苯;
(0.42 mol)和200 mL无水苯;
ⅱ.加热至80~85℃搅拌回流5h;
ⅲ.反应完毕,减压回收 和
和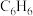 ,冷却,析出黄色晶体;
,冷却,析出黄色晶体;
ⅳ.抽滤、洗涤、干燥、提纯,得22.26g产品。
(1)三颈烧瓶洗涤干净后,组装仪器前必须进行的操作是____________ ;相对普通分液漏斗,仪器A的主要优点是____________ 。
(2)本实验中,需要加入一定量的苯,其目的是____________ 。
(3)无水氯化钙______ (填“能”或“不能”)用碱石灰代替,其原因是____________ 。
(4)磁振子起到的两个作用是____________ 。
(5)抽滤装置如图所示,抽滤的先后操作顺序为a→c→b→d→g→______ (填字母)。
e.取下抽滤瓶上的橡皮管f.关闭抽气泵g.洗涤h.确认抽干
(6)本实验3-硝基苯甲酰氯的产率为______ %。
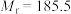 )能用于制染料和有机合成,一种实验室制备原理如图所示:
)能用于制染料和有机合成,一种实验室制备原理如图所示: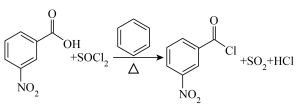
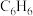 、
、 的沸点分别为80℃、78.6℃;②
的沸点分别为80℃、78.6℃;② 和3-硝基苯甲酰氯均易与水反应。
和3-硝基苯甲酰氯均易与水反应。实验步骤:
ⅰ.在三颈烧瓶中加入3-硝基苯甲酸26.72g(
 )、50 mL
)、50 mL (0.42 mol)和200 mL无水苯;
(0.42 mol)和200 mL无水苯;ⅱ.加热至80~85℃搅拌回流5h;
ⅲ.反应完毕,减压回收
 和
和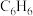 ,冷却,析出黄色晶体;
,冷却,析出黄色晶体;ⅳ.抽滤、洗涤、干燥、提纯,得22.26g产品。
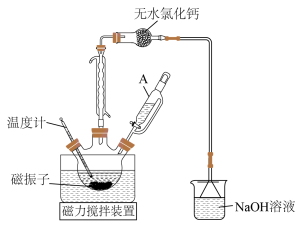
(1)三颈烧瓶洗涤干净后,组装仪器前必须进行的操作是
(2)本实验中,需要加入一定量的苯,其目的是
(3)无水氯化钙
(4)磁振子起到的两个作用是
(5)抽滤装置如图所示,抽滤的先后操作顺序为a→c→b→d→g→
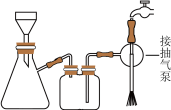
e.取下抽滤瓶上的橡皮管f.关闭抽气泵g.洗涤h.确认抽干
(6)本实验3-硝基苯甲酰氯的产率为
您最近一年使用:0次
名校
2 . 甲酸铜晶体[ ,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备
,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备 步骤如下:
步骤如下:
步骤 .称取12.5g
.称取12.5g  和9.5g
和9.5g  混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到
混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到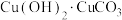 ;
;
步骤 .将
.将 所得
所得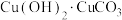 放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g
放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g  。
。
回答下列问题:
(1)实验室研细 和
和 的混合物所用的仪器名称为
的混合物所用的仪器名称为___________ 。
(2)若将混合物一次性加入100mL已经近沸的蒸馏水中,则产生的后果是___________ 。
(3)写出步骤 生成
生成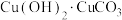 的离子方程式:
的离子方程式:___________ , 和
和 恰好完全反应时,
恰好完全反应时,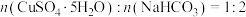 ,本实验
,本实验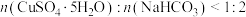 的原因是
的原因是___________ (任写一种)。
(4)简述步骤 检验
检验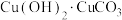 洗涤干净的操作:
洗涤干净的操作:___________ 。
(5)本实验 产率为
产率为___________ (保留三位有效数字)。
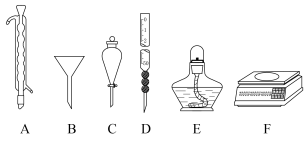
(6)下列仪器本实验用不到的是___________ (填字母)。
 ,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备
,难溶于冷水、乙醇]又称安息香酸铜,是一种有机化工原料。实验室制备 步骤如下:
步骤如下:步骤
 .称取12.5g
.称取12.5g  和9.5g
和9.5g  混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到
混合均匀研细,在快速搅拌条件下,将混合物分多次缓慢加至100mL已经近沸的蒸馏水中(此时停止加热),混合物加完后,再加热近沸几分钟。静置、过滤、洗涤,得到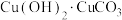 ;
;步骤
 .将
.将 所得
所得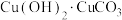 放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g
放入烧杯中,加入20mL蒸馏水,搅拌下加热至50℃,逐滴加入适量的HCOOH,使沉淀完全溶解,趁热过滤,蒸发滤液为原来体积的三分之一,用冰水浴冷却析晶。减压过滤,用少量乙醇洗涤、烘干后得到10.7g  。
。回答下列问题:
(1)实验室研细
 和
和 的混合物所用的仪器名称为
的混合物所用的仪器名称为(2)若将混合物一次性加入100mL已经近沸的蒸馏水中,则产生的后果是
(3)写出步骤
 生成
生成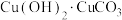 的离子方程式:
的离子方程式: 和
和 恰好完全反应时,
恰好完全反应时,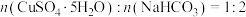 ,本实验
,本实验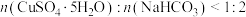 的原因是
的原因是(4)简述步骤
 检验
检验 洗涤干净的操作:
洗涤干净的操作:(5)本实验
 产率为
产率为(6)下列仪器本实验用不到的是
您最近一年使用:0次
名校
3 . 锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。如图为工业上利用湿法炼锌渣(主要含有 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。
③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
④有机试剂丹宁沉淀金属离子的沉淀率见表。
(1)“浸出”时加热的目的是_______ ,该过程发生的主要反应为_______ ;浸出渣的主要成分是_______ (填化学式)。
(2)浸出后加入 溶液的作用是
溶液的作用是_______ (用离子方程式表示)。滤饼1中主要成分为一种,常温下调节溶液的pH范围为_______ 。如果不加 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成_______ 的不良后果。
(3)“滤液2”中主要含有的金属阳离子是_______ (填离子符号)。
(4) 与纯水反应的化学方程式为
与纯水反应的化学方程式为_______ 。
(5)若含锗3.65%的湿法炼锌渣的质量为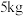 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为_______ 。
 、
、 、
、 、
、 、
、 )制备高纯锗的工艺流程:
)制备高纯锗的工艺流程: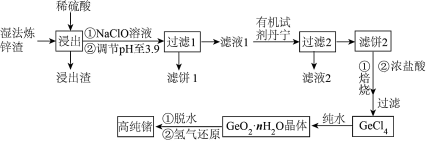
 为两性化合物。②
为两性化合物。② 易水解,在浓盐酸中溶解度低。
易水解,在浓盐酸中溶解度低。③常温下,部分金属阳离子转化为氢氧化物沉淀的pH见表。
| 离子 |  |  |  | 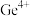 |
| 开始沉淀pH | 7.5 | 2.2 | 6.2 | 8.2 |
| 完全沉淀pH | 9.0 | 3.2 | 8.2 | 11.2 |
| 离子 |  |  |  | 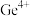 |
| 沉淀率(%) | 0 | 99 | 0 | 97~98.5 |
(2)浸出后加入
 溶液的作用是
溶液的作用是 溶液,pH就需要调节到更大的数值,这样会造成
溶液,pH就需要调节到更大的数值,这样会造成(3)“滤液2”中主要含有的金属阳离子是
(4)
 与纯水反应的化学方程式为
与纯水反应的化学方程式为(5)若含锗3.65%的湿法炼锌渣的质量为
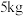 ,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
,氢气还原过程中参与反应的氢气体积为89.6L(标准状况下),则锗的回收率为
您最近一年使用:0次
2024-04-21更新
|
256次组卷
|
2卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题
2024高三下·全国·专题练习
4 . I.“皮鞋很忙的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为_______ g。
(2)配制时,下列操作会导致所配溶液浓度偏高的是_______ 。
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
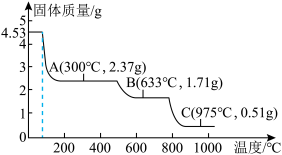
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。_______ 、_______ 。(填化学式)
A. 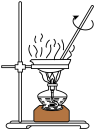 B.
B.  C.
C.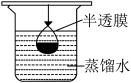
(1)计算、称量。配制该溶液需称取NaOH晶体的质量为
(2)配制时,下列操作会导致所配溶液浓度偏高的是
A.转移时有少量溶液溅出
B.容量瓶用蒸馏水洗净后未干燥
C.定容时俯视读取刻度
D.定容时液面超过了刻度线
E.称量NaOH时用了生锈的砝码
Ⅲ.取4.53gNH4Al(SO4)2∙12H2O加热分解,加热过程中固体质量随温度的变化如图所示。
您最近一年使用:0次
名校
解题方法
5 .  及其盐都是重要的化工原料。
及其盐都是重要的化工原料。
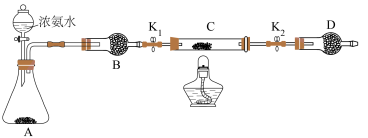
(1)向生石灰中滴加浓氨水,可以快速制取氨气,发生反应的化学方程式为_______ ;盛放浓氨水的仪器名称为_______ ,选用下图中的装置制备干燥的 ,连接顺序为a→
,连接顺序为a→_______ →尾气吸收(按气流方向,用小写字母表示)。_______ 。 性质实验的装置如图。
性质实验的装置如图。_______ ,稳定后,关闭活塞1;再打开活塞2,瓶Ⅱ中的现象是_______ 。
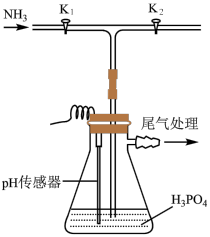
(3)某研究小组用磷酸( )吸收氨气制备干粉灭火剂磷酸氢二铵[
)吸收氨气制备干粉灭火剂磷酸氢二铵[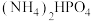 ],装置如图所示。当溶液pH为8.0~9.0时,停止通
],装置如图所示。当溶液pH为8.0~9.0时,停止通 ,即可制得[
,即可制得[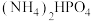 ]溶液。实验过程中,当出现
]溶液。实验过程中,当出现_______ 现象时,应及时关闭 ,打开
,打开 。
。 和
和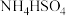 混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成
混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成 896mL(标准状况),
896mL(标准状况),
_______ 。
 及其盐都是重要的化工原料。
及其盐都是重要的化工原料。(1)向生石灰中滴加浓氨水,可以快速制取氨气,发生反应的化学方程式为
 ,连接顺序为a→
,连接顺序为a→
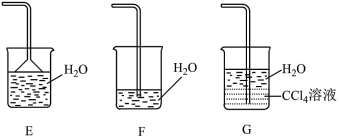
 性质实验的装置如图。
性质实验的装置如图。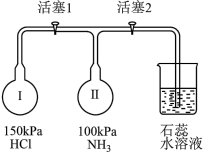
(3)某研究小组用磷酸(
 )吸收氨气制备干粉灭火剂磷酸氢二铵[
)吸收氨气制备干粉灭火剂磷酸氢二铵[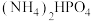 ],装置如图所示。当溶液pH为8.0~9.0时,停止通
],装置如图所示。当溶液pH为8.0~9.0时,停止通 ,即可制得[
,即可制得[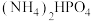 ]溶液。实验过程中,当出现
]溶液。实验过程中,当出现 ,打开
,打开 。
。
 和
和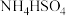 混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成
混合物,称取该混合物固体样品3.62g,加入足量NaOH溶液,充分反应,生成 896mL(标准状况),
896mL(标准状况),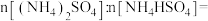
您最近一年使用:0次
解题方法
6 . 12-钨磷酸(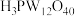 ,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
【制备步骤】
Ⅰ.12-钨磷酸钠(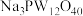 )溶液的制备
)溶液的制备
取 (分子量:330)和
(分子量:330)和 (分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
(分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
Ⅱ.12-钨磷酸的制备
将烧杯中液体一并转移至分液漏斗中,加入205 mL乙醚及6 mL 6 mol/L的盐酸(均过量),振荡后静置,液体分三层,分出最下层液体于仪器 X 中,在通风橱内,置于热水浴中加热蒸除少量乙醚,得白色12-钨磷酸固体8.64 g。
(1)请用离子方程式表示步骤Ⅰ中12-钨磷酸钠的制备原理___________ ;
(2)“仪器X”为___________ ;
(3)步骤Ⅱ中,振荡分液漏斗制备12-钨磷酸时,需不时拧开分液漏斗活塞进行放气,这样操作的目的是___________ ;
(4)步骤Ⅱ中“液体分为三层”,最上层液体的主要成分为___________ (填代号);
a.乙醚 b.12-钨磷酸钠溶液 c.水 d.NaCl溶液
(5)步骤Ⅱ蒸除乙醚时,采用水浴加热而不采用明火加热的目的是___________ ;
(6)制备出的12-钨磷酸常因有灰尘、纸屑等有机纤维杂质落入而形成蓝色的“杂多蓝”,出现这一现象时,加入适量过氧化氢或溴水可使其恢复。上述实验现象可体现出12-钨磷酸常温下具有较强的___________ (填“氧化性”或“还原性”);
(7)根据上述实验数据计算,该实验的产率为___________ (设所得白色固体均为无水12-钨磷酸,结果保留两位有效数字);
(8)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:___________ ;
②12-钨磷酸根离子中存在___________ 种处于不同化学环境的氧原子。
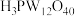 ,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:
,分子量:2880)是杂多化合物的代表物之一,实验室可通过乙醚萃取法合成。涉及的部分物质性质见下表:| 物质 | 性质 |
| 乙醚 | 无色液体,密度比水小且难溶于水,沸点34.5℃ |
| 12-钨磷酸 | 白色固体,能溶于水,常温下极易与乙醚形成密度大于水且难溶于水的油状醚合物 |
Ⅰ.12-钨磷酸钠(
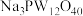 )溶液的制备
)溶液的制备取
 (分子量:330)和
(分子量:330)和 (分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。
(分子量:178)于烧杯中,溶于80mL热水,边加热边搅拌下,向溶液中以细流加入14 mL浓盐酸,继续加热30 s。Ⅱ.12-钨磷酸的制备
将烧杯中液体一并转移至分液漏斗中,加入205 mL乙醚及6 mL 6 mol/L的盐酸(均过量),振荡后静置,液体分三层,分出最下层液体于
(1)请用离子方程式表示步骤Ⅰ中12-钨磷酸钠的制备原理
(2)“仪器X”为
(3)步骤Ⅱ中,振荡分液漏斗制备12-钨磷酸时,需不时拧开分液漏斗活塞进行放气,这样操作的目的是
(4)步骤Ⅱ中“液体分为三层”,最上层液体的主要成分为
a.乙醚 b.12-钨磷酸钠溶液 c.水 d.NaCl溶液
(5)步骤Ⅱ蒸除乙醚时,采用水浴加热而不采用明火加热的目的是
(6)制备出的12-钨磷酸常因有灰尘、纸屑等有机纤维杂质落入而形成蓝色的“杂多蓝”,出现这一现象时,加入适量过氧化氢或溴水可使其恢复。上述实验现象可体现出12-钨磷酸常温下具有较强的
(7)根据上述实验数据计算,该实验的产率为
(8)通过对X-射线衍射结果分析,得到12-钨磷酸根离子结构如下图,请回答:
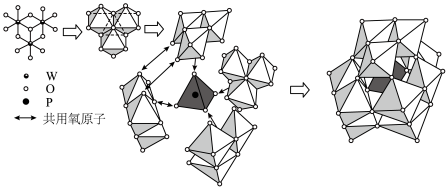
②12-钨磷酸根离子中存在
您最近一年使用:0次
名校
7 . 2021年4月13日,日本政府召开相关阁僚会议,正式决定向海洋排放福岛第一核电站含有对海洋环境有害的核废水,并将核废水主要辐射物质“氚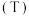 ”做成卡通形象,以合理化将放射性核废水排入太平洋的行为,进而引发国内外民众的严重不满。
”做成卡通形象,以合理化将放射性核废水排入太平洋的行为,进而引发国内外民众的严重不满。

(1)下列有关氚的说法正确的是_______。
| A.卡通形象中标“+”号的小球表示中子 | B.氚的核素符号为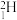 |
| C.氚和及其同位素性质完全相同 | D.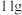 氚水 氚水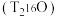 所含中子数为 所含中子数为 |
(2)有关
 和
和 的说法正确的是___________。
的说法正确的是___________。| A.互为同位素 | B.互为同素异形体 |
| C.电子数不同 | D.同温同压下密度之比为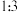 |
(3)在离子
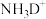 中,电子数、质子数和中子数之比为
中,电子数、质子数和中子数之比为(4)
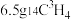 在标况下的体积约为
在标况下的体积约为(5)一个
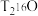 分子的质量是
分子的质量是
您最近一年使用:0次
解题方法
8 . A为一种常见的金属单质,B、E、F、G是含有A元素的常见化合物。回答下列问题:

(1)写出化学式:B_______ ,F_______ 。
(2)写出E到F转化过程的化学方程式_______ 。
(3)检验G溶液中金属阳离子的常用试剂为_______ ,证明该离子存在的现象为_______ 。
(4)写出G到B转化过程的化学方程式_______ ,该反应中还原剂为_______ 。
(5)若标准状况下A与盐酸反应产生44.8L气体,则消耗A的质量为_______ g。

(1)写出化学式:B
(2)写出E到F转化过程的化学方程式
(3)检验G溶液中金属阳离子的常用试剂为
(4)写出G到B转化过程的化学方程式
(5)若标准状况下A与盐酸反应产生44.8L气体,则消耗A的质量为
您最近一年使用:0次
名校
解题方法
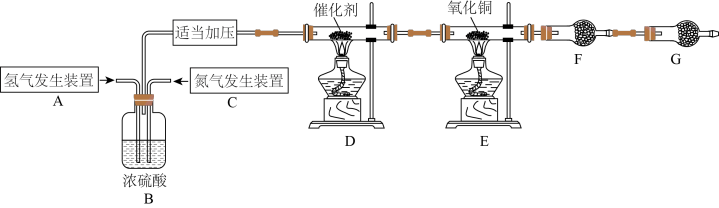
9 . 某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下: 。请回答下列问题:
。请回答下列问题:
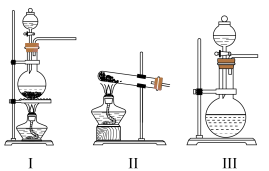
(1)C装置应选用______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)装置B的作用是:①使气体混合均匀;②______ ;③______ 。
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为____________________ 。
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
(5)G装置的作用是①______ ;②______ 。
若没有G装置,测得结果Ar(Cu)______ (填“偏大”“偏小”或“无影响”)。
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。______ (填化学式)
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=______ (用含有m1、m2、m3的式子表示)。
 。请回答下列问题:
。请回答下列问题:(1)C装置应选用
(2)装置B的作用是:①使气体混合均匀;②
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
| A.五氧化二磷 | B.无水CuSO4 | C.碱石灰 | D.无水CaCl2 |
(5)G装置的作用是①
若没有G装置,测得结果Ar(Cu)
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=
您最近一年使用:0次
2024-03-12更新
|
587次组卷
|
5卷引用:湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷
2024高三下·全国·专题练习
10 . 乙酰水杨酸(阿司匹林)是目前常用药物之一,实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
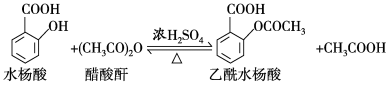
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤;
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤;
③滤液用浓盐酸酸化后冷却、过滤得固体;
④固体经纯化得白色的乙酰水杨酸晶体5.4 g;
回答下列问题:
(1)该合成反应中应采用___________加热(填字母)。
(2)①中需使用冷水,目的是___________ 。
(3)②中饱和碳酸氢钠的作用是___________ ,以便过滤除去难溶杂质。
(4)④采用的纯化方法为___________ 。
(5)本实验的产率是___________ %。

| 水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
| 熔点/℃ | 157~159 | -72~-74 | 135~138 |
| 相对密度/(g·cm-3) | 1.44 | 1.10 | 1.35 |
| 相对分子质量 | 138 | 102 | 180 |
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤;
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤;
③滤液用浓盐酸酸化后冷却、过滤得固体;
④固体经纯化得白色的乙酰水杨酸晶体5.4 g;
回答下列问题:
(1)该合成反应中应采用___________加热(填字母)。
| A.热水浴 | B.酒精灯 | C.煤气灯 | D.电炉 |
(3)②中饱和碳酸氢钠的作用是
(4)④采用的纯化方法为
(5)本实验的产率是
您最近一年使用:0次



