名校
解题方法
1 . 高锰酸钾是一种强氧化剂,具有很好的消炎、杀菌、抑菌的作用,因此临床上可以用于急性皮炎、湿疹、皮肤感染等疾病的治疗。
回答下列问题:
(1)某高锰酸钾外用片的部分使用说明及注意事项如下:
①高锰酸钾外用片可以治疗皮肤感染,是应用了高锰酸钾的___________ 性。
②高锰酸钾水溶液易变质的原因是___________ 。
③高锰酸钾外用片不可与碘化物接触或并用的原因是___________ 。
(2)将 溶液酸化可制得
溶液酸化可制得 ,同时生成
,同时生成 ,在此反应中氧化剂和还原剂的物质的量之比为
,在此反应中氧化剂和还原剂的物质的量之比为___________ ;当生成0.1mol还原产物时转移电子的数目为___________ 。
回答下列问题:
(1)某高锰酸钾外用片的部分使用说明及注意事项如下:
| 【注意事项】 1.本品仅供外用,切忌口服。 2.本品水溶液易变质,故使用前用温水配制,并立即使用。 【药品相互作用】 不可与碘化物、有机物接触或并用,尤其是晶体。 |
①高锰酸钾外用片可以治疗皮肤感染,是应用了高锰酸钾的
②高锰酸钾水溶液易变质的原因是
③高锰酸钾外用片不可与碘化物接触或并用的原因是
(2)将
 溶液酸化可制得
溶液酸化可制得 ,同时生成
,同时生成 ,在此反应中氧化剂和还原剂的物质的量之比为
,在此反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
解题方法
2 . 一定质量的Na2O2投入到足量的水中,得到1L的溶液,同时生成的气体在标准状况时体积为2.24L。求:
(1)该反应转移的电子数目为_______ 。
(2)生成的NaOH物质的量浓度_______ 。
(3)参与该反应的物质Na2O2的质量_______ 。
(1)该反应转移的电子数目为
(2)生成的NaOH物质的量浓度
(3)参与该反应的物质Na2O2的质量
您最近一年使用:0次
3 . 实验室可以根据下列方程式制备氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
(1)反应①的离子方程式为(MnCl2为易溶易电离的物质)_________ 。
(2)用双线桥法表示该反应中电子转移的方向和数目_________ 。
(3)浓盐酸在该反应中的作用是(填序号)_________ ①氧化性②还原性③酸性,若在标准状况下,制得氯气的体积为2.24L,则被氧化的氯化氢的物质的量为_________ 。
 MnCl2+Cl2↑+2H2O;根据反应回答下列问题:
MnCl2+Cl2↑+2H2O;根据反应回答下列问题:(1)反应①的离子方程式为(MnCl2为易溶易电离的物质)
(2)用双线桥法表示该反应中电子转移的方向和数目
(3)浓盐酸在该反应中的作用是(填序号)
您最近一年使用:0次
名校
解题方法
4 . 请回答下列问题:
(1)8gSO3中含有___________ 个氧原子。
(2)3.01 ×1023个CO与___________ mol N2的质量相同,与标况下的___________ LCO2所含氧原子数相同。
(3)7. 8g过氧化钠中共含有___________ mol离子,它与足量水反应时转移的电子数是___________ 个,产生标况下的气体体积约为___________ L。
(4)标况下O2的密度约为___________ g/L (保留三位有效数字)。
(1)8gSO3中含有
(2)3.01 ×1023个CO与
(3)7. 8g过氧化钠中共含有
(4)标况下O2的密度约为
您最近一年使用:0次
名校
解题方法
5 . (1)高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理.工业上制备高铁酸钠有多种方法,其中一种方法的化学反应原理如下:
是一种新型绿色消毒剂,主要用于饮用水处理.工业上制备高铁酸钠有多种方法,其中一种方法的化学反应原理如下:
 。请回答下列问题:
。请回答下列问题:
① 发生
发生______________ 反应,1个 得到
得到_____________ 个电子。
②反应时被氧化的元素是___________ (填名称),还原剂是_________________ (写化学式);氧化剂与还原剂离子数之比为_________________ 。
③生成2个 时,转移电子数为
时,转移电子数为____________________ 。
④用单线桥表示该反应转移电子的方向与数目________________ 。
(2)用“双线桥”法标出反应 的电子转移的方向与数目:
的电子转移的方向与数目: ________________ 。
(3)写出实验室制备 胶体的化学反应方程式
胶体的化学反应方程式_________________________ 。
 是一种新型绿色消毒剂,主要用于饮用水处理.工业上制备高铁酸钠有多种方法,其中一种方法的化学反应原理如下:
是一种新型绿色消毒剂,主要用于饮用水处理.工业上制备高铁酸钠有多种方法,其中一种方法的化学反应原理如下: 。请回答下列问题:
。请回答下列问题:①
 发生
发生 得到
得到②反应时被氧化的元素是
③生成2个
 时,转移电子数为
时,转移电子数为④用单线桥表示该反应转移电子的方向与数目
(2)用“双线桥”法标出反应
 的电子转移的方向与数目:
的电子转移的方向与数目: (3)写出实验室制备
 胶体的化学反应方程式
胶体的化学反应方程式
您最近一年使用:0次
解题方法
6 . 在碱性介质中有利于卤素单质的歧化反应,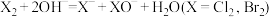 ,
, 在碱性介质中也会发生歧化反应,其反应速率与温度有关,如
在碱性介质中也会发生歧化反应,其反应速率与温度有关,如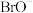 在
在 左右歧化反应很慢,在
左右歧化反应很慢,在 则全部转化为
则全部转化为 和
和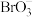 。
。
(1)某温度下,含 的溴水与
的溴水与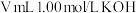 溶液恰好完全反应,则
溶液恰好完全反应,则
_______ 。
(2)某温度下,含 的溴水与
的溴水与 溶液恰好完全反应,若反应后
溶液恰好完全反应,若反应后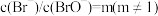 ,则反应转移电子数
,则反应转移电子数
_______ 。(用含m的式子表示)
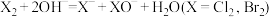 ,
, 在碱性介质中也会发生歧化反应,其反应速率与温度有关,如
在碱性介质中也会发生歧化反应,其反应速率与温度有关,如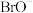 在
在 左右歧化反应很慢,在
左右歧化反应很慢,在 则全部转化为
则全部转化为 和
和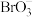 。
。(1)某温度下,含
 的溴水与
的溴水与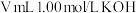 溶液恰好完全反应,则
溶液恰好完全反应,则
(2)某温度下,含
 的溴水与
的溴水与 溶液恰好完全反应,若反应后
溶液恰好完全反应,若反应后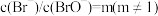 ,则反应转移电子数
,则反应转移电子数
您最近一年使用:0次
解题方法
7 . 某合金(仅含铜、铁)中铜和铁的物质的量之和为 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入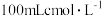 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。
(1)若金属全部溶解,则溶液中___________ (填“一定”或“不一定”)含有 。
。
(2)若产生标准状况下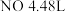 ,则反应转移的电子总数为
,则反应转移的电子总数为___________  。
。
(3)若溶液中金属离子只有 、
、 时,则c≥
时,则c≥___________ (用含a和b的式子表示)。
 ,其中
,其中 的物质的量分数为b,将其全部投入
的物质的量分数为b,将其全部投入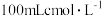 的稀硝酸中,加热使其充分反应(假设
的稀硝酸中,加热使其充分反应(假设 是唯一的还原产物)。
是唯一的还原产物)。(1)若金属全部溶解,则溶液中
 。
。(2)若产生标准状况下
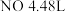 ,则反应转移的电子总数为
,则反应转移的电子总数为 。
。(3)若溶液中金属离子只有
 、
、 时,则c≥
时,则c≥
您最近一年使用:0次
2021-09-04更新
|
147次组卷
|
3卷引用:浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题
8 . 已知MnO2与浓盐酸反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为_______ 。
(2)用单线桥表示出电子的转移和数目_______
(3)该反应中HCl体现的性质是_______ ,氧化产物是_______ ,反应中氧化剂和还原剂的物质的量之比_______ 。
(4)当有1molCl2生成时,则被氧化的HCl的质量是_______ g,该反应转移的电子数为_______ (设NA为阿伏加德罗常数的值)。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)用单线桥表示出电子的转移和数目
(3)该反应中HCl体现的性质是
(4)当有1molCl2生成时,则被氧化的HCl的质量是
您最近一年使用:0次
名校
解题方法
9 . 化学反应中伴随着能量变化,探究各种能量变化是一永恒的主题。
(1)下列变化属于放热反应的是___________ (填序号)。
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
(2)H2O2分解时的能量变化关系如图所示,则H2O2分解反应为___________ 反应 (选填:吸热、放热)。
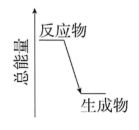
查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和___________ 。
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:
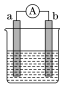
①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为___________ (填名称)。
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为___________ 。
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为___________ 。
(1)下列变化属于放热反应的是
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
(2)H2O2分解时的能量变化关系如图所示,则H2O2分解反应为

查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置:

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为
您最近一年使用:0次
2021-05-11更新
|
270次组卷
|
2卷引用:山东省济宁市任城区2020-2021学年高一下学期期中考试化学试题
2021高三·全国·专题练习
解题方法
10 . 含2molH2SO4的浓硫酸与足量的铜片在加热条件下完全反应,可产生NA个SO2气体分子___
您最近一年使用:0次



