名校
解题方法
1 . 84消毒液、ClO2是常见的含氯消毒剂。
资料:84消毒液中含氟微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映物质的氧化一还原性,ORP值越大,氧化性越强。通常情况下,应将84消毒液原液稀释后使用;一般不用于衣服等纺织品的洗涤消毒。
(1)制备ClO2的一种反应为:2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O,用单线桥法标出其电子转移的方向和数目_______ 。
(2)取含次氯酸钠0.2mol·L-1的消毒液1mL,加水稀释至200mL,则稀释后次氯酸钠的物质的量浓度为_______ mol·L-1。
(3)为研究84消毒液的性质与使用条件,进行下列实验:
【实验1】向两支试管中分别加入2mL84消毒液,在试管l中加入2mL水,试管2中加入2mL白醋,再分别放入相同的红色纸片。观察到试管2中纸片褪色更快。
①实验中在试管l中加入2mL水的目的是_______ 。
②试管2中纸片褪色更快的原因是_______ 。
③如果实验中加浓盐酸,会有黄绿色气体产生,反应的离子方程式是_______ 。
【实验2】测定84消毒液在不同温度时ORP随时间的变化情况,结果如图所示。
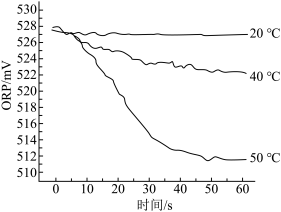
④实验表明,随温度升高,ORP值下降。50℃时ORP值下降较快的原因是_______ 。
资料:84消毒液中含氟微粒主要有ClO-、Cl-、HClO;相同浓度时,HClO的氧化性强于ClO-;ORP是反映物质的氧化一还原性,ORP值越大,氧化性越强。通常情况下,应将84消毒液原液稀释后使用;一般不用于衣服等纺织品的洗涤消毒。
(1)制备ClO2的一种反应为:2NaClO3+2NaCl+2H2SO4=2ClO2↑+Cl2↑+2Na2SO4+2H2O,用单线桥法标出其电子转移的方向和数目
(2)取含次氯酸钠0.2mol·L-1的消毒液1mL,加水稀释至200mL,则稀释后次氯酸钠的物质的量浓度为
(3)为研究84消毒液的性质与使用条件,进行下列实验:
【实验1】向两支试管中分别加入2mL84消毒液,在试管l中加入2mL水,试管2中加入2mL白醋,再分别放入相同的红色纸片。观察到试管2中纸片褪色更快。
①实验中在试管l中加入2mL水的目的是
②试管2中纸片褪色更快的原因是
③如果实验中加浓盐酸,会有黄绿色气体产生,反应的离子方程式是
【实验2】测定84消毒液在不同温度时ORP随时间的变化情况,结果如图所示。

④实验表明,随温度升高,ORP值下降。50℃时ORP值下降较快的原因是
您最近一年使用:0次
22-23高一上·江苏南通·期中
名校
解题方法
2 . 黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe3O4、Fe2O3)生产 溶液的流程如下图所示:
溶液的流程如下图所示:
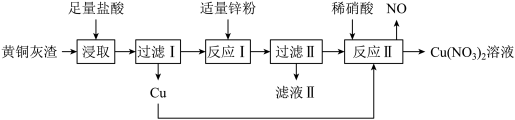
(1)写出“浸取”时Fe3O4反应的离子方程式:_______ 。
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由:_______ 。
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是_______ 。
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。
①若要获得100mL1.4mol·L-1的稀硝酸,需要用到浓硝酸的体积为_______ mL。
②NO是一种无色气体,依据信息写出“反应Ⅱ”的化学方程式:_______ 。
 溶液的流程如下图所示:
溶液的流程如下图所示:
(1)写出“浸取”时Fe3O4反应的离子方程式:
(2)过滤Ⅰ后所得滤液中是否含Fe3+,并说明理由:
(3)检验“滤液Ⅱ”中由铁元素形成的阳离子的方法是
(4)“反应Ⅱ”所用稀硝酸可由质量分数为63%、密度为1.40g·cm-3的浓硝酸稀释获得。
①若要获得100mL1.4mol·L-1的稀硝酸,需要用到浓硝酸的体积为
②NO是一种无色气体,依据信息写出“反应Ⅱ”的化学方程式:
您最近一年使用:0次
2022-12-22更新
|
277次组卷
|
4卷引用:江苏省南通市如皋市2022-2023学年高一上学期期中教学质量调研化学试题
(已下线)江苏省南通市如皋市2022-2023学年高一上学期期中教学质量调研化学试题江苏省盐城市射阳县第二中学2022-2023学年高一上学期11月期中考试化学试题黑龙江省 牡丹江市第一高级中学2023-2024学年高一上学期12月月考化学试题河南省顶级名校2023-2024学年高一上学期12月月考化学试题
名校
3 . 硫酸是一种重要的工业原料。
(1)稀硫酸具有酸性,其电离方程式为:___________ ;稀硫酸可以和 反应生成正盐和水,其反应的离子方程式为:
反应生成正盐和水,其反应的离子方程式为:___________ ;常用稀硫酸清洗铁锈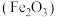 ,其反应的离子方程式为:
,其反应的离子方程式为:___________ 。
(2)某学生计划用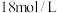 的浓硫酸配制
的浓硫酸配制 的稀硫酸500mL,需要量取浓硫酸的体积为
的稀硫酸500mL,需要量取浓硫酸的体积为___________ mL;除量筒、烧杯、试剂瓶外,还缺少的玻璃仪器有___________ 。
(3)有两份硫酸溶液,根据下表信息,回答有关问题:
①等质量两份溶液混合,则所得混合液中溶质的质量分数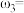
___________ (用含有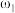 和
和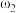 的代数式表示);
的代数式表示);
②已知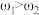 ,
,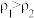 。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为
。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为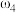 ,则
,则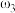
___________ 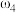 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)在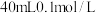 的
的 溶液中,加入足量
溶液中,加入足量 的
的 溶液使
溶液使 完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入
完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入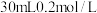 的NaOH溶液恰好反应呈中性,通过计算可知
的NaOH溶液恰好反应呈中性,通过计算可知 溶液体积为
溶液体积为___________ mL。
(5)在两份相同体积相同浓度的 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
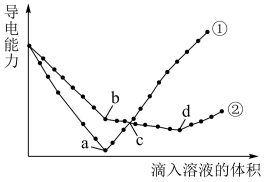
其中 和
和 反应的曲线为
反应的曲线为_____ 。(填①或②);滴定至b点时,溶液中主要存在的离子有___________ 。
(6)为方便计算,有人将98%浓硫酸表示成下列形式,其中合理的是_____ (填字母选项)。
A.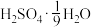 B.
B.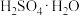
C.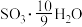 D.
D.
浓硫酸在加热条件下能和铜反应: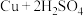 (浓)
(浓)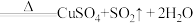 ,该反应中氧化剂和还原剂物质的量之比为
,该反应中氧化剂和还原剂物质的量之比为_____ 。
(1)稀硫酸具有酸性,其电离方程式为:
 反应生成正盐和水,其反应的离子方程式为:
反应生成正盐和水,其反应的离子方程式为: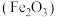 ,其反应的离子方程式为:
,其反应的离子方程式为:(2)某学生计划用
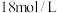 的浓硫酸配制
的浓硫酸配制 的稀硫酸500mL,需要量取浓硫酸的体积为
的稀硫酸500mL,需要量取浓硫酸的体积为(3)有两份硫酸溶液,根据下表信息,回答有关问题:
| 溶质的质量分数 | 溶液的密度 | |
| 第一份溶液 | 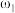 | 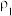 |
| 第二份溶液 | 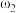 | 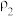 |
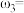
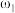 和
和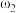 的代数式表示);
的代数式表示);②已知
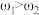 ,
,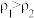 。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为
。取等体积的两份溶液混合,设所得混合液中溶质的质量分数为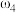 ,则
,则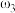
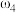 (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。(4)在
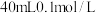 的
的 溶液中,加入足量
溶液中,加入足量 的
的 溶液使
溶液使 完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入
完全沉淀,将反应后的溶液过滤,用少量蒸馏水洗涤沉淀2-3次,将洗涤液和滤液合并后,取一半,加入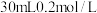 的NaOH溶液恰好反应呈中性,通过计算可知
的NaOH溶液恰好反应呈中性,通过计算可知 溶液体积为
溶液体积为(5)在两份相同体积相同浓度的
 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如下图所示:
其中
 和
和 反应的曲线为
反应的曲线为(6)为方便计算,有人将98%浓硫酸表示成下列形式,其中合理的是
A.
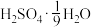 B.
B.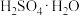
C.
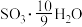 D.
D.
浓硫酸在加热条件下能和铜反应:
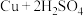 (浓)
(浓)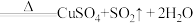 ,该反应中氧化剂和还原剂物质的量之比为
,该反应中氧化剂和还原剂物质的量之比为
您最近一年使用:0次
名校
4 . 下列有关溶液配制的叙述正确的是
| A.配制0.400 0 mol·L-1的NaOH溶液,称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容 |
| B.用已准确称量的KBrO3固体配制一定体积的0.1 mol·L-1 KBrO3溶液时,用到的玻璃仪器有烧杯、玻璃棒、容量瓶和胶头滴管 |
| C.量取27.2 mL 18.4 mol·L-1浓硫酸于烧杯中,加水稀释、冷却后转移至500 mL容量瓶中即可得1.0 mol·L-1的H2SO4溶液 |
| D.称取0.158 g KMnO4固体,放入100 mL 容量瓶中,加水溶解并稀释至刻度,即可得到0.010 mol·L-1的KMnO4溶液 |
您最近一年使用:0次
2021-12-04更新
|
628次组卷
|
4卷引用:江苏省盐城市东台中学2023-2024学年高三上学期开学考试化学试题
江苏省盐城市东台中学2023-2024学年高三上学期开学考试化学试题重庆市第八中学校2021-2022学年高三上学期期中考试化学试题(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
21-22高一上·江苏苏州·期中
名校
解题方法
5 . 根据所学知识,回答下列问题:
(1)下列几种物质,其中属于电解质的是___________ ,属于弱电解质的是___________ (填序号)
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积___________ mL。
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。
①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式___________ 。
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ 。
(1)下列几种物质,其中属于电解质的是
①CO2②H2O③盐酸④KOH⑤BaSO4⑥NH3⑦冰醋酸⑧NaHCO3⑨酒精⑩H2S
(2)配制250mL0.1mol·L-1的盐酸,应用量筒量取密度为1.25g·mL-1,质量分数为36.5%浓盐酸体积
(3)高铁酸钾(K2FeO4)是种多功能绿色水处理剂,其中铁元素的化合价为+6价。制备高铁酸钾的反应体系中有六种微粒:FeO
 、Fe(OH)3、Cl-、ClO-、OH-、H2O。
、Fe(OH)3、Cl-、ClO-、OH-、H2O。①该反应在碱性条件下进行,请写出制备高铁酸钾的离子反应方程式
②若该反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
6 . 实验室有质量分数为98%,密度为 的浓硫酸,现需配制浓度为
的浓硫酸,现需配制浓度为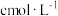 ,体积为
,体积为 的稀硫酸,则所需浓硫酸的体积为
的稀硫酸,则所需浓硫酸的体积为
 的浓硫酸,现需配制浓度为
的浓硫酸,现需配制浓度为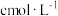 ,体积为
,体积为 的稀硫酸,则所需浓硫酸的体积为
的稀硫酸,则所需浓硫酸的体积为
A.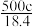 | B.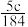 | C.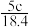 | D.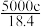 |
您最近一年使用:0次
2021-11-06更新
|
272次组卷
|
3卷引用:江苏省常州市武进区礼嘉中学2021-2022学年高一上学期阶段教学质量调研化学试题
20-21高一上·江苏镇江·阶段练习
名校
7 . 实验室用密度为1.19 g/mL、质量分数为36.5%的浓盐酸配制500 mL 0.100 mol/L盐酸。回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为_______ 。
(2)①该实验中需要用量筒量取上述浓盐酸的体积为_______
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、_______ 。
③定容时,向容量瓶中加蒸馏水至液面接近刻度线_______ 处,改用_______ 逐滴滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
(3)配制过程中,下列操作中会导致结果偏高的是_______ (填序号)。
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
求①参加反应的HCl的质量_____
②反应后溶液中MnCl2的物质的量浓度_____ (反应前后溶液的体积不变)
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度_____ 。
(1)该浓盐酸中HCl的物质的量浓度为
(2)①该实验中需要用量筒量取上述浓盐酸的体积为
②该配制实验中所需要的主要玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
③定容时,向容量瓶中加蒸馏水至液面接近刻度线
(3)配制过程中,下列操作中会导致结果偏高的是
①量取浓盐酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时有少量水
③稀释后立即移液
④移液时不小心有少量液体溅出
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)已知软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
 MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。
MnCl2+ Cl2↑+2H2O。现将一定量软锰矿石与200ml的浓盐酸反应(杂质不参加反应),制得标况下氯气5.6L。求①参加反应的HCl的质量
②反应后溶液中MnCl2的物质的量浓度
(5)实验室为确定一瓶稀NaOH的浓度,用上述所配的盐酸溶液中和25.00mL该NaOH溶液,当酸与碱恰好完全反应时,消耗盐酸溶液22.50mL。试求该NaOH的物质的量浓度
您最近一年使用:0次



