1 . CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是____________________ 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________ ;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________ 。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________ 、________________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为________________ 。
(5)萃取剂的作用是__________________ 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________ 。

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是
(2)写出NaClO3在浸出液中发生主要反应的离子方程式
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式
(3) “操作1”中包含3个基本实验操作,它们依次是
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为
(5)萃取剂的作用是
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是
您最近一年使用:0次
2 . 氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
已知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。

回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___ (“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___ ,装置C中主要反应的化学方程式为___ ,制得的AlN中可能含有氧化铝、活性炭外还可能含有___ 。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___ (写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___ 。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___ 。
已知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。

回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃
(2)装置A中发生反应的离子方程式为
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是
您最近一年使用:0次
2019-12-02更新
|
543次组卷
|
3卷引用:山东省潍坊市2020届高三9月月考化学试题
3 . 三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色、微溶于水的配合物,是合成其它一些含钴配合物的原料。下图是某科研小组以含钴废料(含少量Fe、Al 等杂质)制取[Co(NH3)6]Cl3的工艺流程:
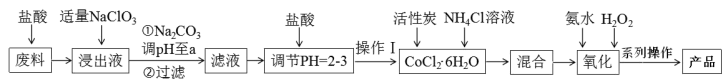
回答下列问题:
(1)写出加“适量NaClO3”发生反应的离子方程式______ 。
(2)“加Na2CO3 调pH至a”会生成两种沉淀,分别为Fe(OH)3和______ (填化学式)。
(3)操作Ⅰ的步骤包括______ 、冷却结晶、减压过滤。
(4)流程中NH4Cl除作反应物外,还可防止加氨水时c(OH-)过大,其原理是______ 。
(5)已知Co3+比Co2+更易结合OH-。“氧化”步骤,甲同学认为应先加入氨水再加入H2O2,乙同学认为试剂添加顺序对产物无影响。你认为______ (填“甲”或“乙”)同学观点正确,理由是______ 。该步骤的化学方程式H2O2+2CoCl2+2NH4Cl+10NH3·H2O=2Co(NH3)6Cl3↓+12H2O。
(6)通过碘量法可测定产品中钴的含量。将 [Co(NH3)6]Cl3 转化成Co3+后,加入过量KI 溶液,再用Na2S2O3标准液滴定(淀粉溶液做指示剂),反应原理:2Co3++2I-=2Co2++I2,I2+2S2O =2I-+S4O
=2I-+S4O ,实验过程中,下列操作会导致所测钴含量数值偏高的是
,实验过程中,下列操作会导致所测钴含量数值偏高的是______ 。
a.用久置于空气中的 KI 固体配制溶液 b.盛装Na2S2O3标准液的碱式滴定管未润洗
c.滴定结束后,发现滴定管内有气泡就读数 d.溶液蓝色褪去,立即读数

回答下列问题:
(1)写出加“适量NaClO3”发生反应的离子方程式
(2)“加Na2CO3 调pH至a”会生成两种沉淀,分别为Fe(OH)3和
(3)操作Ⅰ的步骤包括
(4)流程中NH4Cl除作反应物外,还可防止加氨水时c(OH-)过大,其原理是
(5)已知Co3+比Co2+更易结合OH-。“氧化”步骤,甲同学认为应先加入氨水再加入H2O2,乙同学认为试剂添加顺序对产物无影响。你认为
(6)通过碘量法可测定产品中钴的含量。将 [Co(NH3)6]Cl3 转化成Co3+后,加入过量KI 溶液,再用Na2S2O3标准液滴定(淀粉溶液做指示剂),反应原理:2Co3++2I-=2Co2++I2,I2+2S2O
 =2I-+S4O
=2I-+S4O ,实验过程中,下列操作会导致所测钴含量数值偏高的是
,实验过程中,下列操作会导致所测钴含量数值偏高的是a.用久置于空气中的 KI 固体配制溶液 b.盛装Na2S2O3标准液的碱式滴定管未润洗
c.滴定结束后,发现滴定管内有气泡就读数 d.溶液蓝色褪去,立即读数
您最近一年使用:0次
解题方法
4 . I.化学工业为疫情防控提供了强有力的物质支撑。N元素的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。一氯胺(NH2Cl)在中性或酸性环境中会发生强烈水解,生成具有强烈杀菌作用的HClO,是重要的水消毒剂。写出NH2Cl的电子式:_______ 。
II. 含氮材料为人类提供便利的同时,人类活动和工业化进程产生的N2O、NO和NO2等氮氧化物却对空气产生了巨大污染。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-=2 +H2O;2NO2+2OH-=
+H2O;2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有______ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是_______ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是________ (填化学式)。
(3)NO的氧化吸收:用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
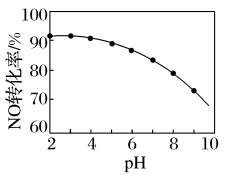
在酸性NaClO溶液中,HClO氧化NO生成Cl-和 ,其离子方程式为
,其离子方程式为______ 。
II. 含氮材料为人类提供便利的同时,人类活动和工业化进程产生的N2O、NO和NO2等氮氧化物却对空气产生了巨大污染。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH-=2
 +H2O;2NO2+2OH-=
+H2O;2NO2+2OH-= +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收:用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
在酸性NaClO溶液中,HClO氧化NO生成Cl-和
 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
5 . 如下图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
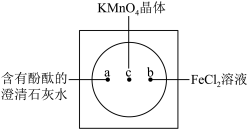
(1)氧化剂与还原剂物质的量之比为____________ ,氧化产物为_______ 。
(2)产生0.1molCl2,则转移电子的物质的量为______ mol。
(3)b处离子方程式是___________ 。
(4)高锰酸钾标准溶液经常用来滴定测量物质的含量。配平并完成下列高锰酸钾滴定草酸反应的离子方程式:_____  +
+______ H2C2O4+______  =
=____  +
+_____ CO2↑+___________

(1)氧化剂与还原剂物质的量之比为
(2)产生0.1molCl2,则转移电子的物质的量为
(3)b处离子方程式是
(4)高锰酸钾标准溶液经常用来滴定测量物质的含量。配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
 +
+ =
= +
+
您最近一年使用:0次
名校
6 . 某学习小组通过实验研究Na2O2与水的反应。
(1)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂____ (填化学式),有气体产生。
(2)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/LKMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mLKMnO4溶液。
①实验中,滴定时KMnO4溶液应装在____ (酸或碱)式滴定管中。
②配平并用用单线桥标出该反应电子转移的方向和数目:___
MnO +H2O2+H+=Mn2++O2↑+H2O
+H2O2+H+=Mn2++O2↑+H2O
③溶液a中c(H2O2)=____ mol/L。
| 操作 | 现象 |
| 向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧列反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂
(2)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/LKMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mLKMnO4溶液。
①实验中,滴定时KMnO4溶液应装在
②配平并用用单线桥标出该反应电子转移的方向和数目:
MnO
 +H2O2+H+=Mn2++O2↑+H2O
+H2O2+H+=Mn2++O2↑+H2O③溶液a中c(H2O2)=
您最近一年使用:0次
解题方法
7 . 已知海水中的溴含量约为65mg·L-1,从海水中提取溴的工业流程如图:

(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是__ 。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的___ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
________ Br2+________ CO =
=________ BrO +
+________ Br-+________ CO2↑
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为___ 。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有__ (填字母)。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯

(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
 =
= +
+(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
您最近一年使用:0次
8 . 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质).某课题以此粉末为原料,资源回收的工艺流程如下:

(1)铈(Ce)是稀土元素之一,萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP应满足的条件________________________ 。
(2)写出第①步反应的离子方程式________________________________ ,第①步不能用浓盐酸的理由____________________________________________
(3)第①步洗涤滤渣A,检验滤渣A是否洗净的方法是___________________________ ,写出第②步反应的化学方程式________________________________
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,写出制取纯硅的相关化学方程式_______________________________________________
(5)取上述流程中得到的Ce(OH)4 产品0.5g ,加硫酸溶解后,用0.1000mol/LFeSO4 标准溶液滴定到终点时( 还原产物为Ce3+ ),消耗20mL 标准溶液,该产品中Ce(OH)4 的质量分数为__________ (保留小数点后一位)。

(1)铈(Ce)是稀土元素之一,萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP应满足的条件
(2)写出第①步反应的离子方程式
(3)第①步洗涤滤渣A,检验滤渣A是否洗净的方法是
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,写出制取纯硅的相关化学方程式
(5)取上述流程中得到的Ce(OH)4 产品0.5g ,加硫酸溶解后,用0.1000mol/LFeSO4 标准溶液滴定到终点时( 还原产物为Ce3+ ),消耗20mL 标准溶液,该产品中Ce(OH)4 的质量分数为
您最近一年使用:0次
9 . 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料设计资源回收的工艺流程如下:
 (1)写出第①步反应的离子方程式
(1)写出第①步反应的离子方程式________________________ 。
(2)洗涤滤渣B的目的是为了除去_____ (填离子符号),检验该离子是否洗净的方法是_______ 。
(3)写出第③步反应的化学方程式_________________________ 。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经________ 、_______ 、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为80.00%)1.300g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为_______ mL。 (可能用到的相对原子质量 H=1 O=16 Ce =140 )
②该电解反应的化学方程式为________________ 。
 (1)写出第①步反应的离子方程式
(1)写出第①步反应的离子方程式(2)洗涤滤渣B的目的是为了除去
(3)写出第③步反应的化学方程式
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经
(5)取上述流程中得到的Ce(OH)4产品(质量分数为80.00%)1.300g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为
②该电解反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)溶液Ⅰ中的溶质为_________ (填化学式,下同),溶液Ⅱ中的溶质为__________ 。
(2)上述第③步反应中,生成沉淀的离子方程式为____________ 。
(3)该合金中铝的含量为__________ 。

(1)溶液Ⅰ中的溶质为
(2)上述第③步反应中,生成沉淀的离子方程式为
(3)该合金中铝的含量为
您最近一年使用:0次
2020-01-30更新
|
79次组卷
|
2卷引用:鲁教版高中化学必修1第四章《材料家族中的元素》测试卷2



