名校
1 . KMnO4是化工生产中的一种重要氧化剂。实验室制备并对产品含量进行测定。请回答下列问题:
(一)制备K2MnO4碱性溶液
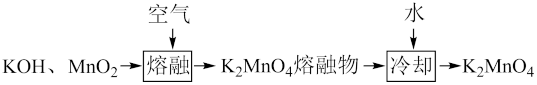 碱性溶液
碱性溶液
(1)“熔融"时应选用的仪器为______ (填选项字母);原因为_____________ 。
a.蒸发皿 b. 普通坩埚 c.铁坩埚 d.烧杯
(2)制备K2MnO4过程中消耗氧化剂和还原剂的物质的量之比为_____________ 。
(二)制备KMnO4
向所得K2MnO4溶液中通入过量CO2,溶液由墨绿色逐渐变为紫黑色并产生黑色沉淀,待反应完全,静置、抽滤,将所得溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得产品。
(3)实验室常用下图装置制备CO2。实验过程中,石灰石应放在装置的______ 部位(填“甲”、“乙”或“丙”);制取CO2时以下操作步骤正确的排列顺序是_______ (填序号)。
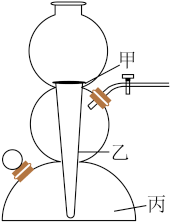
①注入稀盐酸②检查装置气密性③装入大理石
(4)制备KMnO4的离子方程式为_______________________
(三) KMnO4纯度检验
称取2.0gKMnO4产品,配成1000mL溶液,取20.00mL于锥形瓶中,并加入足量稀硫酸酸化,然后用0.02mol·L-1的亚硫酸氢钠(NaHSO3)标准溶液滴定,达到滴定终点时消耗标准溶液的体积为25.00mL。
(5)滴定时发生反应的离子方程式为______________ ;滴定到终点的现象为_____ 产品中KMnO4的质量分数为_______________
(一)制备K2MnO4碱性溶液
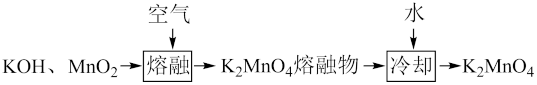 碱性溶液
碱性溶液(1)“熔融"时应选用的仪器为
a.蒸发皿 b. 普通坩埚 c.铁坩埚 d.烧杯
(2)制备K2MnO4过程中消耗氧化剂和还原剂的物质的量之比为
(二)制备KMnO4
向所得K2MnO4溶液中通入过量CO2,溶液由墨绿色逐渐变为紫黑色并产生黑色沉淀,待反应完全,静置、抽滤,将所得溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得产品。
(3)实验室常用下图装置制备CO2。实验过程中,石灰石应放在装置的

①注入稀盐酸②检查装置气密性③装入大理石
(4)制备KMnO4的离子方程式为
(三) KMnO4纯度检验
称取2.0gKMnO4产品,配成1000mL溶液,取20.00mL于锥形瓶中,并加入足量稀硫酸酸化,然后用0.02mol·L-1的亚硫酸氢钠(NaHSO3)标准溶液滴定,达到滴定终点时消耗标准溶液的体积为25.00mL。
(5)滴定时发生反应的离子方程式为
您最近一年使用:0次
2020-10-03更新
|
477次组卷
|
3卷引用:陕西省西安市第一中学2021届高三上学期模拟调研考试化学试题
陕西省西安市第一中学2021届高三上学期模拟调研考试化学试题陕西省宝鸡市凤翔中学2021届高三上学期期中考试化学试题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
2 . 为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含 、
、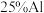 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

 第
第 步Cu与混酸反应的离子方程式为
步Cu与混酸反应的离子方程式为______  得到滤渣1的主要成分为
得到滤渣1的主要成分为______ 。
 第
第 步中加入
步中加入 的作用是
的作用是______ ,使用 的优点是
的优点是______ ;调溶液pH的目的是______ 。
 简述第
简述第 步由滤液2得到
步由滤液2得到 的方法是
的方法是______ 。
 由滤渣2制取
由滤渣2制取 ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣 酸浸液
酸浸液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣 酸浸液
酸浸液 滤液
滤液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2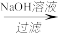 滤液
滤液 溶液
溶液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______ 方案不可行,原因是______ ;从原子利用率角度考虑,______ 方案更合理。
 用滴定法测定
用滴定法测定 含量.取a g试样配成100mL溶液,每次取
含量.取a g试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式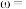
______ 。
 、
、 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:  |
| 方法Ⅲ | 用肼 还原新制 还原新制 |
 第
第 步Cu与混酸反应的离子方程式为
步Cu与混酸反应的离子方程式为 得到滤渣1的主要成分为
得到滤渣1的主要成分为 第
第 步中加入
步中加入 的作用是
的作用是 的优点是
的优点是 简述第
简述第 步由滤液2得到
步由滤液2得到 的方法是
的方法是 由滤渣2制取
由滤渣2制取 ,设计了以下三种方案:
,设计了以下三种方案:甲:滤渣
 酸浸液
酸浸液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O乙:滤渣
 酸浸液
酸浸液 滤液
滤液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O丙:滤渣2
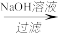 滤液
滤液 溶液
溶液 Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O上述三种方案中,
 用滴定法测定
用滴定法测定 含量.取a g试样配成100mL溶液,每次取
含量.取a g试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式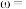
您最近一年使用:0次
名校
解题方法
3 . 高纯硝酸锶 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:

已知: 滤渣1的成分为
滤渣1的成分为 、
、 ;
; 铬酸
铬酸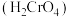 为弱酸。
为弱酸。
 酸浸不能采用高温的原因是
酸浸不能采用高温的原因是____________ ,滤液1的主要溶质是________ 。
 相对于水洗,用浓硝酸洗涤的优点是
相对于水洗,用浓硝酸洗涤的优点是___________ 。
 滤液2中过量的
滤液2中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:
,同时放出无污染的气体,写出发生反应的离子方程式:________ 。
 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由
__________ 。
 为了测定滤渣2中
为了测定滤渣2中 的含量,进行以下实验:
的含量,进行以下实验:
mg滤渣2 溶液
溶液
滴定终点时消耗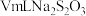 溶液
溶液 已知:
已知: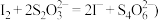 。
。
 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为
的质量分数为___________  用代数式表示
用代数式表示 。
。
 若加入的HI溶液过量太多,测定结果会
若加入的HI溶液过量太多,测定结果会_________  “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
 可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
可用于制造信号灯、光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
已知:
 滤渣1的成分为
滤渣1的成分为 、
、 ;
; 铬酸
铬酸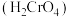 为弱酸。
为弱酸。 酸浸不能采用高温的原因是
酸浸不能采用高温的原因是 相对于水洗,用浓硝酸洗涤的优点是
相对于水洗,用浓硝酸洗涤的优点是 滤液2中过量的
滤液2中过量的 被
被 还原为
还原为 ,同时放出无污染的气体,写出发生反应的离子方程式:
,同时放出无污染的气体,写出发生反应的离子方程式: 已知
已知 类似氢氧化铝,还原后溶液的pH不能大于8的原因是
类似氢氧化铝,还原后溶液的pH不能大于8的原因是 结合离子方程式说明理由
结合离子方程式说明理由
 为了测定滤渣2中
为了测定滤渣2中 的含量,进行以下实验:
的含量,进行以下实验:mg滤渣2
 溶液
溶液
滴定终点时消耗
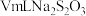 溶液
溶液 已知:
已知: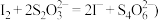 。
。 滤渣2中
滤渣2中 摩尔质量为
摩尔质量为 的质量分数为
的质量分数为 用代数式表示
用代数式表示 。
。 若加入的HI溶液过量太多,测定结果会
若加入的HI溶液过量太多,测定结果会 “偏高”“偏低”或“无影响”
“偏高”“偏低”或“无影响” 。
。
您最近一年使用:0次
2020-02-04更新
|
350次组卷
|
2卷引用:2020届高考化学二轮复习大题精准训练 ——侧重提纯类无机工艺流程题
4 . ClO2代替漂白粉等含氯消毒剂可以减少对人体的危害,但ClO2不易储存和运输,因此将其制成亚氯酸钠。
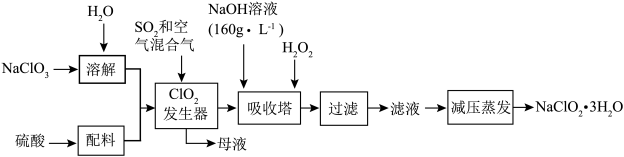
已知:①NaClO2的溶解度随温度升高而增大,温度过高易分解,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是___ (填序号)。
A将SO2氧化成SO3,增强酸性
B稀释ClO2以防止爆炸
C将NaClO3氧化成ClO2
(2)提高“ClO2发生器”反应速率的措施有___ 。
(3)吸收塔内反应的离子方程式为___ 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是___ 。
(5)测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为___ 。
②该样品中NaClO2的质量分数为___ (用含m、c、V的代数式表示,结果需化简)。

已知:①NaClO2的溶解度随温度升高而增大,温度过高易分解,适当条件下可结晶析出NaClO2·3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(1)在发生器中鼓入空气的作用可能是
A将SO2氧化成SO3,增强酸性
B稀释ClO2以防止爆炸
C将NaClO3氧化成ClO2
(2)提高“ClO2发生器”反应速率的措施有
(3)吸收塔内反应的离子方程式为
(4)采取“减压蒸发”而不用“常压蒸发”,原因是
(5)测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为
②该样品中NaClO2的质量分数为
您最近一年使用:0次
解题方法
5 . 冰晶石(Na3A1F6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:

(1)Na3AlF6中氟、铝以共价键结合,写出Na3AlF6中所含阳离子的电子式_______ ,滤渣A的主要成分是_______ (填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:
①实验3比实验2获得。Na2SiF6的质量低的原因可能是_______ 。
②选择“酸浸”时所采用的最适合条件为_______ 。
(3)写出反应③的离子方程式:_______ 。
(4)“操作i”不能用硅酸盐质设备进行分离的原因_______ 。
(5)经测定,操作i所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+_______ (填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3A1F6)=6.0×10-8)

(1)Na3AlF6中氟、铝以共价键结合,写出Na3AlF6中所含阳离子的电子式
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:
实验 编号 | 萤石品位 (CaF2含量) | 硫酸的 质量分数 | 反应温度/℃ | 获得Na2SiF6 的质量 |
1 | 96% | 25% | 60~70 | 120 |
2 | 96% | 35% | 60~70 | 153 |
3 | 96% | 35% | 80~90 | 100 |
4 | 96% | 40% | 60~70 | 141 |
②选择“酸浸”时所采用的最适合条件为
(3)写出反应③的离子方程式:
(4)“操作i”不能用硅酸盐质设备进行分离的原因
(5)经测定,操作i所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+
您最近一年使用:0次
6 . 硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1) “氧化”步骤中,加入H2O2溶液的目的是________ (用离子方程式表示)。“沉淀”步骤中,用氨水调节pH的范围是________ 。
(2) “过滤”所得滤液中含有的阳离子为Mg2+、________ 。
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、____________________ 。
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数________ 。(写出计算过程)。
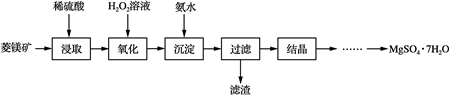
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Mg2+ | Fe2+ | Fe3+ |
| 开始沉淀 | 9.1 | 7.6 | 1.9 |
| 完全沉淀 | 11.1 | 9.7 | 3.2 |
(1) “氧化”步骤中,加入H2O2溶液的目的是
(2) “过滤”所得滤液中含有的阳离子为Mg2+、
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数
您最近一年使用:0次
2014·陕西西安·二模
名校
7 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
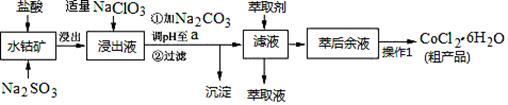
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_________________ 。
(2)写出NaClO3发生反应的主要离子方程式________________ ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________ 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为___________________ 。
(4)“操作1”中包含3个基本实验操作,它们依次是_____________ 、____________ 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是______________ ;其使用的最佳pH范围是_________ 。
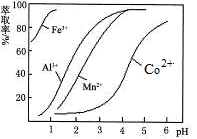
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是______________________ 。(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式
(2)写出NaClO3发生反应的主要离子方程式
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为
(4)“操作1”中包含3个基本实验操作,它们依次是
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是
您最近一年使用:0次
2016-12-09更新
|
576次组卷
|
6卷引用:2014届陕西省长安一中等五校高三第二次联考理综化学试卷
11-12高三上·安徽安庆·阶段练习
8 . 为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是___________________ ,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是___________ 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
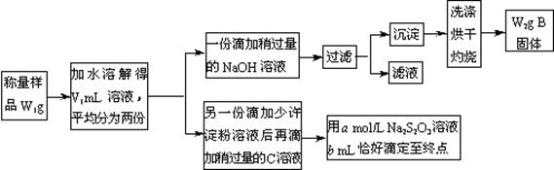
请回答下列问题:
①写出B和C的化学式:B____________ ,C________________ 。
②滴定时,判断滴定达到终点的现象是______________________ 。
③KIO3的质量分数是________________________________ (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)____________
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。

请回答下列问题:
①写出B和C的化学式:B
②滴定时,判断滴定达到终点的现象是
③KIO3的质量分数是
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
您最近一年使用:0次
名校
9 . 现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X___________ 。
(2)鉴别B在溶液中产生的阴离子的实验操作方法是___________ 。
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:___________ 。
ii.B溶液与E沉淀反应的化学方程式:___________ 。
iii.写出B与C反应至溶液呈中性的离子方程式:___________ 。
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为___________ 。
| 阳离子 | Na+、H+、Ba+ |
| 阴离子 | OH-、 、 、 |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X
(2)鉴别B在溶液中产生的阴离子的实验操作方法是
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:
ii.B溶液与E沉淀反应的化学方程式:
iii.写出B与C反应至溶液呈中性的离子方程式:
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为
您最近一年使用:0次
解题方法
10 . 为了减少煤燃烧产生的二氧化硫的排放,可以采取各种方法,其中一种方法是使用微生物脱硫技术。煤炭中以FeS2形式存在的硫,在有水和空气存在的条件下,用脱硫微生物起氧化还原作用:在细菌作用下FeS2 中的硫元素首先被氧化最高价态,然后亚铁离子继续被氧化成高价铁离子。
(1)请分别写出上述过程总离子反应方程式___________ 。
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸___________ 吨;硫酸铁___________ 吨。
(1)请分别写出上述过程总离子反应方程式
(2)某大型电厂使用的煤炭中含有FeS2的质量分数为1.2%,若每月燃烧该种煤炭100万吨,理论上回收硫酸
您最近一年使用:0次



