20-21高一上·全国·期末
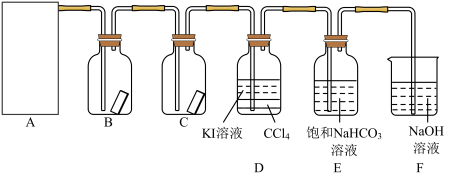
1 . 已知反应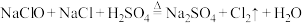 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是_______ (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是_______ ,请提出合理的改进方法:_______ 。
(3)写出氯气与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ,该反应中氧化剂与还原剂的物质的量之比为_______ 。为验证尾气吸收后的溶液中存在 ,正确的操作是
,正确的操作是_______ 。
(4)氯气通入饱和 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有_______ (填化学式)。
 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是

(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)写出氯气与
 溶液反应的离子方程式:
溶液反应的离子方程式: ,正确的操作是
,正确的操作是(4)氯气通入饱和
 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有
您最近一年使用:0次
2024-03-04更新
|
50次组卷
|
7卷引用:期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)四川省天府新区太平中学2022-2023学年高一上学期期末考试化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题(已下线)第二章单元检测 (测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题重庆市巫山县官渡中学2020-2021学年高一下学期第一次月考化学试题
名校
2 . 如图列出了 十种元素在周期表中的位置:
十种元素在周期表中的位置:
(1)上述元素中,形成化合物最多的元素是___________ (填序号),M层电子数最多的是___________ (填元素名称),最高价氧化物对应的水化物酸性最强的是___________ (填酸的化学式)。
(2)由①、③、⑨三种元素形成的离子化合物的化学式为___________ 。
(3)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)元素④与⑤形成淡黄色化合物的电子式:___________ ,该化合物中含有的作用力有___________ 。
(5)⑤、⑦的最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(6)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系:___________ 。
 十种元素在周期表中的位置:
十种元素在周期表中的位置:
(1)上述元素中,形成化合物最多的元素是
(2)由①、③、⑨三种元素形成的离子化合物的化学式为
(3)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是
(4)元素④与⑤形成淡黄色化合物的电子式:
(5)⑤、⑦的最高价氧化物对应水化物相互反应的离子方程式为
(6)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系:
您最近一年使用:0次
2024-02-22更新
|
80次组卷
|
2卷引用:安徽省阜阳市第三中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
3 . 为探究 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制 的
的 溶液,测其
溶液,测其 约为0.7,即
约为0.7,即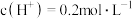 。
。
①用化学用语解释 溶液呈酸性的原因:
溶液呈酸性的原因:___________ 。
②下列实验方案中,能使 溶液
溶液 升高的是
升高的是___________ (填字母序号)。
a.加水稀释 b.加入 固体 c.滴加浓KSCN溶液 d.加入
固体 c.滴加浓KSCN溶液 d.加入 固体
固体
(2)小组同学利用上述 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:
已知: 的性质与Al相似,能发生反应:
的性质与Al相似,能发生反应:
①红褐色沉淀是:___________ (化学式),其溶度积常数表达式Ksp=___________ ,结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________ 。
②用离子方程式解释反应后溶液为浅绿色的原因:___________ 。
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的 溶液,产生气泡;
溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________ 。
b.小组同学认为上述实验无法确定黑色固体中是否含有 ,理由是
,理由是___________ 。
(3)为进一步探究上述 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
 溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
溶液中的离子平衡和离子反应,某小组同学进行了如下实验。(1)配制
 的
的 溶液,测其
溶液,测其 约为0.7,即
约为0.7,即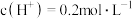 。
。①用化学用语解释
 溶液呈酸性的原因:
溶液呈酸性的原因:②下列实验方案中,能使
 溶液
溶液 升高的是
升高的是a.加水稀释 b.加入
 固体 c.滴加浓KSCN溶液 d.加入
固体 c.滴加浓KSCN溶液 d.加入 固体
固体(2)小组同学利用上述
 溶液探究其与足量锌粉的反应。实验操作及现象如表:
溶液探究其与足量锌粉的反应。实验操作及现象如表:| 操作 | 现象 |
向反应瓶中加入 锌粉,然后加入 锌粉,然后加入 的 的 溶液,搅拌 溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
 的性质与Al相似,能发生反应:
的性质与Al相似,能发生反应:
①红褐色沉淀是:
②用离子方程式解释反应后溶液为浅绿色的原因:
③分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的
 溶液,产生气泡;
溶液,产生气泡;iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是
b.小组同学认为上述实验无法确定黑色固体中是否含有
 ,理由是
,理由是(3)为进一步探究上述
 溶液中
溶液中 和
和 氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
氧化性的相对强弱,继续实验并观察到反应开始时现象如表:| 操作 | 现象 |
将 的 的 溶液与 溶液与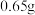 锌粉混合 锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将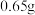 锌粉混合 锌粉混合 | 溶液中立即产生大量气泡 |
 溶液中,
溶液中, 的氧化性比
的氧化性比 更强。
更强。
您最近一年使用:0次
名校
4 . 镍氢电池是一种新型绿色电池,利用废旧镍氢电池的金属电极芯[主要成分为 、
、 及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。
及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。

已知:
① 和
和 都能与盐酸发生氧化还原反应。
都能与盐酸发生氧化还原反应。
②常温下,部分金属阳离子以氢氧化物的形式沉淀时溶液的pH见表:
提示:当离子浓度小于 时,认为该种离子沉淀完全。
时,认为该种离子沉淀完全。
回答下列问题:
(1)“步骤①”用稀硫酸浸取金属电极芯前,需先粉碎金属电极芯,粉碎的目的是_______________ 。常温下,0.05 的稀硫酸的pH=
的稀硫酸的pH=__________ ,若将该稀硫酸的温度升高到40℃,pH将__________ (填“增大”、“减小”或“不变”)。
(2)“步骤②”调pH的范围为__________ 。
(3)常温下, ,则m=
,则m=__________ 。
(4)“步骤④”中从环保角度分析不采用盐酸的原因是_______________________ 。
(5)“步骤⑤”制 的离子方程式为
的离子方程式为___________________________________ 。
(6) 在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[
在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[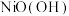 ]。该反应的离子方程式为
]。该反应的离子方程式为______________________________________ 。
 、
、 及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。
及少量铁、铝的氧化物等]生产硫酸镍﹑碳酸钴,其工艺流程如图所示。
已知:
①
 和
和 都能与盐酸发生氧化还原反应。
都能与盐酸发生氧化还原反应。②常温下,部分金属阳离子以氢氧化物的形式沉淀时溶液的pH见表:
金属阳离子 |
|
|
|
|
|
|
开始沉淀时pH | 6.3 | 1.5 | 3.4 | 7.2 | — | 7.0 |
完全沉淀时pH | 8.3 | 2.8 | 4.7 | 9.1 | 1.1 | 9.0 |
 时,认为该种离子沉淀完全。
时,认为该种离子沉淀完全。回答下列问题:
(1)“步骤①”用稀硫酸浸取金属电极芯前,需先粉碎金属电极芯,粉碎的目的是
 的稀硫酸的pH=
的稀硫酸的pH=(2)“步骤②”调pH的范围为
(3)常温下,
 ,则m=
,则m=(4)“步骤④”中从环保角度分析不采用盐酸的原因是
(5)“步骤⑤”制
 的离子方程式为
的离子方程式为(6)
 在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[
在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料[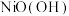 ]。该反应的离子方程式为
]。该反应的离子方程式为
您最近一年使用:0次
2023-12-05更新
|
303次组卷
|
4卷引用:期末押题卷02-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题贵州省部分学校2023-2024学年高二上学期11月期中考试化学试题安徽省安庆市怀宁县高河中学2023-2024学年高二上学期第三次月考化学试题
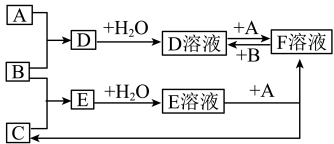
5 . 已知A、B、C为中学化学中常见的单质,A为是生产、生活中用量最大、用途最广的金属单质,室温下B是黄绿色气体,C为无色气体。在一定条件下相互转化的关系如图所示。
(1)C、F分别是什么物质:C是_____ ,F是_____ (填化学式)
(2)向D溶液中加入_____ 溶液可看到溶液变血红色。
(3)写出F溶液中加入B的离子方程式:_____ 。
(1)C、F分别是什么物质:C是
(2)向D溶液中加入
(3)写出F溶液中加入B的离子方程式:
您最近一年使用:0次
名校
6 . 某学习小组将氯气和空气按体积比1∶3混合,通入含水 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。
ⅰ. 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。
ⅱ. 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
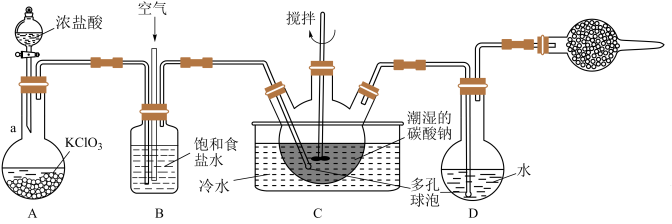
(1)仪器 的名称是
的名称是_________ ,A中发生反应的离子方程式为_________ 。
(2)实验中须控制 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用__________________ (答出2条即可)
(3)装置 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为__________________ 。
(4)将制得的 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②____________ 。设计实验探究溶液红色褪去的原因___________________________ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为______  (
( 可被
可被 还原成
还原成 )。
)。
 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。ⅰ.
 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。ⅱ.
 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
(1)仪器
 的名称是
的名称是(2)实验中须控制
 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用(3)装置
 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为(4)将制得的
 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
2023-08-22更新
|
746次组卷
|
5卷引用:专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
(已下线)专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题海南省白沙学校2023-2024学年高一上学期期末考试化学试题四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题
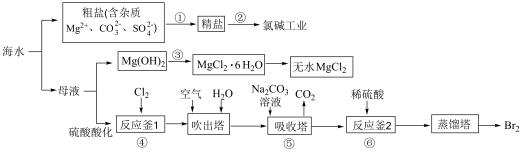
7 . 海洋资源是当今世界资源开发利用的重点领域之一,请回答下列相关问题: 溶液和
溶液和___________ ,过滤后加入___________ 调节pH,经蒸发结晶后得到精盐;氯碱工业中电解饱和食盐水,得到烧碱、氢气和氯气,其离子方程式为___________ 。
(2)向母液中加入氢氧化钠溶液,经过滤、洗涤得到氢氧化镁,判断沉淀已洗涤干净的操作是___________ 。镁元素在元素周期表中的位置为___________ , 中离子半径:
中离子半径:
_______ (填“>”或“<”)
(3)反应釜1中每得到8g溴,理论上至少需要___________ L氯气(标准状况);在吸收塔中,发生反应的离子方程式为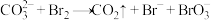 ,请将该离子方程式配平,并用单线桥法标出电子的转移方向和数目:
,请将该离子方程式配平,并用单线桥法标出电子的转移方向和数目:___________ ;向反应釜2中加硫酸,发生反应的离子方程式是___________ 。
(4)设计简单的实验验证溴的非金属性比碘强,其操作及现象是___________ (可选择的试剂:溴水、碘水、苯、NaBr溶液、KI溶液、淀粉溶液)。
 溶液和
溶液和(2)向母液中加入氢氧化钠溶液,经过滤、洗涤得到氢氧化镁,判断沉淀已洗涤干净的操作是
 中离子半径:
中离子半径:

(3)反应釜1中每得到8g溴,理论上至少需要
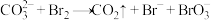 ,请将该离子方程式配平,并用单线桥法标出电子的转移方向和数目:
,请将该离子方程式配平,并用单线桥法标出电子的转移方向和数目:(4)设计简单的实验验证溴的非金属性比碘强,其操作及现象是
您最近一年使用:0次
解题方法
8 . 氮化锶( )在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。
)在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。 通过
通过___________ 法制得。Sr的单质与氧气加热反应时能生成过氧化锶,过氧化锶的电子式为___________ 。
(2)用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气,其反应的离子方程式是___________ ,该反应中每生成标准状况下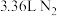 ,转移电子的物质的量为
,转移电子的物质的量为___________ 。
(3)装置C中装有___________ ,实验时,先点燃酒精灯___________ (填“A”或“B”),原因是___________
(4)氮化锶要干燥保存,遇水会剧烈反应,有氨气产生,该反应的化学方程式为___________ 。
 )在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。
)在工业上广泛应用于生产荧光粉,遇水会剧烈反应。某化学兴趣小组利用如图所示装置制备氮化锶并检验其性质(部分夹持装置略)。请回答下列问题。
 通过
通过(2)用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气,其反应的离子方程式是
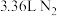 ,转移电子的物质的量为
,转移电子的物质的量为(3)装置C中装有
(4)氮化锶要干燥保存,遇水会剧烈反应,有氨气产生,该反应的化学方程式为
您最近一年使用:0次
9 . I.硫酸亚铁晶体(FeSO4·7H2O)是一种重要的食品或饲料添加剂,实验室用严重锈蚀的废铁屑(含有Fe、Fe2O3)为原料制备硫酸亚铁晶体(FeSO4·7H2O),其流程如下:

回答下列问题:
(1) 与稀硫酸反就的离子方程式为
与稀硫酸反就的离子方程式为___________ 。
(2)溶液 中加过量铁粉时,反应的离子方程式为
中加过量铁粉时,反应的离子方程式为___________ 。
(3)若检验溶液 中不存在
中不存在 ,可选择的方法是:
,可选择的方法是:___________ 。
(4) 晶体应密封保存,主要目的是
晶体应密封保存,主要目的是___________ 。
Ⅱ.测定补铁剂中铁元素的含量。

(5) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素 ,维生素C的作用是
,维生素C的作用是___________ 。
(6)计算每片该补铁剂含铁元素的质量为___________ g。

回答下列问题:
(1)
 与稀硫酸反就的离子方程式为
与稀硫酸反就的离子方程式为(2)溶液
 中加过量铁粉时,反应的离子方程式为
中加过量铁粉时,反应的离子方程式为(3)若检验溶液
 中不存在
中不存在 ,可选择的方法是:
,可选择的方法是:(4)
 晶体应密封保存,主要目的是
晶体应密封保存,主要目的是Ⅱ.测定补铁剂中铁元素的含量。

(5)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素 ,维生素C的作用是
,维生素C的作用是(6)计算每片该补铁剂含铁元素的质量为
您最近一年使用:0次
名校
解题方法
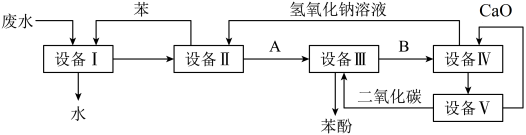
10 . 含苯酚的工业废水的处理流程如图所示。请回答下列问题:_____ 、_____ (填操作名称)。由设备II进入设备III的物质A是_____ (填化学式)。由设备III进入设备IV的物质B是_____ (填化学式)。
(2)设备III中反应的离子方程式为_____ 。
(3)设备VI中物质B的水溶液和CaO反应后,产物是NaOH、H2O和_____ (填化学式)。通过_____ (填操作名称),产物相互分离。
(4)图中能循环使用的物质有NaOH溶液、_____ 、_____ 、CaO。(填化学式)
(2)设备III中反应的离子方程式为
(3)设备VI中物质B的水溶液和CaO反应后,产物是NaOH、H2O和
(4)图中能循环使用的物质有NaOH溶液、
您最近一年使用:0次
2023-07-14更新
|
121次组卷
|
2卷引用:名校期末好题汇编-烃的衍生物(非选择题)







