名校
解题方法
1 . 还原反应在工农业生产和日常生活中有广泛运用
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是___________ ;
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有___________ 。 (填“氧化性”或“还原性”);
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是___________ 。(填“氧化作用”或“还原作用”);
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是___________ ;
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式___________ 。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C所起的作用是
(4)缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
(5)Fe3+在工业上有重要用途。例如印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路,生成CuCl2和FeCl2,写出离子方程式
您最近一年使用:0次
2024-02-29更新
|
53次组卷
|
2卷引用:海南省海口市第一中学2023-2024学年高一上学期期末考试化学试题(重点班)
名校
解题方法
2 . NaClO、 、
、 为常见高效的消毒剂和漂白剂。
为常见高效的消毒剂和漂白剂。
(1) 是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为
是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为 (未配平)。该反应中
(未配平)。该反应中 与
与 的化学计量数之比为
的化学计量数之比为___________ (不考虑 的分解)。
的分解)。
(2)①“84”消毒液的有效成分为NaClO。工业上常用碱性NaClO废液吸收 ,部分催化过程如图所示。“过程1”中
,部分催化过程如图所示。“过程1”中 是
是___________ (填“氧化剂”或“还原剂”),当 和
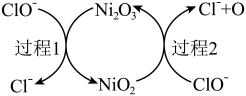
和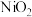 以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为___________ 。
②NaClO可在碱性条件下将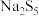 氧化为
氧化为 ,而自身被还原为NaCl,则
,而自身被还原为NaCl,则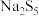 与NaClO的个数比为
与NaClO的个数比为___________ 。
(3)以氯酸钠、硫酸和二氧化硫为原料制备 ,进而再利用
,进而再利用 与
与 溶液反应制备亚氯酸钠(
溶液反应制备亚氯酸钠( ),具体流程如下:
),具体流程如下:
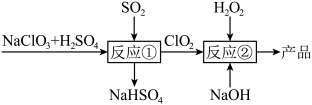
反应①的离子方程式为___________ ;理论上,该流程中参与反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
 、
、 为常见高效的消毒剂和漂白剂。
为常见高效的消毒剂和漂白剂。(1)
 是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为
是国际上公认的安全绿色消毒剂。可用氯酸钠和H2O2溶液在酸性条件下制备,反应的化学方程式为 (未配平)。该反应中
(未配平)。该反应中 与
与 的化学计量数之比为
的化学计量数之比为 的分解)。
的分解)。(2)①“84”消毒液的有效成分为NaClO。工业上常用碱性NaClO废液吸收
 ,部分催化过程如图所示。“过程1”中
,部分催化过程如图所示。“过程1”中 是
是 和
和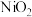 以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
以物质的量之比1∶2发生“过程2”的反应,该反应的离子方程式为
②NaClO可在碱性条件下将
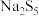 氧化为
氧化为 ,而自身被还原为NaCl,则
,而自身被还原为NaCl,则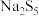 与NaClO的个数比为
与NaClO的个数比为(3)以氯酸钠、硫酸和二氧化硫为原料制备
 ,进而再利用
,进而再利用 与
与 溶液反应制备亚氯酸钠(
溶液反应制备亚氯酸钠( ),具体流程如下:
),具体流程如下:
反应①的离子方程式为
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
3 . I.请回答。
(1)按照有机物的命名规则,下列命名正确的是___________ 。
A.3-乙基己烷 B.2-乙基戊烷, C.1,2-二甲基丁烷 D.4-甲基戊烷
写出该物质的结构简式:___________ 。
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓慢反应一段时间。___________ (A升高;B降低;C不变);右端玻璃管的作用是___________ 。
(3)若水中含有Na2SiO3,则在U形管左端会观察到现象是___________ ;若水中含有AgNO3,则水中反应离子方程式___________ 。
(4)若题目中甲烷与氯气的体积比为1:1,则得到的产物为___________(填字母)。
(5)若把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是___________ 。
①黄绿色逐渐消失 ②试管壁上有黄色油珠出现
③水位在试管内上升到一定高度 ④水槽内有少量晶体析出
⑤液面上有白雾
(1)按照有机物的命名规则,下列命名正确的是
A.3-乙基己烷 B.2-乙基戊烷, C.1,2-二甲基丁烷 D.4-甲基戊烷
写出该物质的结构简式:
Ⅱ.如图所示,U形管的左端用橡胶塞封闭,充有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解可以忽略不计。将封闭有甲烷和氯气混合气体的装置放置在有漫射光的地方让混合气体缓慢反应一段时间。
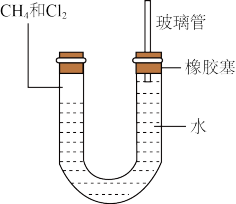
(3)若水中含有Na2SiO3,则在U形管左端会观察到现象是
(4)若题目中甲烷与氯气的体积比为1:1,则得到的产物为___________(填字母)。
| A.CH3Cl、HCl | B.CCl4、HCl |
| C.CH3Cl、CH2Cl2 | D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl |
(5)若把1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,试推测可观察到的现象是
①黄绿色逐渐消失 ②试管壁上有黄色油珠出现
③水位在试管内上升到一定高度 ④水槽内有少量晶体析出
⑤液面上有白雾
您最近一年使用:0次
2024-02-20更新
|
368次组卷
|
2卷引用:上海市曹杨第二中学2023-2024学年高二上学期化学期末卷
名校
4 . 现有以下物质:①Ca(HCO3)2溶液;②CO2;③熔融Na2CO3;④NaOH;⑤SiO2;⑥Fe(OH)3胶体;⑦氨水;⑧Na2O2
(1)其中能导电的电解质:_________ (填编号,下同);属于非电解质的是:_________ 。
(2)请写出①和过量④的离子反应方程式__________________ 。
(3)利用 Fe(OH)3胶体进行下列实验:将其装入 形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带
形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带_________ 电荷(填“正”或“负”)。
(4)⑤为酸性氧化物,写出④与⑤反应的离子方程式__________________ 。
(5) Na2O2可作熔矿剂和氧化剂,则高温熔融条件下可将Cr2O3氧化为Na2CrO4,该反应的化学方程式为__________________ 。
(1)其中能导电的电解质:
(2)请写出①和过量④的离子反应方程式
(3)利用 Fe(OH)3胶体进行下列实验:将其装入
 形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带
形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带(4)⑤为酸性氧化物,写出④与⑤反应的离子方程式
(5) Na2O2可作熔矿剂和氧化剂,则高温熔融条件下可将Cr2O3氧化为Na2CrO4,该反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 现有A、B、C、D四种可溶性物质,它们溶于水后电离产生的所有离子如下表所示:(各物质中所含离子均不相同)
已知:①A物质是中学里用来检验 的盐;
的盐;
②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A_______ ,D_______ 。
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式_______ 。
(3)检验溶液中 是否变质的方法是
是否变质的方法是_______ 。
(4)D物质和C物质在溶液中反应的离子方程式为_______ 。
| 阳离子 |  、 、 、 、 、 、 |
| 阴离子 |  、 、 、 、 、 、 |
 的盐;
的盐;②向B物质的溶液中滴入无色酚酞溶液,呈红色;
③C物质分别与其它三种物质在溶液中反应均能产生白色沉淀,且B和C反应产生的白色沉淀会迅速变为灰绿色,最后变为红褐色。
回答下列问题:
(1)写出下列物质的化学式:A
(2)写出③中沉淀颜色变化过程中涉及的化学反应方程式
(3)检验溶液中
 是否变质的方法是
是否变质的方法是(4)D物质和C物质在溶液中反应的离子方程式为
您最近一年使用:0次
名校
6 . 现有下列七种物质:① ②过氧化钠③氧化铁④
②过氧化钠③氧化铁④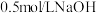 溶液⑤碳酸氢钠⑥
溶液⑤碳酸氢钠⑥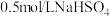 溶液⑦次氯酸钠。请根据上述物质回答下列问题:
溶液⑦次氯酸钠。请根据上述物质回答下列问题:
(1)在上述物质中属于电解质的有______________ (填①~⑦序号)
(2)含有 氧原子的②与足量①反应,产生气体在标准状况下的体积为
氧原子的②与足量①反应,产生气体在标准状况下的体积为_______ L。
(3)写出③物质的一种用途_____________________ 。
(4)某同学帮助水质检测站配制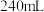 ④溶液以备使用。
④溶液以备使用。
①该同学应用托盘天平称取NaOH固体_______ g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_______ 。
③定容时仰视刻度线,则所配制的溶液的浓度会_______ (填“偏高”、“偏低”、“不变”)。
(5)⑤⑥两种溶液混合可以发生反应,离子方程式为_____________________
(6)废水脱氮工艺有一种方法是在废水中加入过量⑦使 完全转化为
完全转化为 ,此方法可用离子方程式表示为:
,此方法可用离子方程式表示为: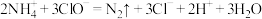 。用单线桥法在离子方程式上标出电子转移的方向和数目
。用单线桥法在离子方程式上标出电子转移的方向和数目_______ ;该反应中氧化剂与还原剂的物质的量之比为_______ 。
 ②过氧化钠③氧化铁④
②过氧化钠③氧化铁④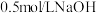 溶液⑤碳酸氢钠⑥
溶液⑤碳酸氢钠⑥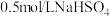 溶液⑦次氯酸钠。请根据上述物质回答下列问题:
溶液⑦次氯酸钠。请根据上述物质回答下列问题:(1)在上述物质中属于电解质的有
(2)含有
 氧原子的②与足量①反应,产生气体在标准状况下的体积为
氧原子的②与足量①反应,产生气体在标准状况下的体积为(3)写出③物质的一种用途
(4)某同学帮助水质检测站配制
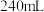 ④溶液以备使用。
④溶液以备使用。①该同学应用托盘天平称取NaOH固体
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
③定容时仰视刻度线,则所配制的溶液的浓度会
(5)⑤⑥两种溶液混合可以发生反应,离子方程式为
(6)废水脱氮工艺有一种方法是在废水中加入过量⑦使
 完全转化为
完全转化为 ,此方法可用离子方程式表示为:
,此方法可用离子方程式表示为: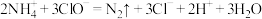 。用单线桥法在离子方程式上标出电子转移的方向和数目
。用单线桥法在离子方程式上标出电子转移的方向和数目
您最近一年使用:0次
2023-03-27更新
|
465次组卷
|
4卷引用:辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题
辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 (已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高一上学期1月期末化学试题河南省南阳市社旗县第一高级中学2023-2024学年高三上学期1月月考化学试题
7 . 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为______ ,然后加入适量的______ ,(从下面四个选项选择)调节溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常残留在溶液中的离子浓度小于1×10-5mol∙L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol∙L-1,则Cu(OH)2开始沉淀时溶液的pH为______ , 完全沉淀时溶液的pH为
完全沉淀时溶液的pH为______ ,通过计算确定上述方案______ (填“可行”或“不可行”)。
(3)pH=6,CuSO4溶液中由水电离出的c(H+)是______ 。
(1)为除去溶液中的Fe2+,可先加入
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常残留在溶液中的离子浓度小于1×10-5mol∙L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol∙L-1,则Cu(OH)2开始沉淀时溶液的pH为
 完全沉淀时溶液的pH为
完全沉淀时溶液的pH为(3)pH=6,CuSO4溶液中由水电离出的c(H+)是
您最近一年使用:0次
2023-03-13更新
|
255次组卷
|
3卷引用:河北省石家庄市辛集市2022-2023学年高二上学期期末教学质量监测化学试题
河北省石家庄市辛集市2022-2023学年高二上学期期末教学质量监测化学试题(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)河北省石家庄市西山学校2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 按要求书写方程式
(1)少量铁与稀硝酸反应的离子方程式:_______ 。
(2)Na2S2O3和稀硫酸反应的离子方程式:_______ 。
(3)SO2催化氧化的化学方程式:_______ 。
(4)NO2气体溶于水的化学方程式:_______ 。
(5)工业制备粗硅的化学方程式:_______ 。
(6)负极电极方程式:_______ 。

(1)少量铁与稀硝酸反应的离子方程式:
(2)Na2S2O3和稀硫酸反应的离子方程式:
(3)SO2催化氧化的化学方程式:
(4)NO2气体溶于水的化学方程式:
(5)工业制备粗硅的化学方程式:
(6)负极电极方程式:

您最近一年使用:0次
19-20高一·全国·期末
解题方法
9 . (I)现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的有___ 。
(2)属于非电解质的有___ 。
(3)除去③中少量②的操作是___ ,化学方程式为___ 。
(4)若在⑦中缓慢加入①的水溶液,产生的现象是___ 。
(II)NaClO是“84”消毒液的有效成分。请回答下列问题。
(1)NaClO中Cl元素的化合价是________ ;
(2)用氢氧化钠溶液和氯气反应制备“84”消毒液,反应的离子方程式是________ 。
(3)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是________ 。
(1)上述十种物质中,属于电解质的有
(2)属于非电解质的有
(3)除去③中少量②的操作是
(4)若在⑦中缓慢加入①的水溶液,产生的现象是
(II)NaClO是“84”消毒液的有效成分。请回答下列问题。
(1)NaClO中Cl元素的化合价是
(2)用氢氧化钠溶液和氯气反应制备“84”消毒液,反应的离子方程式是
(3)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是
您最近一年使用:0次
19-20高一·全国·期末
名校
解题方法
10 . Ⅰ.NaHSO4可用作清洁剂、防腐剂等。
(1)下列关于NaHSO4的说法正确的是______ 。
A.NaHSO4固体能导电 B.NaHSO4溶液的导电性一定强于CH3COOH溶液
C. NaHSO4属于强电解质 D.NaHSO4溶液显中性
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为________________ 。
(3)将0.8 mol⋅L−1 NaHSO4与0.4 mol⋅L−1 Ba(OH)2溶液等体积混合,发生反应的离子方程式为________________________ 。
Ⅱ.请按要求回答下列问题:
(1)KAl(SO4)2的电离方程式__________________________ 。
(2)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是__________________________ 。
(3)反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中H2O2的变化过程为H2O2→O2。
①该反应的还原剂是________ (填化学式)。
②在该反应方程式中用双线桥法标明电子转移的方向和数目。________
③若反应中转移了3mol电子,则产生的气体在标准状况下体积为_______ L。
(1)下列关于NaHSO4的说法正确的是
A.NaHSO4固体能导电 B.NaHSO4溶液的导电性一定强于CH3COOH溶液
C. NaHSO4属于强电解质 D.NaHSO4溶液显中性
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为
(3)将0.8 mol⋅L−1 NaHSO4与0.4 mol⋅L−1 Ba(OH)2溶液等体积混合,发生反应的离子方程式为
Ⅱ.请按要求回答下列问题:
(1)KAl(SO4)2的电离方程式
(2)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是
(3)反应2H2CrO4+3H2O2=2Cr(OH)3 +3O2↑+2H2O中H2O2的变化过程为H2O2→O2。
①该反应的还原剂是
②在该反应方程式中用双线桥法标明电子转移的方向和数目。
③若反应中转移了3mol电子,则产生的气体在标准状况下体积为
您最近一年使用:0次



