20-21高一·全国·课时练习
解题方法
1 . 某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:

(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+═Mg2++H2↑,________________________
②__________________ ,____________________ ;Mg2++2OH-═Mg(OH)2↓
③_____________________ ,CO2+2H2O+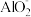 ═Al(OH)3↓+
═Al(OH)3↓+
④________________________ ;
(2)该样品中铝的质量分数是________________________
(3)第②步中加入NaOH溶液不足时,会使测定结果_____________ 第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果________________________ 第④步对沉淀灼烧不充分时,会使测定结果_____________ 。
A.偏高 B.偏低 C.不影响。

(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+═Mg2++H2↑,
②
③
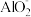 ═Al(OH)3↓+
═Al(OH)3↓+
④
(2)该样品中铝的质量分数是
(3)第②步中加入NaOH溶液不足时,会使测定结果
A.偏高 B.偏低 C.不影响。
您最近一年使用:0次
解题方法
2 . 某同学设计了如下实验方法分离KNO3和Ba(NO3)2两种固体混合物并测定其含量:

(1)操作①的名称是____________ ,试剂a是____________ (填化学式)。
(2)加入K2CO3溶液所发生反应的离子方程式是__________ 。
(3)按此实验方案分离得到的KNO3,经分析含有杂质K2CO3,除去K2CO3的操作为___________
(4)过滤后洗涤沉淀B的实验操作为________________ 。
(5)实验前称量混合物A的质量为m g,称量经洗涤干燥后的沉淀B的质量为w g,则混合物中Ba(NO3)2质量分数为______________________ 。

(1)操作①的名称是
(2)加入K2CO3溶液所发生反应的离子方程式是
(3)按此实验方案分离得到的KNO3,经分析含有杂质K2CO3,除去K2CO3的操作为
(4)过滤后洗涤沉淀B的实验操作为
(5)实验前称量混合物A的质量为m g,称量经洗涤干燥后的沉淀B的质量为w g,则混合物中Ba(NO3)2质量分数为
您最近一年使用:0次
解题方法
3 . 根据所学知识,回答下列问题:
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是__________ 。高铁酸钠可与水反应生成Fe(OH)3胶体、氢氧化钠和氧气,写出相应的离子方程式:_____________ 。
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式_____________ ,该反应中属于电解质但不属于氧化物的物质是________________ (填化学式),若制得22.4L(折算为标准状况下)钠蒸气,转移电子的数目为________________ 。
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为___________ %(用含A、K的式子表示)。
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______ 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________ 。
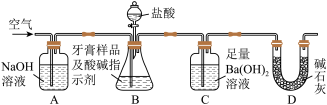
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_____ 。
(4)C中反应生成沉淀的离子方程式是__________ 。
(5)下列各项措施中,不能提高测定准确度的是____ (填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体 b.滴加盐酸不宜过快c.在A-B之间增添盛有浓硫酸的洗气装置d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO
 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)C中反应生成沉淀的离子方程式是
(5)下列各项措施中,不能提高测定准确度的是
a.在加入盐酸之前,应排净装置内的CO2气体 b.滴加盐酸不宜过快c.在A-B之间增添盛有浓硫酸的洗气装置d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
您最近一年使用:0次
解题方法
5 . 实验题
化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生.
I.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水充足搅拌,过滤.
(1)往滤渣中加入过量NaOH溶液,过滤. 氢氧化铝与NaOH溶液反应的离子方程式是_______ .
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.这一过程发生反应的化学方程式依次为:__________________________________ ,__________________________________ .
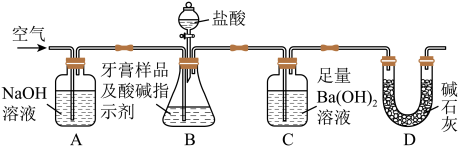
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B,C中的反应物外,还有:_________ .
(4)C中反应生成BaCO3的离子方程式是___________________________________ .
(5)下列各项措施中,不能提高测定准确度的是( ) (填标号).
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________ .
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是_________________ .
(8)装置中U形管D中的碱石灰的作用是_____________________________ .
化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生.
I.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水充足搅拌,过滤.
(1)往滤渣中加入过量NaOH溶液,过滤. 氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.这一过程发生反应的化学方程式依次为:
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B,C中的反应物外,还有:
(4)C中反应生成BaCO3的离子方程式是
(5)下列各项措施中,不能提高测定准确度的是
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是
(8)装置中U形管D中的碱石灰的作用是
您最近一年使用:0次
名校
解题方法
6 . 某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3 的过程如下:

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为________________ ;固体A 是___________ (填化学式),写出沉淀F 转化为氧化铝的化学方程式是___________________________ 。
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________ ;固体X的主要用途有(写出1条即可) _____ 。沉淀Z为_______ (填化学式)。由溶液K生成沉淀M的离子方程式是_________________________ 。
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________ (保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol 电子,反应的化学方程式是__________________ 。

(1)流程甲中加入盐酸后生成Fe3+的离子方程式为
(2)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是
(3)流程乙中,将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol 碳单质,转移1mol 电子,反应的化学方程式是
您最近一年使用:0次
7 . 某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3)制备绿矾(FeSO4·7H2O)并测定烧渣中铁元素的含量,流程图如下:

(1)操作a的名称是_____________ 。
(2)加入足量试剂X后,发生反应的离子方程式为_____________ 、_____________ 。
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是_______ 、_________ 。
(4)硫铁矿烧渣中铁元素的质量分数为________ 。

(1)操作a的名称是
(2)加入足量试剂X后,发生反应的离子方程式为
(3)向溶液2中滴加KSCN溶液,无明显现象。向固体中加入足量稀硫酸后,发生氧化还原反应的离子方程式是
(4)硫铁矿烧渣中铁元素的质量分数为
您最近一年使用:0次
解题方法
8 . 某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
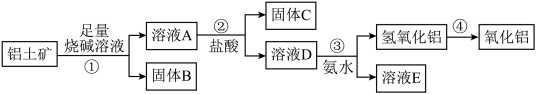
(1)固体B的主要用途有(写出1条即可)_________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:_______________ ;________________ 。
(3)第③步中,生成氢氧化铝的离子方程式是_________________ 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________ 。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________ 。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)

(1)固体B的主要用途有(写出1条即可)
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:
(3)第③步中,生成氢氧化铝的离子方程式是
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
您最近一年使用:0次
9 . 某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________ ,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及________________________________
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是_____________________ ,反应的化学方程式是________________________ ,_____________________
(5)该样品中铝的质量分数是:_______________________________ (用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________

已知:Si+2NaOH+H2O=Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:
(2)步骤③中生成沉淀的离子方程式为:
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是
(5)该样品中铝的质量分数是:
(6)下列因操作不当,会使测定结果偏大的是
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第④步中的沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
您最近一年使用:0次
名校
10 . 现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X___________ 。
(2)鉴别B在溶液中产生的阴离子的实验操作方法是___________ 。
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:___________ 。
ii.B溶液与E沉淀反应的化学方程式:___________ 。
iii.写出B与C反应至溶液呈中性的离子方程式:___________ 。
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为___________ 。
| 阳离子 | Na+、H+、Ba+ |
| 阴离子 | OH-、 、 、 |
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出下列物质的名称:X
(2)鉴别B在溶液中产生的阴离子的实验操作方法是
(3)按要求完成以下水溶液中的反应方程式:
i.A溶液与B溶液反应的离子方程式:
ii.B溶液与E沉淀反应的化学方程式:
iii.写出B与C反应至溶液呈中性的离子方程式:
(4)D与E的混合物ag,加入足量盐酸,充分反应后生成标准状况时的气体bL,则D在混合物中的质量分数为
您最近一年使用:0次



