名校
解题方法
1 . 现有一定量含有Na2O杂质的Na2O2试样,用如下图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量,可供选用的反应物:CaCO3固体、盐酸、稀硫酸和蒸馏水)。
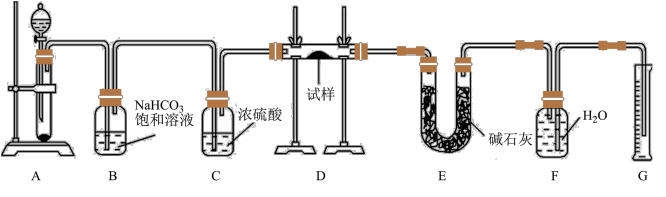
回答下列问题:
(1)装置A中盛装液体的仪器名称为______ 。
(2)写出A中发生反应的离子方程式____________________ 。
(3)装置B的作用是______ ,不能用Na2CO3溶液的原因是____________________ (用化学方程式解释)
(4)装置E中碱石灰的作用是____________________ 。
(5)15.6 g Na2O2与CO2完全反应转移的电子数目为______ 。
(6)若开始时测得试样的质量为3.0 g,反应结束后测得收集气体折算到标准状况下体积为336 mL,则试样中Na2O2的质量分数为______ 。

回答下列问题:
(1)装置A中盛装液体的仪器名称为
(2)写出A中发生反应的离子方程式
(3)装置B的作用是
(4)装置E中碱石灰的作用是
(5)15.6 g Na2O2与CO2完全反应转移的电子数目为
(6)若开始时测得试样的质量为3.0 g,反应结束后测得收集气体折算到标准状况下体积为336 mL,则试样中Na2O2的质量分数为
您最近一年使用:0次
2023-11-02更新
|
90次组卷
|
2卷引用:四川省凉山州西昌市2022-2023学年高一上学期期中考试化学试题
名校
2 . 氯碱工业的产物可用于制取“84”消毒液的主要成份次氯酸钠。
I.常温下,将 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
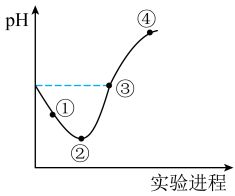
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
(2)③点所示溶液中:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);
(3)比较水的电离程度:曲线③点处___________ 曲线②点处。
II.探究发现 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
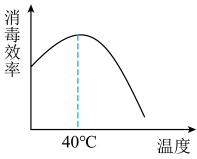
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因_______ 。
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中 的含量。
的含量。
其实验步骤为:称取工业烧碱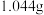 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)
(5)上述实验步骤中需要用到的全部定量仪器有:___________ 。
(6)计算该样品中 的质量分数为
的质量分数为___________ 。(用小数表示,保留至小数点后第3位)
(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
I.常温下,将
 缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入
缓慢通入一定量的水中至饱和,然后向所得饱和氧水中逐滴加入 的氢氧化钠溶液,整个过程中
的氢氧化钠溶液,整个过程中 变化如图所示,回答下列问题:
变化如图所示,回答下列问题:
(1)在新制氯水中,下列关系正确的是___________(选填编号)。
A.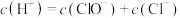 | B. |
C.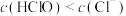 | D.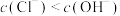 |
(2)③点所示溶液中:

 (填“
(填“ ”“
”“ ”或“
”或“ ”,下同);
”,下同);(3)比较水的电离程度:曲线③点处
II.探究发现
 溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
溶液的消毒效率与温度有关(如图所示),因此浓漂白液稀释时,应保持温度在40℃以下。
(4)试从水解平衡角度和物质变化的相关知识解释40℃前后变化趋势不同的可能原因
III.氯碱工厂的烧碱产品常含有碳酸钠、氯化钠,可用“中和滴定氯化钡法”测定其中
 的含量。
的含量。其实验步骤为:称取工业烧碱
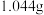 ,配成
,配成 溶液,取出
溶液,取出 ,先加入
,先加入 溶液(过量),然后滴入酚酞指示剂,再用
溶液(过量),然后滴入酚酞指示剂,再用 的盐酸滴定至终点,平均消耗盐酸
的盐酸滴定至终点,平均消耗盐酸 。(已知:
。(已知: 溶解时的
溶解时的 )
)(5)上述实验步骤中需要用到的全部定量仪器有:
(6)计算该样品中
 的质量分数为
的质量分数为(7)某次检测发现,实验值明显高于理论值,原因可能是___________。(选填编号)
| A.工业烧碱已发生潮解 | B.滴定时往锥形瓶中加水 |
| C.配制的待测液敞口放置时间过长 | D.滴定管水洗后未用标准盐酸润洗 |
您最近一年使用:0次
名校
3 . 硫及其化合物之间的转化具有重要意义。请按要求回答下列问题。
(1)土壤中的微生物可将大气中H2S经两步反应氧化成 ,两步反应的能量变化如图,写出1molH2S(g)全部氧化成
,两步反应的能量变化如图,写出1molH2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为___________ 。________ 。
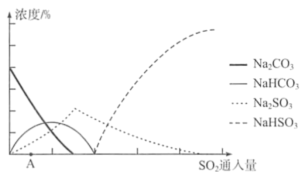
(3)利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。___________
②下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是___________ ___________ 。
④为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
i.用化学反应原理解释NaOH过量的原因___________ 。
ii.结晶时应选择的最佳操作是___________ (选填字母)
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
⑤为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是___________ 。
⑥KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
i.滴定终点前反应的离子方程式是:_______ ,___ +__
+__ =___+___(将方程式补充完整)
=___+___(将方程式补充完整)
ii.成品中Na2SO3 (M=126g/mol)的质量分数是___________ 。
(1)土壤中的微生物可将大气中H2S经两步反应氧化成
 ,两步反应的能量变化如图,写出1molH2S(g)全部氧化成
,两步反应的能量变化如图,写出1molH2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为
(3)利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。

②下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是

④为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
i.用化学反应原理解释NaOH过量的原因
ii.结晶时应选择的最佳操作是
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
⑤为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是
⑥KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
i.滴定终点前反应的离子方程式是:
 +__
+__ =___+___(将方程式补充完整)
=___+___(将方程式补充完整)ii.成品中Na2SO3 (M=126g/mol)的质量分数是
您最近一年使用:0次
解题方法
4 . 某实验小组以BaS溶液为原料制备 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:
可选用试剂:NaCl晶体、BaS溶液、 溶液、
溶液、 溶液、浓硫酸、蒸馏水
溶液、浓硫酸、蒸馏水
步骤1. 的制备
的制备
按图1所示装置进行实验,得到 溶液,经蒸发浓缩、冷却结晶、过滤等步骤获得
溶液,经蒸发浓缩、冷却结晶、过滤等步骤获得 产品。
产品。
步骤2.产品中 的含量测定
的含量测定
①称取产品0.5000g,用水溶解,配成25mL溶液;
②用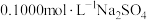 标准溶液滴定①所得溶液,测得溶液电导率
标准溶液滴定①所得溶液,测得溶液电导率 及
及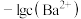 随滴入
随滴入 标准溶液的体积
标准溶液的体积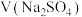 的变化关系如图2所示。
的变化关系如图2所示。

回答下列问题:
(1)固体BaS在潮湿空气中长期放置,会逸出臭鸡蛋气味的气体,且水溶性变差(其原因是表面生成了难溶于水的白色固体)。写出该过程的化学方程式______ 。
(2)装置I为气体发生装置,该装置所选用的试剂为______ 。
(3)上述实验装置中存在安全隐患,改进措施是______ ;III中反应的离子方程式为______ 。
(4)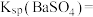
______  ,若不考虑溶液混合引起的体积变化,则
,若不考虑溶液混合引起的体积变化,则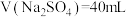 时溶液中
时溶液中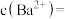
______ 。
(5)产品中 的质量分数为
的质量分数为______ 。
 ,并用重量法测定产品中
,并用重量法测定产品中 的含量。设计了如下实验方案:
的含量。设计了如下实验方案:可选用试剂:NaCl晶体、BaS溶液、
 溶液、
溶液、 溶液、浓硫酸、蒸馏水
溶液、浓硫酸、蒸馏水步骤1.
 的制备
的制备按图1所示装置进行实验,得到
 溶液,经蒸发浓缩、冷却结晶、过滤等步骤获得
溶液,经蒸发浓缩、冷却结晶、过滤等步骤获得 产品。
产品。步骤2.产品中
 的含量测定
的含量测定①称取产品0.5000g,用水溶解,配成25mL溶液;
②用
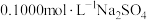 标准溶液滴定①所得溶液,测得溶液电导率
标准溶液滴定①所得溶液,测得溶液电导率 及
及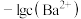 随滴入
随滴入 标准溶液的体积
标准溶液的体积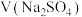 的变化关系如图2所示。
的变化关系如图2所示。
回答下列问题:
(1)固体BaS在潮湿空气中长期放置,会逸出臭鸡蛋气味的气体,且水溶性变差(其原因是表面生成了难溶于水的白色固体)。写出该过程的化学方程式
(2)装置I为气体发生装置,该装置所选用的试剂为
(3)上述实验装置中存在安全隐患,改进措施是
(4)
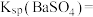
 ,若不考虑溶液混合引起的体积变化,则
,若不考虑溶液混合引起的体积变化,则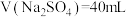 时溶液中
时溶液中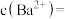
(5)产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
5 . 某纯碱样品只含NaCl杂质,为测定样品中 的含量进行如下实验。某兴趣小组同学称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。
的含量进行如下实验。某兴趣小组同学称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)仪器a的名称:_______ 。
(2)装置①中NaOH溶液的作用是_______ 。
(3)装置②中反应的离子方程为_______ ,装置③中反应的离子方程式为_______ 。
(4)下列说法正确的是_______。
(5)样品中 的质量分数为
的质量分数为_______ (保留3位有效数字)。
 的含量进行如下实验。某兴趣小组同学称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。
的含量进行如下实验。某兴趣小组同学称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。
(1)仪器a的名称:
(2)装置①中NaOH溶液的作用是
(3)装置②中反应的离子方程为
(4)下列说法正确的是_______。
| A.装置②、③间应增加除去HCl杂质的装置 |
| B.装置④的作用是吸收尾气,防止空气污染 |
C.若撤掉装置④会导致 的质量分数偏高 的质量分数偏高 |
| D.停止滴加盐酸后,还需继续通入空气一段时间 |
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
6 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石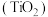 ,其是冶炼钛的重要原料。生产钛的工艺流程如图:
,其是冶炼钛的重要原料。生产钛的工艺流程如图:
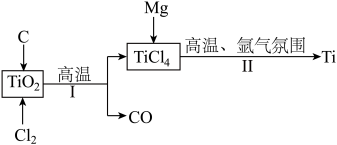
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关 的说法正确的是
的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ 。
③每转移 电子,同时生成
电子,同时生成 的体积为
的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含 )中的钛元素含量。常温下,取
)中的钛元素含量。常温下,取 反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共用去
的稀硫酸,当不再出现气泡时,共用去 稀硫酸:
稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
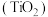 ,其是冶炼钛的重要原料。生产钛的工艺流程如图:
,其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关
 的说法正确的是
的说法正确的是A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移
 电子,同时生成
电子,同时生成 的体积为
的体积为(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含
 )中的钛元素含量。常温下,取
)中的钛元素含量。常温下,取 反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共用去
的稀硫酸,当不再出现气泡时,共用去 稀硫酸:
稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-02-03更新
|
128次组卷
|
2卷引用:湖北省十堰市2022-2023学年高一上学期期末调研考试题化学试卷
名校
解题方法
7 . 利用课堂上学到的知识来解决生活中的问题是我们学习的重要目的。
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸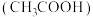 含量为
含量为 ,则食醋中醋酸含量为
,则食醋中醋酸含量为_______ 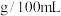 ,已知国家标准中酿造醋的醋酸含量必须大于
,已知国家标准中酿造醋的醋酸含量必须大于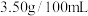 ,配制醋为
,配制醋为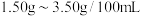 ,则甲同学购买食醋属于
,则甲同学购买食醋属于_______ 醋(填“酿造”或“配制)。
②乙同学将鸡蛋壳(主要成分为 )泡进食醋中,发现蛋壳慢慢溶解,有气泡产生,请写出该反应的离子方程式
)泡进食醋中,发现蛋壳慢慢溶解,有气泡产生,请写出该反应的离子方程式_______ 。
(2)下图是化学实验室浓硫酸试剂标签上的部分内容。
丙同学计划用该浓硫酸配制 的稀硫酸,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
的稀硫酸,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
①配制稀硫酸时,还缺少的玻璃仪器有_______ 。
②经计算,配制 的稀硫酸需要量取上述浓硫酸的体积为
的稀硫酸需要量取上述浓硫酸的体积为_______ mL(结果保留1位小数)。
③下列操作使所配溶液的浓度偏低的有_______ 。
A.用量筒量取溶液时仰视凹液面读数
B.颠倒摇匀后,发现液面低于刻度线,不作任何处置
C.取用的浓硫酸已敞口放置一段时间
D.转移溶液时,未洗涤烧杯和玻璃棒
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸
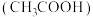 含量为
含量为 ,则食醋中醋酸含量为
,则食醋中醋酸含量为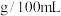 ,已知国家标准中酿造醋的醋酸含量必须大于
,已知国家标准中酿造醋的醋酸含量必须大于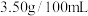 ,配制醋为
,配制醋为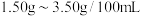 ,则甲同学购买食醋属于
,则甲同学购买食醋属于②乙同学将鸡蛋壳(主要成分为
 )泡进食醋中,发现蛋壳慢慢溶解,有气泡产生,请写出该反应的离子方程式
)泡进食醋中,发现蛋壳慢慢溶解,有气泡产生,请写出该反应的离子方程式(2)下图是化学实验室浓硫酸试剂标签上的部分内容。
| 硫酸 化学纯  品名:硫酸 化学式:  相对分子质量:98 密度:  质量分数:98% |
 的稀硫酸,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
的稀硫酸,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:①配制稀硫酸时,还缺少的玻璃仪器有
②经计算,配制
 的稀硫酸需要量取上述浓硫酸的体积为
的稀硫酸需要量取上述浓硫酸的体积为③下列操作使所配溶液的浓度偏低的有
A.用量筒量取溶液时仰视凹液面读数
B.颠倒摇匀后,发现液面低于刻度线,不作任何处置
C.取用的浓硫酸已敞口放置一段时间
D.转移溶液时,未洗涤烧杯和玻璃棒
您最近一年使用:0次
名校
解题方法
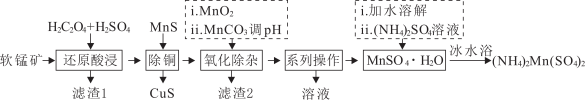
8 . 硫酸锰铵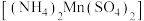 是一种浅粉色固体,可溶于水,工业上可用于加工木材防火剂。用软锰矿(主要含
是一种浅粉色固体,可溶于水,工业上可用于加工木材防火剂。用软锰矿(主要含 ,还含有
,还含有 、
、 、
、 、
、 、
、 等)制备硫酸锰铵的工艺流程如下:
等)制备硫酸锰铵的工艺流程如下:
已知:①该流程中金属离子以氢氧化物形式沉淀时溶液的pH如下:
②MgSO4和MnSO4的溶解度如下:
③常温下: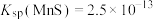 ,
, 。
。
回答下列问题:
(1)“还原酸浸”主要反应的离子方程式为______ 。
(2)滤渣1的主要成分为______ 。
(3)“除铜”反应的平衡常数
______ (结果保留2位有效数字)。
(4)“氧化除杂”加 的作用是
的作用是______ ,加 调节溶液的
调节溶液的 的范围为
的范围为______ 。
(5)“系列操作”包括______ 、______ 洗涤。
(6)通过实验测定产品硫酸锰铵中锰元素的含量:准确称取所得产品 溶于水配成溶液,滴加氨水调
溶于水配成溶液,滴加氨水调 至
至 ,加入过量的
,加入过量的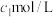
 溶液
溶液 ,充分反应后过滤掉
,充分反应后过滤掉 ,将滤液与洗涤液合并配制成
,将滤液与洗涤液合并配制成 溶液,取
溶液,取 用
用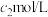
 酸性标准液滴定,重复实验3次,平均消耗标准液
酸性标准液滴定,重复实验3次,平均消耗标准液 。滴定终点的判断依据是
。滴定终点的判断依据是______ ,产品硫酸锰铵中锰元素的质量分数为______ (用相应字母表示)。
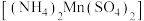 是一种浅粉色固体,可溶于水,工业上可用于加工木材防火剂。用软锰矿(主要含
是一种浅粉色固体,可溶于水,工业上可用于加工木材防火剂。用软锰矿(主要含 ,还含有
,还含有 、
、 、
、 、
、 、
、 等)制备硫酸锰铵的工艺流程如下:
等)制备硫酸锰铵的工艺流程如下:
已知:①该流程中金属离子以氢氧化物形式沉淀时溶液的pH如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Mg2+ |
| 开始沉淀时pH | 8.0 | 6.3 | 1.5 | 8.1 |
| 沉淀完全时pH | 10.0 | 8.3 | 2.8 | 9.4 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
| 溶解度/g | MgSO4 | 22 | 28.2 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 |
| MnSO4 | 52.9 | 59.7 | 62.9 | 62.9 | 60 | 53.6 | 45.6 | 40.9 | 35.3 | |
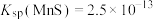 ,
, 。
。回答下列问题:
(1)“还原酸浸”主要反应的离子方程式为
(2)滤渣1的主要成分为
(3)“除铜”反应的平衡常数

(4)“氧化除杂”加
 的作用是
的作用是 调节溶液的
调节溶液的 的范围为
的范围为(5)“系列操作”包括
(6)通过实验测定产品硫酸锰铵中锰元素的含量:准确称取所得产品
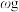 溶于水配成溶液,滴加氨水调
溶于水配成溶液,滴加氨水调 至
至 ,加入过量的
,加入过量的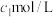
 溶液
溶液 ,充分反应后过滤掉
,充分反应后过滤掉 ,将滤液与洗涤液合并配制成
,将滤液与洗涤液合并配制成 溶液,取
溶液,取 用
用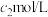
 酸性标准液滴定,重复实验3次,平均消耗标准液
酸性标准液滴定,重复实验3次,平均消耗标准液 。滴定终点的判断依据是
。滴定终点的判断依据是
您最近一年使用:0次
2022-12-16更新
|
435次组卷
|
3卷引用:全国部分重点中学T8联考(湖北)2023届高三上学期第一次学业质量评价化学试题
解题方法
9 . 某工厂采用如下步骤从海水中提取镁:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降,过滤,洗涤;
③将沉淀物与盐酸反应,蒸发结晶,过滤,得到含结晶水的晶体;
④将所得晶体在一定条件下加热得到无水氯化镁;
⑤电解熔融氯化镁,得到金属镁。
回答下列问题:
(1)Ca(OH)2所含元素中,质量分数最高的元素为_____ (填元素符号),该元素在地壳中的含量居于第_____ 位。
(2)写出沉淀物中的Mg(OH)2与盐酸反应的离子方程式:_____ ,该反应的基本反应类型为_____ 。
(3)氯化镁溶液在空气中直接加热得到的最终产物为MgO,发生反应的化学方程式为①MgCl2+2H2O Mg(OH)2↓+2HCl;②Mg(OH)2
Mg(OH)2↓+2HCl;②Mg(OH)2 MgO+H2O。反应①利用了盐酸的
MgO+H2O。反应①利用了盐酸的____ (填“酸性”、“还原性”、“氧化性”或“挥发性”),在反应②中,每生成0.4gMgO,此时消耗MgCl2的物质的量为____ mol。
(4)已知海水中镁的含量为1.28g•L-1,每生产1.00t镁,至少需要引入____ L海水(不考虑生产过程中质量的损失)。
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降,过滤,洗涤;
③将沉淀物与盐酸反应,蒸发结晶,过滤,得到含结晶水的晶体;
④将所得晶体在一定条件下加热得到无水氯化镁;
⑤电解熔融氯化镁,得到金属镁。
回答下列问题:
(1)Ca(OH)2所含元素中,质量分数最高的元素为
(2)写出沉淀物中的Mg(OH)2与盐酸反应的离子方程式:
(3)氯化镁溶液在空气中直接加热得到的最终产物为MgO,发生反应的化学方程式为①MgCl2+2H2O
 Mg(OH)2↓+2HCl;②Mg(OH)2
Mg(OH)2↓+2HCl;②Mg(OH)2 MgO+H2O。反应①利用了盐酸的
MgO+H2O。反应①利用了盐酸的(4)已知海水中镁的含量为1.28g•L-1,每生产1.00t镁,至少需要引入
您最近一年使用:0次
2022-12-08更新
|
63次组卷
|
2卷引用:江西省2022-2023学年高一上学期选科调考化学试题
名校
解题方法
10 . I、现有一定量含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水)。回答下列问题:
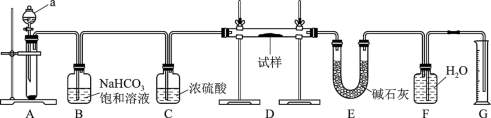
(1)装置a的名称为_________ 。
(2)装置A中反应的离子方程式为_________ 。
(3)写出装置D中反应生成O2的化学方程式,并用双线桥法表示其电子的转移_________ 。
(4)装置E中碱石灰的主要作用是_________ 。
(5)已知装置D中试样质量为19.5g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数_________ 。
Ⅱ、纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠,再加热碳酸氢钠即可制得纯碱。查阅资料知:NH3极易溶于水,水溶液呈碱性。部分工艺流程如图所示:
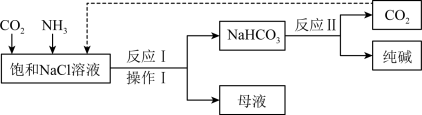
(6)纯碱属于_________ (填“酸”“碱”或“盐”)。
(7)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为_________ (选填字母)。
A.CO2再通NH3 B.先通NH3再通CO2
图中导管b通入_________ ,导管a不能插入液面以下的原因是_________ 。装置c中的试剂为_________ (选填字母)。
A.碱石灰 B.浓硫酸 C.五氧化二磷
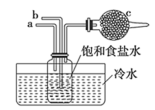

(1)装置a的名称为
(2)装置A中反应的离子方程式为
(3)写出装置D中反应生成O2的化学方程式,并用双线桥法表示其电子的转移
(4)装置E中碱石灰的主要作用是
(5)已知装置D中试样质量为19.5g,装置G中所得O2体积为1120mL(已折算成标准状况下体积,且O2全部逸出)。求试样中Na2O2的质量分数
Ⅱ、纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠,再加热碳酸氢钠即可制得纯碱。查阅资料知:NH3极易溶于水,水溶液呈碱性。部分工艺流程如图所示:

(6)纯碱属于
(7)为提高NaHCO3的产量,CO2和NH3通入饱和NaCl溶液的先后顺序为
A.CO2再通NH3 B.先通NH3再通CO2
图中导管b通入
A.碱石灰 B.浓硫酸 C.五氧化二磷

您最近一年使用:0次



