名校
解题方法
1 . 某处工厂排出的烟道气中含氮氧化物(主要为NO、 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式______________ ;若反应后尾气无残留,则参加反应的 、NO物质的量比值为
、NO物质的量比值为_____ (填字母)。
a.≥1 b.≤1 c.任意值
(2)可使用适量酸性 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为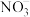 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成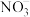 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是_______________ 。
(4)有氧条件下,NO在催化剂作用下可被 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是___________ 。
(5)羟基自由基( )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程:______________ 。 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加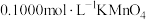 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗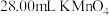 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数__________ 。(写出计算过程)
 )、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图:
)、粉尘和少量水蒸气.课外兴趣活动小组对该工厂排出的烟道气进行处理,并检测其氮氧化物含量,实验装置如图: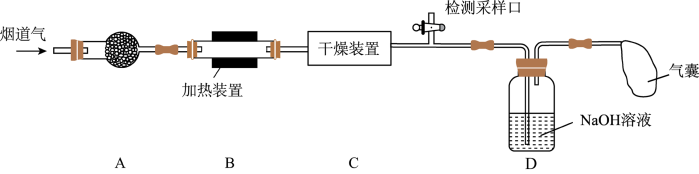
 混合气体按一定比例被
混合气体按一定比例被 溶液完全吸收生成
溶液完全吸收生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式 、NO物质的量比值为
、NO物质的量比值为a.≥1 b.≤1 c.任意值
(2)可使用适量酸性
 溶液,将溶液中的
溶液,将溶液中的 全部氧化为
全部氧化为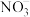 ,发生反应的离子方程式是
,发生反应的离子方程式是(3)气囊用来储存处理后气体,其中可能含少量NO气体,可用酸性
 溶液来处理。
溶液来处理。 氧化NO生成
氧化NO生成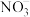 和
和 ,发生反应的离子方程式是
,发生反应的离子方程式是(4)有氧条件下,NO在催化剂作用下可被
 还原为
还原为 。在钒基催化剂
。在钒基催化剂 作用下的脱硝反应机理如图所示:
作用下的脱硝反应机理如图所示: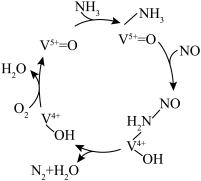
 在有氧条件下的总化学方程式是
在有氧条件下的总化学方程式是(5)羟基自由基(
 )也可以用于脱硫脱硝。如图表示光催化氧化技术可生成
)也可以用于脱硫脱硝。如图表示光催化氧化技术可生成 ﹔光照时,价带失去电子产生有强氧化性的空穴,价带上
﹔光照时,价带失去电子产生有强氧化性的空穴,价带上 直接转化为
直接转化为 ;描述产生
;描述产生 的另一种过程:
的另一种过程: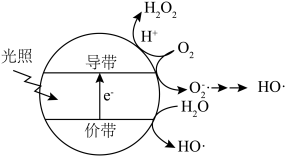
 等杂质,可以采用
等杂质,可以采用 测定含量。称取
测定含量。称取 该亚硝酸钠产品溶于水配制成
该亚硝酸钠产品溶于水配制成 的样品溶液。取
的样品溶液。取 该样品溶液于锥形瓶中,用稀
该样品溶液于锥形瓶中,用稀 酸化后,再向锥形瓶中滴加
酸化后,再向锥形瓶中滴加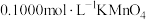 溶液,至恰好完全反应时,消耗
溶液,至恰好完全反应时,消耗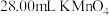 溶液。计算该产品中
溶液。计算该产品中 的质量分数
的质量分数
您最近一年使用:0次
2024-05-03更新
|
241次组卷
|
3卷引用:03 2024年苏州昆山中学高一3月月考
名校
2 . 利用课堂上学到的知识来解决生活中的问题是我们学习的重要目的。
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸( )含量为
)含量为 ,则食醋中醋酸含量为
,则食醋中醋酸含量为______ 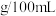 ,属于
,属于______ 醋(填“酿造”或“配制”,已知:酿造醋的国家标准为醋酸含量必须大于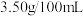 ,而配制醋仅为
,而配制醋仅为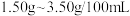 )。
)。
②乙同学将鸡蛋壳(主要成分为 )泡进食醋中,发现有气泡产生,请写出该反应的离子方程式
)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式____________ ;在标准状况下生成的气体密度为______ 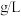 (结果保留1位小数)。
(结果保留1位小数)。
(2)下图是化学实验室浓盐酸试剂标签上的部分内容。
丁同学计划用该浓盐酸配制 的稀盐酸,现实验仅需要稀盐酸450mL,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
的稀盐酸,现实验仅需要稀盐酸450mL,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
①配制稀盐酸时,还缺少的仪器有______ 。
②经计算,配制 的稀盐酸需要量取上述浓盐酸的体积为
的稀盐酸需要量取上述浓盐酸的体积为______ mL(结果保留1位小数)。
③测定所配制的稀盐酸,发现其浓度大于 ,引起误差的原因可能是
,引起误差的原因可能是____________ 。
A. 将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B. 定容时俯视容量瓶刻度线
C. 转移溶液后,未洗涤烧杯和玻璃棒
D. 定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(1)某化学实验兴趣小组自行购置了鸡蛋、食醋等生活用品,进行了如下探究。
①甲同学测出从超市购买的食醋中醋酸(
 )含量为
)含量为 ,则食醋中醋酸含量为
,则食醋中醋酸含量为 ,属于
,属于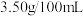 ,而配制醋仅为
,而配制醋仅为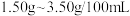 )。
)。②乙同学将鸡蛋壳(主要成分为
 )泡进食醋中,发现有气泡产生,请写出该反应的离子方程式
)泡进食醋中,发现有气泡产生,请写出该反应的离子方程式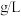 (结果保留1位小数)。
(结果保留1位小数)。(2)下图是化学实验室浓盐酸试剂标签上的部分内容。
盐酸 化学纯(CP) (500mL) 品名:盐酸 化学式:HCl 相对分子质量:36.5 密度: 质量分数:36.5% |
 的稀盐酸,现实验仅需要稀盐酸450mL,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:
的稀盐酸,现实验仅需要稀盐酸450mL,可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒。请回答下列问题:①配制稀盐酸时,还缺少的仪器有
②经计算,配制
 的稀盐酸需要量取上述浓盐酸的体积为
的稀盐酸需要量取上述浓盐酸的体积为③测定所配制的稀盐酸,发现其浓度大于
 ,引起误差的原因可能是
,引起误差的原因可能是A. 将量取的浓盐酸倒入烧杯后,洗涤量筒,洗涤液也注入烧杯
B. 定容时俯视容量瓶刻度线
C. 转移溶液后,未洗涤烧杯和玻璃棒
D. 定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
您最近一年使用:0次
3 . 重铬酸钾(K2Cr2O7)是一种重要的化工原料,可用于制铬矾、火柴、铬颜料,并供鞣革、电镀、有机合成等。工业上以铬铁矿[主要成分为Fe(CrO2)2,质量分数为67.2%,杂质主要为硅、铁、铝的氧化物]为原料制备重铬酸钾的工艺流程如图所示:
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:______ 。
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:_______ 。
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是_______ (填化学式)。
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:______ 。
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是_______ ,生产过程的产率为______ 。
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为_______ 。(滴定过程中发生的反应为Cr2O +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
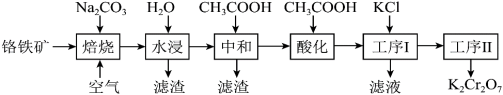
①焙烧时Fe(CrO2)2中的Fe元素转化为NaFeO2,Cr元素转化为Na2CrO4;铝的氧化物转化为NaAlO2。
②Fe(CrO2)2的摩尔质量为224g/mol,K2Cr2O7的摩尔质量为294g/mol。
③矿物中相关元素可溶性组分物质的量浓度c(mol•L-1)的对数值与pH的关系如图所示。
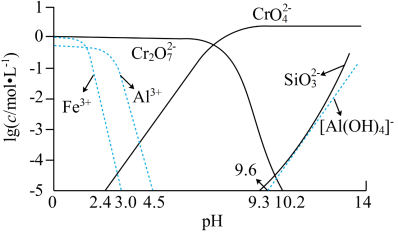
请回答下列问题:
(1)写出“焙烧”过程中发生的主要反应的化学方程式:
(2)“水浸”所得滤渣1的主要成分是Fe(OH)3,写出生成此滤渣的离子方程式:
(3)在“中和”步骤中加冰醋酸调节pH约等于7,中和后滤渣2的主要成分是
(4)“酸化”时加冰醋酸调节pH约等于5,写出酸化过程中发生反应的离子方程式:
(5)工序I经过滤、洗涤后获得粗产品,经工序Ⅱ得到661.5kg产品,则工序Ⅱ的操作方法是
(6)测定产品中K2Cr2O7含量:称取样品2.50g配成250mL溶液,取25.00mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000mol•L-1(NH4)2Fe(SO4)2标准液进行滴定。三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL。则样品中K2Cr2O7的纯度为
 +Fe2++H+→Cr3++Fe3++H2O)
+Fe2++H+→Cr3++Fe3++H2O)
您最近一年使用:0次
2024-06-03更新
|
124次组卷
|
2卷引用:2024届陕西省渭南市临渭区高三下学期三模理综试题-高中化学
名校
解题方法
4 . 配合物乙二胺四乙酸铁钠(NaFeY)可溶于水,具有促进膳食中其他铁源或内源性铁源吸收的作用,同时还可促进锌的吸收,是常见的铁营养强化剂。模拟工业生产原理制取乙二胺四乙酸铁钠并测定所制取样品的纯度。
I.产品的制备:
步骤1:准确称取mgFeCl3·6H2O于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。步骤2:将Fe(OH)3、乙二胺四乙酸(H4Y),水加入三颈烧瓶中,搅拌,80℃水浴反应1h,加入Na2CO3溶液,发生反应:2Fe(OH)3+Na2CO3+2H4Y=2NaFeY·3H2O+CO2↑+H2O。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
(1)利用FeCl3和氨水的反应制备Fe(OH)3,写出反应的离子方程式___________ 。检验Fe(OH)3洗涤干净的方法是___________ 。
(2)实验中需要控温在80℃反应1小时,最佳的加热方式是___________ 。
(3)方案的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。为使沉淀颗粒增大,实验中往往可以采取___________ (填实验条件)。
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取20.00g样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成250mL溶液,取出25mL加入过量的30.00mL0.1600mol/LEDTA标准溶液并加热煮沸,充分反应后,再用0.2000mol/L的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为5.00mL。
已知:Fe3+、Zn2+与EDTA反应的化学计量比均为1:1。
(4)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
(5)计算铁元素的质量分数___________ 。
Ⅲ.某同学为探究富含亚铁盐且保存时间较长的糕点情况,设计了如下实验方案:___________ 。
(7)加入新制氯水后,溶液红色加深的原因是___________ (用离子方程式表示)。
(8)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:___________ 。
②【设计方案】
为了对假设2进行验证,简述你的设计方案:___________ 。
I.产品的制备:
步骤1:准确称取mgFeCl3·6H2O于烧杯中,加水充分溶解,分批加入适量浓氨水,搅拌、过滤、洗涤、干燥。步骤2:将Fe(OH)3、乙二胺四乙酸(H4Y),水加入三颈烧瓶中,搅拌,80℃水浴反应1h,加入Na2CO3溶液,发生反应:2Fe(OH)3+Na2CO3+2H4Y=2NaFeY·3H2O+CO2↑+H2O。经过蒸发浓缩、冷却结晶,过滤、洗涤,晾干后得产品。
(1)利用FeCl3和氨水的反应制备Fe(OH)3,写出反应的离子方程式
(2)实验中需要控温在80℃反应1小时,最佳的加热方式是
(3)方案的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。为使沉淀颗粒增大,实验中往往可以采取
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取20.00g样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成250mL溶液,取出25mL加入过量的30.00mL0.1600mol/LEDTA标准溶液并加热煮沸,充分反应后,再用0.2000mol/L的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为5.00mL。
已知:Fe3+、Zn2+与EDTA反应的化学计量比均为1:1。
(4)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
A. | B. | C. | D. |
Ⅲ.某同学为探究富含亚铁盐且保存时间较长的糕点情况,设计了如下实验方案:

(7)加入新制氯水后,溶液红色加深的原因是
(8)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态。
假设2:
②【设计方案】
为了对假设2进行验证,简述你的设计方案:
您最近一年使用:0次
5 . 三氯化六氨合钴(Ⅲ) 是制备其它三价钴配合物的重要试剂。实验室制备
是制备其它三价钴配合物的重要试剂。实验室制备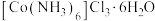 的装置如图所示,具体步骤如下:
的装置如图所示,具体步骤如下: 和
和 溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
II.向三颈烧瓶中滴加过量氨水,充分反应后,搅拌下逐滴加入 溶液,水浴加热至50~60℃充分反应,生成的
溶液,水浴加热至50~60℃充分反应,生成的 吸附在活性炭上。
吸附在活性炭上。
III.经过“一系列”操作,得到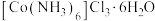 晶体。
晶体。
已知:① 不易被氧化,
不易被氧化, 具有强氧化性;
具有强氧化性; 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。
②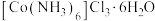 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于
在水中的溶解度随温度的升高而增大,加入浓盐酸有利于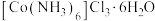 晶体析出。
晶体析出。
回答下列问题:
(1)步骤I中“溶解”需要的主要玻璃仪器为___________ , 有利于步骤II中
有利于步骤II中 与
与 的配位反应,其原理是
的配位反应,其原理是___________ 。
(2)步骤II中加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ ,向三颈烧瓶中先滴加氨水后滴加 溶液的原因是
溶液的原因是___________ 。
(3)稀盐酸可将吸附在活性炭上的 溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入
溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入___________ 溶解,趁热过滤,冷却后向滤液中加入少量___________ ,边加边搅拌,充分静置后过滤,用___________ 洗涤2~3次,低温干燥。(可选用试剂:稀盐酸、浓盐酸、无水乙醇)
(4)测定产品中钴的含量,进行如下实验:
称取3.5400g产品,加入足量 溶液蒸出
溶液蒸出 ,再加入稀硫酸,将
,再加入稀硫酸,将 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的 溶液,用
溶液,用
 标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为
标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为___________ ,产品中钴元素的质量分数为___________ 。(已知: 、
、 )
)
 是制备其它三价钴配合物的重要试剂。实验室制备
是制备其它三价钴配合物的重要试剂。实验室制备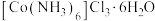 的装置如图所示,具体步骤如下:
的装置如图所示,具体步骤如下: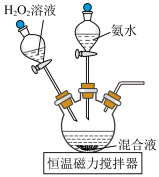
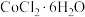 和
和 溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。II.向三颈烧瓶中滴加过量氨水,充分反应后,搅拌下逐滴加入
 溶液,水浴加热至50~60℃充分反应,生成的
溶液,水浴加热至50~60℃充分反应,生成的 吸附在活性炭上。
吸附在活性炭上。III.经过“一系列”操作,得到
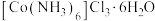 晶体。
晶体。已知:①
 不易被氧化,
不易被氧化, 具有强氧化性;
具有强氧化性; 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。②
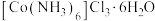 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于
在水中的溶解度随温度的升高而增大,加入浓盐酸有利于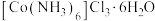 晶体析出。
晶体析出。回答下列问题:
(1)步骤I中“溶解”需要的主要玻璃仪器为
 有利于步骤II中
有利于步骤II中 与
与 的配位反应,其原理是
的配位反应,其原理是(2)步骤II中加入
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为 溶液的原因是
溶液的原因是(3)稀盐酸可将吸附在活性炭上的
 溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入
溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入(4)测定产品中钴的含量,进行如下实验:
称取3.5400g产品,加入足量
 溶液蒸出
溶液蒸出 ,再加入稀硫酸,将
,再加入稀硫酸,将 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的 溶液,用
溶液,用
 标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为
标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为 、
、 )
)
您最近一年使用:0次
名校
解题方法
6 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。
【实验i】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 的
的 溶液
溶液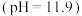 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)试剂a是_______ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是_______ 。
(3) 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为_______ 。
(4)同学甲在 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由_______ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质_______ 。
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为_______ 。
【实验ⅳ】探究的应用
(7)将 溶于乳酸
溶于乳酸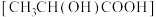 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是_______ 。
 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。【实验i】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)
 的
的 溶液
溶液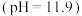 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)试剂a是
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)
 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在
 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为
【实验ⅳ】探究的应用
(7)将
 溶于乳酸
溶于乳酸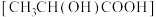 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是
您最近一年使用:0次
名校
解题方法
7 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
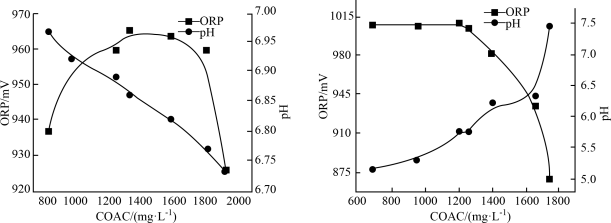
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
名校
8 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。
的制取、性质及其应用。按要求回答下列问题。
已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)
(无色)
【实验ⅰ】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 溶液(
溶液( )中通入
)中通入 一段时间,至C中溶液的pH为7时向其中滴加一定量
一段时间,至C中溶液的pH为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)盛装稀盐酸的仪器名称为________ ,试剂a为________ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是________ 。
(3)pH为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为________ 。
(4)同学甲在C中出现白色沉淀之后继续通 ,阐述你认为同学甲的操作合理与否及理由
,阐述你认为同学甲的操作合理与否及理由________ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质 ,请写出步骤②反应的离子方程式:
,请写出步骤②反应的离子方程式:_________ 。
(6)对比实验ⅱ和实验ⅲ,得出实验结论(填1点即可):_________ 。
【实验ⅳ】探究 的应用
的应用
(7)将 溶于乳酸
溶于乳酸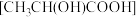 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是________ 。
 的制取、性质及其应用。按要求回答下列问题。
的制取、性质及其应用。按要求回答下列问题。已知:①
 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)
(无色)【实验ⅰ】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)实验i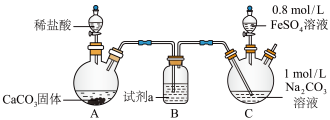
 溶液(
溶液( )中通入
)中通入 一段时间,至C中溶液的pH为7时向其中滴加一定量
一段时间,至C中溶液的pH为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)盛装稀盐酸的仪器名称为
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)pH为7时滴加一定量
 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在C中出现白色沉淀之后继续通
 ,阐述你认为同学甲的操作合理与否及理由
,阐述你认为同学甲的操作合理与否及理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质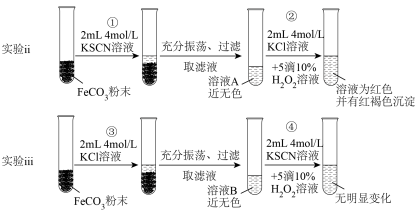
 ,请写出步骤②反应的离子方程式:
,请写出步骤②反应的离子方程式:(6)对比实验ⅱ和实验ⅲ,得出实验结论(填1点即可):
【实验ⅳ】探究
 的应用
的应用(7)将
 溶于乳酸
溶于乳酸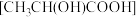 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数。发现乳酸亚铁的质量分数总是大于100%(操作误差略),其原因是
您最近一年使用:0次
9 . 某含铬矿石的回收生产中得到BaCrO4的样品,为了测定其中BaCrO4的含量,进行以下实验: =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应
1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为_____ (用字母表示)。
2.若加入的HI溶液过量太多,测定结果会_____。
3.用还原法可以将硝酸厂烟气中的大量氮氧化物(NOx),转化为无害物质。常温下,将NO与H2的混合气体通入Ce(SO4) 2与Ce2 (SO4)3的混合溶液中,其转化过程如图所示。下列说法错误的是_____。
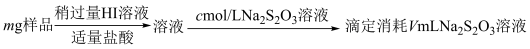
 =2I−+S4O
=2I−+S4O ;②CrO
;②CrO 的还原产物为Cr3+;③杂质不参与相关反应
的还原产物为Cr3+;③杂质不参与相关反应1.样品中BaCrO4(摩尔质量为Mg·mol−l)的质量分数为
2.若加入的HI溶液过量太多,测定结果会_____。
| A.偏高 | B.偏低 | C.无影响 | D.无法确定 |
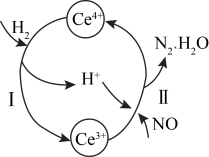
| A.反应I的离子反应方程式为:2Ce4++H2=2Ce3++2H+ |
| B.反应II中氧化剂与还原剂的物质的量之比为1:2 |
| C.反应前溶液中c(Ce4+)一定等于反应后溶液中的c(Ce4+) |
| D.反应过程中混合溶液内Ce3+和Ce4+的总数一定保持不变 |
您最近一年使用:0次
解题方法
10 . 硒是人体不可缺少的微量元素,硒的应用范围非常广泛。以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、 、CuO、ZnO、
、CuO、ZnO、 等)提取硒一种工艺流程如下:
等)提取硒一种工艺流程如下:
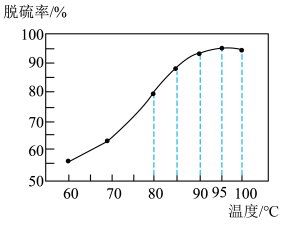
(1)“脱硫”时,脱硫率随温度的变化如图所示,试分析随温度的升高,脱硫率呈上升趋势的原因;_______ ,最佳脱硫温度为_______ 。 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)“控电位还原”,是将电位高的物质先还原,电位低的物质保留在溶液中,以达到物质的分离。可采用硫脲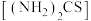 联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。
联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。
控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原 ,该过程的还原反应(半反应)式为
,该过程的还原反应(半反应)式为_______ ,为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_______ V以上。
(4)“精制”过程中 先将Se浸出转化成硒代硫酸钠(
先将Se浸出转化成硒代硫酸钠(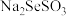 ),
),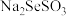 再被
再被 酸化生成硒的离子方程式为
酸化生成硒的离子方程式为_______ 。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg⋅g ,则精硒中铁的质量分数为
,则精硒中铁的质量分数为_______ %。
 、CuO、ZnO、
、CuO、ZnO、 等)提取硒一种工艺流程如下:
等)提取硒一种工艺流程如下: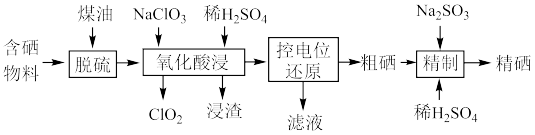
(1)“脱硫”时,脱硫率随温度的变化如图所示,试分析随温度的升高,脱硫率呈上升趋势的原因;
 ,该反应的化学方程式为
,该反应的化学方程式为(3)“控电位还原”,是将电位高的物质先还原,电位低的物质保留在溶液中,以达到物质的分离。可采用硫脲
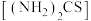 联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。
联合亚硫酸钠进行“控电位还原”,下表是“氧化酸浸”液中主要粒子的电位。名称 |
|
|
|
|
|
|
中位/V | 0.345 | -0.760 | -0.440 | 0.770 | 1.511 | 0.740 |
 ,该过程的还原反应(半反应)式为
,该过程的还原反应(半反应)式为(4)“精制”过程中
 先将Se浸出转化成硒代硫酸钠(
先将Se浸出转化成硒代硫酸钠(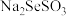 ),
),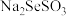 再被
再被 酸化生成硒的离子方程式为
酸化生成硒的离子方程式为(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg⋅g
 ,则精硒中铁的质量分数为
,则精硒中铁的质量分数为
您最近一年使用:0次


 /Cu
/Cu /Zn
/Zn /Fe
/Fe


