名校
1 . 酸性废水中的砷元素主要以亚砷酸(H3AsO3)形式存在。已知As2S3难溶于水,也不溶于稀硫酸、稀盐酸等无机酸。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为_______ 。
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=_______ 。[Ksp(As2S3)=4.0×10-38]。
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是_______ 。
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为________ (图中“HS·”为自由基,“·”表示孤单电子)。
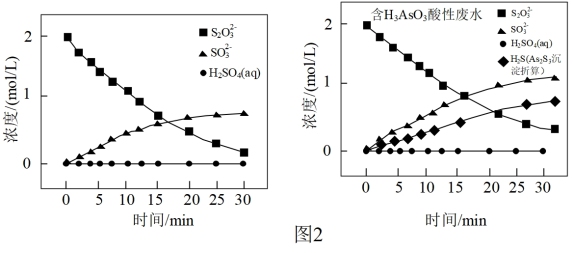
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是_______ 。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O
 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为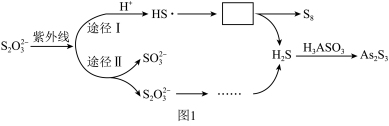
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是

您最近一年使用:0次
2021-03-27更新
|
1493次组卷
|
2卷引用:江苏省南京市盐城市2021届高三第二次模拟考试化学试题
解题方法
2 . 粘土帆矿(含V2O5、Fe2O3、Al2O3、SiO2等不溶性成分)制备V2O5的工艺流程如下:

已知: ①硫酸氧钒[(VO)SO4]高温易分解生成VO2和SO3
②萃取剂对相关离子的萃取能力如下表:
回答下列问题:
(1)粘土钒矿焙烧时一般选择 250℃的原因是______ ,V2O5与浓硫酸生成硫酸氧钒的化学方程式______ 。
(2)为提高浸出效率可采取的操作有______ (答两条),浸出液中存在 VO2+、VO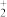 、 Fe3+、Al3+和
、 Fe3+、Al3+和 离子,萃取前加入铁粉的目的
离子,萃取前加入铁粉的目的______ 。
(3)“反萃取”用 20%硫酸目的为______ ,“氧化”的离子方程式为______ 。
(4)用反萃取法由碘的 CCl4溶液提取碘单质,画出流程图______ 。

已知: ①硫酸氧钒[(VO)SO4]高温易分解生成VO2和SO3
②萃取剂对相关离子的萃取能力如下表:
| 微粒 | VO2+ | VO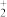 | Fe3+ | Fe2+ |
| 萃取能力 | 强(随pH增大而增强) | 弱 | 强 | 弱 |
(1)粘土钒矿焙烧时一般选择 250℃的原因是
(2)为提高浸出效率可采取的操作有
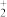 、 Fe3+、Al3+和
、 Fe3+、Al3+和 离子,萃取前加入铁粉的目的
离子,萃取前加入铁粉的目的(3)“反萃取”用 20%硫酸目的为
(4)用反萃取法由碘的 CCl4溶液提取碘单质,画出流程图

您最近一年使用:0次
2021-03-18更新
|
1674次组卷
|
3卷引用:山东省青岛市2021届高三3月统一质量检测化学试题
解题方法
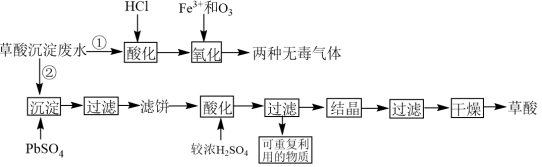
3 . 稀土工业生产中,草酸(H2C2O4)是稀土元素沉淀剂。工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸的混合溶液及微量的草酸稀土杂质等。此废水腐蚀性较强,直接排放会造成环境污染。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
25℃时,各物质的溶度积常数如下表:
回答下列问题:
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为_______ 。
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是_______ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于_______ (已知lg2=0.3,1g5=0.7)。
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+ (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=_______ 。
(4)滤饼“酸化”“过滤”后可重复利用的物质为_______ (填化学式)。
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法_______ (填“①”或“②”)更好,原因是_______ 。

25℃时,各物质的溶度积常数如下表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4)] | Ka2(H2C2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+
 (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(4)滤饼“酸化”“过滤”后可重复利用的物质为
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法
您最近一年使用:0次
名校
解题方法
4 . 取一定质量的NaBr、NaI的混合物平均分成五等分,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干灼烧得固体,通入氯气的体积与最终所得固体质量记录如下:
下列实验结论正确的是
| 编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 固体组成 | NaCl | ||||
| Cl2的体积/mL | V | 2V | 3V | 4V | 5V |
| 固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
| A.甲溶液中发生的反应是Cl2+2Br-=2Cl-+Br2 |
| B.乙中固体组成为NaBr、NaCl |
| C.标准状况下Cl2的体积V为2688mL |
| D.原混合物中NaBr的物质的量为1mol |
您最近一年使用:0次
2020-11-19更新
|
1662次组卷
|
5卷引用:解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)广东省深圳外国语学校2021届高三第二次月考化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
5 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )A.当a=b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2020-08-18更新
|
3396次组卷
|
7卷引用:解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)福建省泉州市永春第一中学2022-2023学年高一上学期期末考试化学试题
名校
6 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.45mol |
| D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2020-07-22更新
|
3003次组卷
|
11卷引用:山西省实验中学2020-2021学年高一下学期第一次月考化学试题
山西省实验中学2020-2021学年高一下学期第一次月考化学试题辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题辽宁省大连市2019-2020学年高一下学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高一9月月考化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期4月月考化学试题云南省曲靖市第一中学2022-2023学年高一下学期期末考试化学试题安徽省铜陵市第一中学2022-2023 学年高一下学期期中教学质量检测化学试题云南省开远市第一中学校2022-2023学年高一下学期期末考试化学试题重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
名校
解题方法
7 . 有关 反应的叙述正确的为
反应的叙述正确的为
 反应的叙述正确的为
反应的叙述正确的为| A.还原剂与氧化剂物质的量之比为5:3 |
| B.生成lmolO2,反应共转移4mol电子 |
C.若有5mol水做还原剂时,被BrF3还原的BrF3为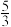 mol mol |
| D.若有5mol水参与反应时,被水还原的BrF3为2mol |
您最近一年使用:0次
2019-11-24更新
|
2662次组卷
|
7卷引用:辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题
名校
8 . 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
| A.生成44.8L N2(标准状况) |
| B.有0.25 mol KNO3被还原 |
| C.转移电子的物质的量为1.75mol |
| D.被氧化的N原子的物质的量为3.75mol |
您最近一年使用:0次
2019-07-05更新
|
9181次组卷
|
8卷引用:黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题
真题
名校
9 . 聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确 的是
| A.KClO3作氧化剂,每生成1 mol [Fe(OH)SO4]n消耗6/n mol KClO3 |
| B.生成聚合硫酸铁后,水溶液的pH增大 |
| C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水 |
| D.在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强 |
您最近一年使用:0次
2019-04-12更新
|
5915次组卷
|
36卷引用:解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练上海交通大学附属中学2021届高三下学期3月月考化学试题(已下线)课时17 铁及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)3.3.1 盐类的水解-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题05.元素及其化合物-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向26 盐类的水解-备战2022年高考化学一轮复习考点微专题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2019年4月浙江省普通高校招生选考科目考试化学试题福建省华安一中2018-2019学年高二下学期期末考试化学试题湖南省长沙市第一中学2020届高三第一次月考化学试题江西省宜春市奉新县第一中学2020届高三上学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2020届高三10月月考化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题江西省吉安市五校2019-2020学年高二上学期第二次联考化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)广东省佛山市第一中学2020-2021学年高二上学期期中考试化学(选考)试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题第三章 金属及其化合物 第13讲 铁及其重要化合物湖南省株洲市第四中学2023届高三第六次月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算重庆市万州第二高级中学2022-2023学年高三下学期5月月考化学试题新疆喀什地区伽师县2022-2023学年高三上学期11月期中考试化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)北京市第八十中学2024届高三上学期10月月考化学试题化学江苏省扬州市宝应区2023-2024学年曹甸高级中学高三上学期9月化学试卷
名校
解题方法
10 . 聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
| A.1∶1 | B.2∶1 | C.3∶1 | D.2∶5 |
您最近一年使用:0次
2018-12-15更新
|
1546次组卷
|
7卷引用:辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题
辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题苏教2020版化学必修第二册专题9第三单元 金属材料的性能及应用课后习题2016-2017学年江苏省徐州一中高一上期中化学卷(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)(已下线)2019年1月2日 《每日一题》高考二轮复习-以物质的量为核心的计算【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期第三次月考化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题



