名校
解题方法
1 . 将Cl2通入含a mol NaOH的溶液中,反应会放热,温度升高后发生反应: 3Cl2+6NaOH = 5NaCl+NaClO3+3H2O。当NaOH完全反应时,下列说法正确的是
| A.反应中作氧化剂的Cl2有0.25a mol |
B.若反应后溶液中 =2,则 =2,则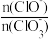 =5 =5 |
C.NaClO与NaClO3的物质的量之和可能为 a mol a mol |
D.反应中转移电子的物质的量可能为 a mol a mol |
您最近一年使用:0次
2023-05-16更新
|
931次组卷
|
3卷引用:山东省烟台市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
2 . 如图所示,实验室中利用洁净的铜片(0.3 mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到Cu2S和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。下列说法错误的是
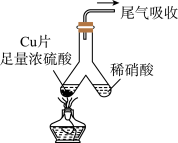

| A.白色固体为CuSO4 |
| B.NO为还原产物,b为氧化产物 |
| C.NO与b的物质的量之和可能为0.2 mol |
| D.参加反应的浓硫酸中,表现氧化性的占25% |
您最近一年使用:0次
2023-05-16更新
|
1198次组卷
|
3卷引用:山东省烟台市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
3 . 对于反应: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是| A.该反应中,有三种元素化合价发生改变 |
B.该反应的还原剂为 和 和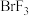 ,氧化产物为 ,氧化产物为 和 和 |
C.1.5mol 参加反应,被 参加反应,被 还原的 还原的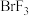 为0.4mol 为0.4mol |
D.1.5mol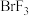 参加反应,有4mol 参加反应,有4mol 转移 转移 |
您最近一年使用:0次
2023-03-11更新
|
1214次组卷
|
4卷引用:浙江省强基联盟2022-2023学年高三上学期选考仿真密卷化学试题
浙江省强基联盟2022-2023学年高三上学期选考仿真密卷化学试题(已下线)化学-2023年高考押题预测卷01(浙江卷)(含考试版、全解全析、参考答案、答题卡)湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
4 . 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪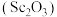 的一种流程如下:
的一种流程如下:
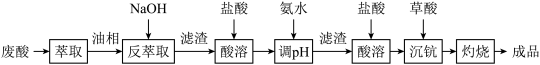
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________________ 。
(2)常温下,先加入氨水调节 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节 ,滤液中
,滤液中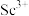 的浓度为
的浓度为__________ 。
{已知: 、
、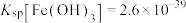 、
、 }
}
(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:___________________________ 。
(4)草酸钪“灼烧”氧化的化学方程式为________________________________________________ 。
(5)废酸中含钪量为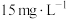 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为__________ 。
(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:
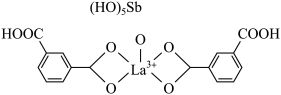
该结构中,中心离子 配位数为
配位数为__________ 。
(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:
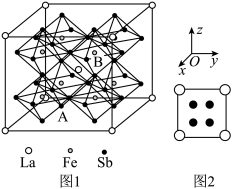
①若图中A点锑原子的坐标为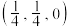 ,则B点铁原子的坐标为
,则B点铁原子的坐标为__________ 。
②若该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为__________ cm。
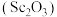 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)常温下,先加入氨水调节
 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是 ,滤液中
,滤液中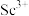 的浓度为
的浓度为{已知:
 、
、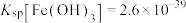 、
、 }
}(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:
(4)草酸钪“灼烧”氧化的化学方程式为
(5)废酸中含钪量为
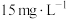 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:

该结构中,中心离子
 配位数为
配位数为(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:

①若图中A点锑原子的坐标为
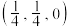 ,则B点铁原子的坐标为
,则B点铁原子的坐标为②若该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为
您最近一年使用:0次
2023-02-06更新
|
583次组卷
|
3卷引用:湖南师范大学附属中学2022-2023学年高三上学期月考卷(六)化学试题
名校
5 . Ⅰ.回答下列问题:
(1)(NH4)2SO4溶液可以用来除铁锈的原因:_______ (用离子方程式说明)。
(2)部分弱酸的电离平衡常数如表:
室温下①0.1mol·L-1HCOONa②0.1 mol·L-1 NaClO③0.1 mol·L-1Na2CO3④ 0.1 mol·L-1NaHCO3溶液的pH由大到小的关系为_______ 。
(3)根据上述电离平衡常数,试写出下列化学反应的离子方程式:
①向碳酸钠溶液中通入少量二氧化硫气体_______
②向碳酸钠溶液中滴入过量甲酸_______
Ⅱ.常温下,HNO2的电离平衡常数Ka =2.6×10-4,亚硝酸钠(NaNO2)是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(4)亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则反应的化学方程式为_______ 。
(5)某活动小组同学设计实验方案鉴别NaCl溶液和NaNO2溶液,请填写下列表格。
Ⅲ.活动小组同学采用如下装置制备NaNO2(装置可重复使用,部分夹持仪器已省略)。

已知:①2NO+Na2O2=2NaNO2,
②酸性条件下,NO、NO2都能与 反应生成
反应生成 和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
(6)实验装置的连接顺序为A→_______→_______→_______→_______→B;_
(7)C瓶内发生反应的离子方程式为_______ 。
(8)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
①第一组实验数据出现较明显异常,造成异常的原因可能是_______ (填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡
c.判断终点时,滴入一滴酸性KMnO4溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
d.观察滴定终点时俯视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为_______ 。
(1)(NH4)2SO4溶液可以用来除铁锈的原因:
(2)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka =1.77×10-4 | Ka= 4.0×10-8 | Ka1=4.3 ×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(3)根据上述电离平衡常数,试写出下列化学反应的离子方程式:
①向碳酸钠溶液中通入少量二氧化硫气体
②向碳酸钠溶液中滴入过量甲酸
Ⅱ.常温下,HNO2的电离平衡常数Ka =2.6×10-4,亚硝酸钠(NaNO2)是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(4)亚硝酸钠有毒,不能随意丢弃,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则反应的化学方程式为
(5)某活动小组同学设计实验方案鉴别NaCl溶液和NaNO2溶液,请填写下列表格。
| 选用药品 | 实验现象(NaNO2溶液) | 利用NaNO2的性质 |
| ①酚酞试液 | ||
| ②淀粉-KI试纸 |
Ⅲ.活动小组同学采用如下装置制备NaNO2(装置可重复使用,部分夹持仪器已省略)。

已知:①2NO+Na2O2=2NaNO2,
②酸性条件下,NO、NO2都能与
 反应生成
反应生成 和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。
和Mn2+;NaNO2能使酸性高锰酸钾溶液褪色。(6)实验装置的连接顺序为A→_______→_______→_______→_______→B;
(7)C瓶内发生反应的离子方程式为
(8)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.滴定前滴定管尖嘴中有气泡,滴定后滴定管尖嘴无气泡
c.判断终点时,滴入一滴酸性KMnO4溶液,锥形瓶内溶液呈浅红色,振荡后立即褪色
d.观察滴定终点时俯视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 将5.6g镁和铜的混合物加入到500mL1mol/L的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入2mol/LNaOH溶液至沉淀完全,生成沉淀的质量为10.7g,下列叙述错误的是
| A.当金属全部溶解时,电子转移的数目为0.3NA |
| B.混合物镁和铜的物质的量之比为1:2 |
| C.当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L |
| D.当生成的沉淀量达到最大时,消耗NaOH溶液的体积为200mL |
您最近一年使用:0次
2023-01-19更新
|
1611次组卷
|
3卷引用:重庆市第八中学校2021-2022学年高一下学期第二次月考化学试题
7 . Fe3O4是一种重要的化工产品,以黄铁矿烧渣(主要含Fe2O3、Fe3O4、CaO等物质)为原料制备Fe3O4的过程如下。
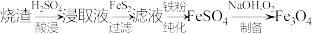
(1)酸浸、过滤
① 酸浸过程Fe3O4发生反应的离子方程式是________ 。
② 充分酸浸后浸取液中仍有Ca2+ 残留,加入FeS2可进一步提高钙的脱除率,结合方程式解释原因________ 。
(2)纯化
① Fe粉的作用是________ 。
② 检验纯化是否完全还原,应向滤液中加入________ 。
a.KMnO4溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液
(3)制备
将NaOH溶液与FeSO4溶液(稍过量)按一定比例混合,产生白色沉淀,继而转变为墨绿色,最后变为黑色。溶液混合的同时通入空气并记录pH的变化,如图所示。
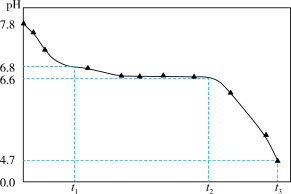
已知:
ⅰ.pH≈7.8时,浊液中主要存在Fe(OH)+、 Fe(OH)2和少量Fe2+
ⅱ.墨绿色物质主要成分为Fe5O2(OH)5SO4
制备过程可能发生了如下历程:
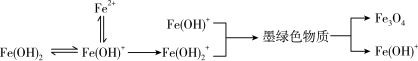
① 0~t1时段,pH明显降低。结合离子方程式解释原因:________ 。
② t1~t2时段,墨绿色物质的生成与转化(生成Fe3O4)同时进行。
a.生成墨绿色物质的方程式是:________ 。
b.墨绿色物质转化为Fe3O4的方程式是:________ 。
③ t2~t3时段,pH继续降低的原因是:________ 。
(1)酸浸、过滤
① 酸浸过程Fe3O4发生反应的离子方程式是
② 充分酸浸后浸取液中仍有Ca2+ 残留,加入FeS2可进一步提高钙的脱除率,结合方程式解释原因
(2)纯化
① Fe粉的作用是
② 检验纯化是否完全还原,应向滤液中加入
a.KMnO4溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液
(3)制备
将NaOH溶液与FeSO4溶液(稍过量)按一定比例混合,产生白色沉淀,继而转变为墨绿色,最后变为黑色。溶液混合的同时通入空气并记录pH的变化,如图所示。

已知:
ⅰ.pH≈7.8时,浊液中主要存在Fe(OH)+、 Fe(OH)2和少量Fe2+
ⅱ.墨绿色物质主要成分为Fe5O2(OH)5SO4
制备过程可能发生了如下历程:
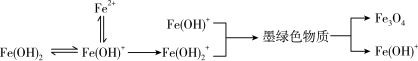
① 0~t1时段,pH明显降低。结合离子方程式解释原因:
② t1~t2时段,墨绿色物质的生成与转化(生成Fe3O4)同时进行。
a.生成墨绿色物质的方程式是:
b.墨绿色物质转化为Fe3O4的方程式是:
③ t2~t3时段,pH继续降低的原因是:
您最近一年使用:0次
名校
解题方法
8 . 从某含有 、
、 、
、 的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
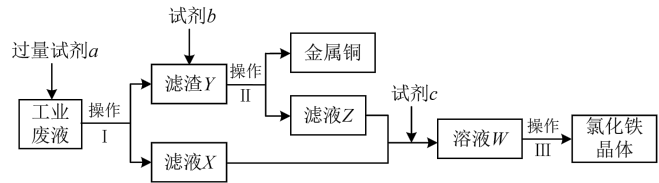
 、
、 、
、 的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
的工业废液中回收铜并制备氯化铁晶体的流程如下,则下列说法不正确的是
| A.试剂a为铁,试剂b为稀硫酸 |
B.加入试剂a过程中,有红色固体析出后,说明溶液中 已经反应完全 已经反应完全 |
C.试剂c可为 溶液,相应的反应为 溶液,相应的反应为 |
| D.溶液W可作“腐蚀液”腐蚀覆铜板 |
您最近一年使用:0次
2023-01-07更新
|
1439次组卷
|
5卷引用:天津市南开中学2022-2023学年高一上学期期末考试化学试题
天津市南开中学2022-2023学年高一上学期期末考试化学试题(已下线)【2023】【高一下】【期中考】【328】【高中化学】(已下线)专项02 氧化还原反应的概念、规律及综合应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)安徽省安庆市第七中学2023-2024学年高一下学期开学考试化学试题浙江省余姚中学2023-2024学年高一下学期3月质量检测化学(选考)试题
2023·重庆·模拟预测
9 . 四氧化三锰是一种重要的电子和新能源基础原材料,可以用于生产软磁锰锌铁氧体、锂电正极材料锰酸锂和负温度系数热敏电阻等。以软锰矿(主要成分为 还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分
还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分 )为原料制备大颗粒的电池
)为原料制备大颗粒的电池 。
。
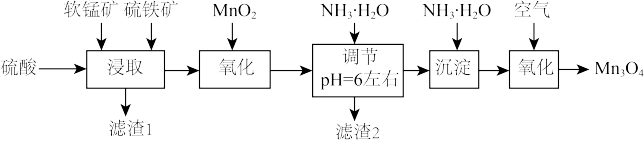
说明:
Ⅰ.“浸取”:研究发现,酸浸时 和
和 颗粒反应的原理如图1所示(部分产物未标出)。
颗粒反应的原理如图1所示(部分产物未标出)。
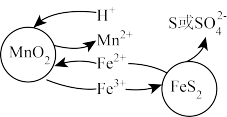
图1
Ⅱ.通空气“氧化”:将“沉淀”步骤所得含少量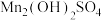 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得 。
。
Ⅲ.氢氧化物形式完全沉淀时溶液的pH见表:
(1)滤渣1中主要成分的化学式为_______ 。
(2)随硫铁矿的增加,锰的浸出率降低,可能的原因是_______ 。
(3)写出“浸取”时 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(4)加入 “氧化”的目的是
“氧化”的目的是_______ 。
(5)检验“沉淀”已洗净的操作是_______ 。
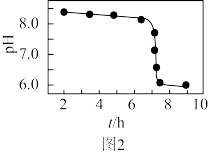
(6)“沉淀”加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是_______ 。
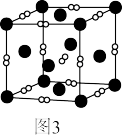
(7)一个立方体结构的 晶胞如图3所示,距离
晶胞如图3所示,距离 最近的
最近的 有
有_______ 个,已知阿伏加德罗数值为 ,则
,则 的晶体密度为
的晶体密度为 ,则晶胞的边长为
,则晶胞的边长为_______ nm(用含ρ、 的代数式表示)。
的代数式表示)。
 还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分
还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分 )为原料制备大颗粒的电池
)为原料制备大颗粒的电池 。
。
说明:
Ⅰ.“浸取”:研究发现,酸浸时
 和
和 颗粒反应的原理如图1所示(部分产物未标出)。
颗粒反应的原理如图1所示(部分产物未标出)。
图1
Ⅱ.通空气“氧化”:将“沉淀”步骤所得含少量
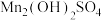 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得 。
。Ⅲ.氢氧化物形式完全沉淀时溶液的pH见表:
| 沉淀物 |  |  |  |  |
| 开始沉淀的pH | 3.4 | 2.2 | 6.3 | 8.1 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.7 | 10.4 |
(2)随硫铁矿的增加,锰的浸出率降低,可能的原因是
(3)写出“浸取”时
 与
与 反应的离子方程式为
反应的离子方程式为(4)加入
 “氧化”的目的是
“氧化”的目的是(5)检验“沉淀”已洗净的操作是
(6)“沉淀”加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是

(7)一个立方体结构的
 晶胞如图3所示,距离
晶胞如图3所示,距离 最近的
最近的 有
有 ,则
,则 的晶体密度为
的晶体密度为 ,则晶胞的边长为
,则晶胞的边长为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
10 . “84消毒液”广泛应用于杀菌消毒,其有效成分是 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
资料:i. 的电离常数为
的电离常数为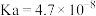 ;
; 的电离常数为
的电离常数为 、
、
ii.碘的化合物主要以 和
和 的形式存在,
的形式存在, 。
。
iii.碘单质能与 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I.制备消毒液(夹持装置略)

(1)制备 的离子反应方程式
的离子反应方程式_______ 。
(2)结合资料i,写出D中反应的化学方程式_______ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是_______ 。
假设2:过量的 将反应生成的
将反应生成的 氧化为
氧化为 。
。
设计实验b证实了假设2成立。 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是_______ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由_______ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据_______ 。
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是_______ 。
 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。资料:i.
 的电离常数为
的电离常数为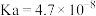 ;
; 的电离常数为
的电离常数为 、
、
ii.碘的化合物主要以
 和
和 的形式存在,
的形式存在, 。
。iii.碘单质能与
 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I.制备消毒液(夹持装置略)

(1)制备
 的离子反应方程式
的离子反应方程式(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9g 固体 固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9g 固体,再加入1 固体,再加入1 盐酸10mL 盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量 固体(小于0.5g) 固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是
假设2:过量的
 将反应生成的
将反应生成的 氧化为
氧化为 。
。设计实验b证实了假设2成立。
 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是
您最近一年使用:0次
2022-12-30更新
|
1167次组卷
|
4卷引用:河北省邯郸市第一中学2022-2023学年高三上学期一轮复习(四)化学试题



