解题方法
1 .  还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。
 还原
还原 是实现“双碳”经济的有效途径之一。在密闭容器中(
是实现“双碳”经济的有效途径之一。在密闭容器中( 和
和 按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现
按物质的量之比1:3投料,反应经如图所示的流程(主要产物已标出)可实现 的高效转化。
的高效转化。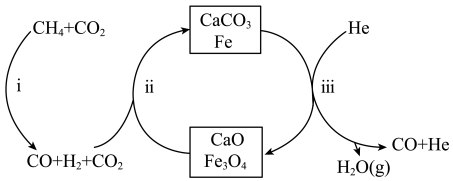
A.该反应的催化剂为 和 和 |
| B.过程iii在恒压条件下通入He,有利于增加CO的产量 |
| C.过程i、ii、iii均涉及置换反应 |
D.每生成4mol的CO,转移的电子数约为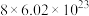 |
您最近一年使用:0次
名校
2 . 铜是使用广泛的一种金属。下图是某高砷银铜精矿制取铜、银的工艺。该矿石的主要成分是CuS,还含有Ag、As、Ca、Si、Al等的化合物。
①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②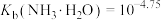 。
。
③萃取原理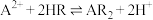 。
。
回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为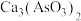 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式___________ 。
(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是___________ 。
(3)写出氨浸铜反应的离子方程式___________ 。氨铵比1:1时氨浸铜效果最好,此时溶液pH=___________ 。
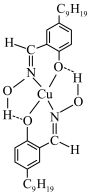
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为___________ ,萃取时萃取剂分子中___________ 键断裂。___________ 。
(6)浸银液含 ,还原时氧化产物为
,还原时氧化产物为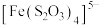 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为___________ 。

①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②
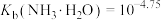 。
。③萃取原理
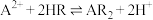 。
。回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为
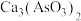 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是
(3)写出氨浸铜反应的离子方程式
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为
(6)浸银液含
 ,还原时氧化产物为
,还原时氧化产物为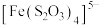 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
2024-04-21更新
|
201次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
名校
解题方法
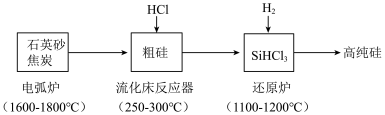
3 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:____________ 。当有1molC参与反应时,该反应转移的电子数是_____________ 。
(2)还原炉中发生的化学反应方程式为:____________ 。
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有_____________ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为____________ 。
(5)关于硅及其相关化合物的叙述正确的是_____________
A.自然界中存在天然游离的硅单质
B.已知C与Si的最高正价都是正四价,由于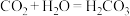 ,因此
,因此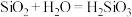
C.硅元素在金属与非金属的分界线处,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
(2)还原炉中发生的化学反应方程式为:
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与Si的最高正价都是正四价,由于
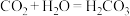 ,因此
,因此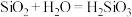
C.硅元素在金属与非金属的分界线处,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
您最近一年使用:0次
解题方法
4 . 钯(Pd)是航天、航空等高科技领域不可缺少的关键材料。一种从铂钯精矿[含有Pt、Pd、Au、Cu、Bi]中分离提取钯的工艺流程如图所示:
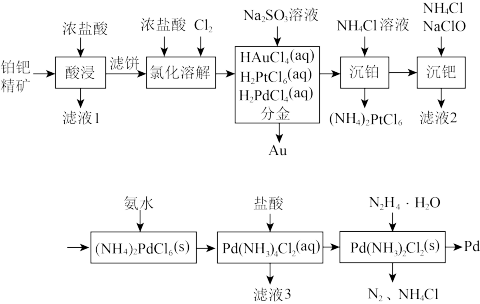
(1)“滤液1”中含有 和
和 ,
, 中Cu的化合价为
中Cu的化合价为________ ;Bi与As在周期表中位于同一主族,基态As原子的简化电子排布式为________ 。
(2)“氯化溶解”时氯气的作用是_________ 。
(3)“分金”时, 的氧化性
的氧化性____ (填“大于”或“小于”) ,理由是
,理由是_____ 。
(4)“沉铂”时发生反应的化学方程式为_________ 。
(5)“沉钯”时反应的化学方程式为___________ 。“滤液3”可以进入到________ 中循环利用。
(6) (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为________ 。

(1)“滤液1”中含有
 和
和 ,
, 中Cu的化合价为
中Cu的化合价为(2)“氯化溶解”时氯气的作用是
(3)“分金”时,
 的氧化性
的氧化性 ,理由是
,理由是(4)“沉铂”时发生反应的化学方程式为
(5)“沉钯”时反应的化学方程式为
(6)
 (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
2024-04-09更新
|
277次组卷
|
3卷引用:山西省晋中市2024届高三第二次优生测试理综合化学试题-
名校
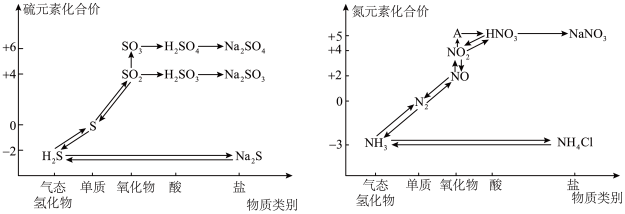
5 . 硫、氮的氧化物都会引起环境问题,越来越引起人们的重视。如图是硫、氮元素的各种价态与物质类别的对应关系:
(1)从硫元素的化合价变化的角度判断,图中只有还原性的含硫化合物为_________ 。
(2)写出浓硫酸与木炭在加热条件下反应的化学方程式:_________________________ ;若要除去 中的
中的 可以使用
可以使用_________ (填试剂名称)。
(3)根据A对应的化合价和物质类别,A为_________ (写分子式)。
(4)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择_________ ,反应的离子方程式为__________________ 。
(5)工业生产中利用氨水吸收 和
和 ,流程如图所示:
,流程如图所示: 被吸收过程的离子方程式是
被吸收过程的离子方程式是_______________________ 。
(6)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下: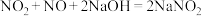
 ;
; 。现有V L某NaOH溶液能完全吸收含m mol NO和n mol
。现有V L某NaOH溶液能完全吸收含m mol NO和n mol  的大气污染物,则NaOH溶液的物质的量浓度至少为
的大气污染物,则NaOH溶液的物质的量浓度至少为________  。若所得溶液
。若所得溶液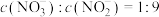 ,则原混合气体中NO和
,则原混合气体中NO和 物质的量之比m∶n=
物质的量之比m∶n=_____ 。
(1)从硫元素的化合价变化的角度判断,图中只有还原性的含硫化合物为
(2)写出浓硫酸与木炭在加热条件下反应的化学方程式:
 中的
中的 可以使用
可以使用(3)根据A对应的化合价和物质类别,A为
(4)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(5)工业生产中利用氨水吸收
 和
和 ,流程如图所示:
,流程如图所示: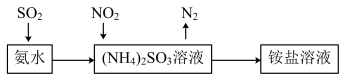
 被吸收过程的离子方程式是
被吸收过程的离子方程式是(6)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
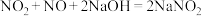
 ;
; 。现有V L某NaOH溶液能完全吸收含m mol NO和n mol
。现有V L某NaOH溶液能完全吸收含m mol NO和n mol  的大气污染物,则NaOH溶液的物质的量浓度至少为
的大气污染物,则NaOH溶液的物质的量浓度至少为 。若所得溶液
。若所得溶液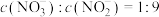 ,则原混合气体中NO和
,则原混合气体中NO和 物质的量之比m∶n=
物质的量之比m∶n=
您最近一年使用:0次
2024-03-26更新
|
317次组卷
|
2卷引用:山西省大同市2023-2024学年高一下学期3月月考化学试题
名校
6 . 大气中 主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将
主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是
 主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将
主要来自天然气净化、炼焦、石油精炼、人造丝生产、造纸、橡胶、染料、制药等工业生产过程。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是
的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中,正确的是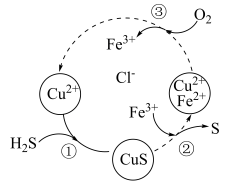
A.过程①中,生成CuS的反应为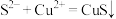 |
B.过程②中, 作还原剂 作还原剂 |
C.过程③中,每消耗1mol  ,转移2mol ,转移2mol  |
D.回收S的总反应为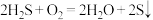 |
您最近一年使用:0次
2024-03-26更新
|
60次组卷
|
3卷引用:山西省大同市2023-2024学年高一下学期3月月考化学试题
名校
7 . 汽车剧烈碰撞时,安全气囊中发生反应:NaN3+KNO3→K2O+Na2O+N2↑(未配平)。对上述反应的描述错误的是
| A.NaN3是还原剂,KNO3是氧化剂 |
| B.该反应中只有1种元素的化合价发生变化 |
| C.配平后物质的化学计量数依次为10、2、1、5、16 |
| D.生成N2的个数与转移电子个数之比为4:5 |
您最近一年使用:0次
2024-03-22更新
|
105次组卷
|
2卷引用:山西省运城市康杰中学2023-2024学年高一下学期化学试题
名校
8 . 为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成 ,致密保护层—“发蓝”。化学处理过程中涉及到的反应为
,致密保护层—“发蓝”。化学处理过程中涉及到的反应为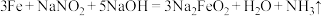 ,下列叙述错误的是
,下列叙述错误的是
 ,致密保护层—“发蓝”。化学处理过程中涉及到的反应为
,致密保护层—“发蓝”。化学处理过程中涉及到的反应为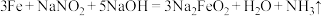 ,下列叙述错误的是
,下列叙述错误的是| A.铁做还原剂,被氧化 | B. 中N元素的化合价为+3价 中N元素的化合价为+3价 |
C.氧化性: | D.反应中每转移3mol电子,生成11.2L |
您最近一年使用:0次
2024-02-22更新
|
124次组卷
|
2卷引用:山西省长治市上党好教育联盟2023-2024学年高一上学期1月期末化学试题
9 . 目前支原体肺炎流行,及时消毒有利于降低感染几率。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂等,其中含氯消毒剂的家族最庞大、应用最广泛。
(1)次氯酸钠( )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为___________ 。
(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是___________ ,若生成标况下44.8L的 ,转移电子的数目为
,转移电子的数目为___________ 。
(3)如果在不同温度、浓度的条件下, 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,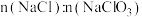 为
为___________ ,整个过程,参加反应所需 与氯气的物质的量之比为
与氯气的物质的量之比为___________ 。
若将 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:
(4) 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法___________ 。
A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
亚氯酸钠( )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。 在发生器中发生
在发生器中发生________ (氧化或还原)反应,该反应的还原产物为_________ ,吸收塔中温度不宜过高,否则会导致 产率下降,原因是
产率下降,原因是___________ 。
(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为___________ 。(保留两位小数)。
(1)次氯酸钠(
 )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是
 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是 ,转移电子的数目为
,转移电子的数目为(3)如果在不同温度、浓度的条件下,
 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,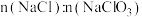 为
为 与氯气的物质的量之比为
与氯气的物质的量之比为若将
 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:(4)
 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
A. amol amol | B. amol amol | C. amol amol | D.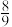 amol amol |
亚氯酸钠(
 )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。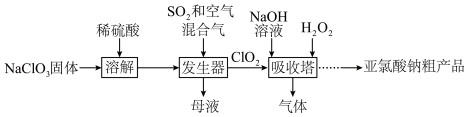
 在发生器中发生
在发生器中发生 产率下降,原因是
产率下降,原因是(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克
 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2024-02-02更新
|
0次组卷
|
2卷引用:山西省运城市景胜中学2023-2024学年高一下学期3月月考化学试题
名校
10 . 生活离不开化学。化学与生产生活密切相关,利用所学知识回答下列问题。
I.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分。
①食盐(NaCl)②料酒(乙醇)③食醋(乙酸)④碱面( )⑤发酵粉(
)⑤发酵粉( 和明矾)⑥84消毒液(NaClO)⑦洁厕灵(HCl)
和明矾)⑥84消毒液(NaClO)⑦洁厕灵(HCl)
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是___________ 。
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填正确答案标号)。
(3)写出过量③和④反应的离子方程式___________ 。
(4)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:___________ 。
(5)某同学用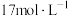 的浓硫酸配制
的浓硫酸配制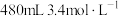 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为___________ mL。
Ⅱ.汽车安全气囊内装有、和 等物质
等物质
(6)当汽车发生严重碰撞时,引发 分解:
分解: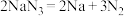 ,
, 的电子式为
的电子式为___________ ,若安全气囊内有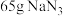 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为___________ L,产生的Na立即与 发生置换反应生成
发生置换反应生成 ,其中氧化剂和还原剂的物质的量比是
,其中氧化剂和还原剂的物质的量比是___________ 。
I.家庭厨卫中有许多中学化学常见的物质,括号内为厨卫商品的主要成分。
①食盐(NaCl)②料酒(乙醇)③食醋(乙酸)④碱面(
 )⑤发酵粉(
)⑤发酵粉( 和明矾)⑥84消毒液(NaClO)⑦洁厕灵(HCl)
和明矾)⑥84消毒液(NaClO)⑦洁厕灵(HCl)(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(2)②③的主要成分可以归为一类物质,其分类的依据是___________(填正确答案标号)。
| A.两种物质都是非电解质 | B.两种物质都是电解质 |
| C.两种物质都是氧化物 | D.两种物质都是含碳化合物 |
(4)84消毒液和洁厕灵不能混合使用,用离子方程式表示其理由:
(5)某同学用
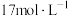 的浓硫酸配制
的浓硫酸配制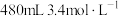 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为Ⅱ.汽车安全气囊内装有、和
 等物质
等物质(6)当汽车发生严重碰撞时,引发
 分解:
分解: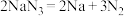 ,
, 的电子式为
的电子式为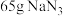 ,其完全分解所释放的
,其完全分解所释放的 在标准状况下的体积为
在标准状况下的体积为 发生置换反应生成
发生置换反应生成 ,其中氧化剂和还原剂的物质的量比是
,其中氧化剂和还原剂的物质的量比是
您最近一年使用:0次
2024-01-25更新
|
98次组卷
|
2卷引用:山西省大同市2023-2024学年高一下学期3月月考化学试题



