2023·上海长宁·二模
解题方法
1 . 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是
| A.生成12.7g I2时,转移0.1mol电子 | B.KI是还原产物 |
| C.还原剂与氧化剂的物质的量之比为7:1 | D.K2H3IO6发生氧化反应 |
您最近一年使用:0次
2023·上海青浦·二模
解题方法
2 . 磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应2Ca3(PO4)2+10C→6CaO+P4+10CO获得。完成下列填空:
(1)磷原子的最外层电子排布式是_____ ,氧原子核外有_____ 种不同运动状态的电子。白磷在空气中露置时间长了会因温度达到着火点而自燃,使白磷升温的热量主要来自_____ 。
(2)N和P在周期表中位于_____ 族,PH3分子的空间构型为_____ ,是_____ 分子(填“极性”或“非极性”)。下列能说明N和P非金属性相对强弱的是_____ (填编号)。
a.NH3的稳定性比PH3强 b.NH3的沸点比PH3高
c.硝酸酸性比磷酸强 d.N原子半径比P原子小
铜既能与浓硝酸反应,也能与稀硝酸反应,当铜与一定浓度硝酸反应时,可将化学方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(未配平,不考虑2NO2 N2O4)。完成下列填空:
N2O4)。完成下列填空:
(3)3Cu+10HNO3→ Cu(NO3)2+
Cu(NO3)2+ NO↑+
NO↑+ NO2↑+
NO2↑+ H2O。配平上述化学方程式,用单线桥法标出电子转移方向和数目。
H2O。配平上述化学方程式,用单线桥法标出电子转移方向和数目。______
(4)0.3molCu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______ 。
(1)磷原子的最外层电子排布式是
(2)N和P在周期表中位于
a.NH3的稳定性比PH3强 b.NH3的沸点比PH3高
c.硝酸酸性比磷酸强 d.N原子半径比P原子小
铜既能与浓硝酸反应,也能与稀硝酸反应,当铜与一定浓度硝酸反应时,可将化学方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(未配平,不考虑2NO2
 N2O4)。完成下列填空:
N2O4)。完成下列填空:(3)3Cu+10HNO3→
 Cu(NO3)2+
Cu(NO3)2+ NO↑+
NO↑+ NO2↑+
NO2↑+ H2O。配平上述化学方程式,用单线桥法标出电子转移方向和数目。
H2O。配平上述化学方程式,用单线桥法标出电子转移方向和数目。(4)0.3molCu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是
您最近一年使用:0次
2023·上海闵行·二模
3 . 某国产电动汽车推出的“刀片电池”具有强环境适应性,更安全可靠。“刀片电池”正极材料使用了磷酸亚铁锂(LiFePO4)。磷酸亚铁锂(LiFePO4)由Li2CO3、C6H12O6和FePO4在高温条件下制备。
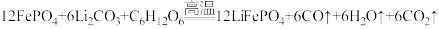
(1)铁是26号元素,它是___________ 。(选填编号)
a.主族元素b.副族元素c.短周期元素d.长周期元素
磷元素的原子核外有___________ 种运动状态不同的电子。
(2)上述方程式中,CO2的电子式为___________ ,属于第二周期的元素,原子半径由小到大排列___________ 。
(3)反应中的氧化剂是___________ ;当有0.1molLiFePO4生成时,转移电子的数目为___________ 个。
磷酸亚铁锂也可以用(CH3COO)2Fe、NH4H2PO4和LiOH为原料制备。
(4)NH4H2PO4溶于水形成的溶液中存在:c(H+)+c( )=c(OH-)+c(H2PO
)=c(OH-)+c(H2PO )+
)+___________ 。
(5)请解释(CH3COO)2Fe溶于水显酸性的原因___________ 。
(1)铁是26号元素,它是
a.主族元素b.副族元素c.短周期元素d.长周期元素
磷元素的原子核外有
(2)上述方程式中,CO2的电子式为
(3)反应中的氧化剂是
磷酸亚铁锂也可以用(CH3COO)2Fe、NH4H2PO4和LiOH为原料制备。
(4)NH4H2PO4溶于水形成的溶液中存在:c(H+)+c(
 )=c(OH-)+c(H2PO
)=c(OH-)+c(H2PO )+
)+(5)请解释(CH3COO)2Fe溶于水显酸性的原因
您最近一年使用:0次
2023·上海奉贤·二模
4 . 关于反应4CO2+SiH4 4CO+SiO2+2H2O,下列说法正确的是
4CO+SiO2+2H2O,下列说法正确的是
 4CO+SiO2+2H2O,下列说法正确的是
4CO+SiO2+2H2O,下列说法正确的是| A.CO是氧化产物 | B.SiH4发生还原反应 |
| C.氧化剂与还原剂的物质的量之比为1∶4 | D.还原性:SiH4>CO |
您最近一年使用:0次
2023·上海黄浦·二模
解题方法
5 . 卤族元素能形成多种物质,结构和性质之间充满联系。
(1)部分卤族元素的某种性质a随核电荷数的变化趋势如图所示,则a表示正确的是_____ 。(填字母)
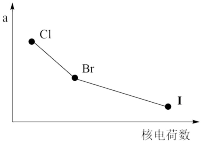
a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为_____ ;溴原子核外电子能量最高的电子层符号是_____ 。
(3)ClF3的熔、沸点比BrF3的_____ (填“高”或“低”),理由是_____ 。
ClO2气体可处理污水中的CN-,以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(4)ClO2与CN- (C是+2价)反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为_____ 。
(5)请评价上述哪一种方法制备的ClO2更适合用于饮用水的消毒______ 。
(1)部分卤族元素的某种性质a随核电荷数的变化趋势如图所示,则a表示正确的是

a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为
(3)ClF3的熔、沸点比BrF3的
ClO2气体可处理污水中的CN-,以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(4)ClO2与CN- (C是+2价)反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
(5)请评价上述哪一种方法制备的ClO2更适合用于饮用水的消毒
您最近一年使用:0次
2022·上海浦东新·模拟预测
解题方法
6 . 某污水处理工艺中, 的转化途径如下图所示:
的转化途径如下图所示:

完成下列填空:
(1)上述转化过程_______ (选填“属于”或“不属于”)氮的固定。N原子核外能量最高的电子有_______ 个,这些电子_______ (选填编号)
a.所处的电子亚层相同 b.自旋方向相同
c.占据的轨道相同 d.运动状态相同
(2)从原子结构角度解释NO分子中氮元素化合价呈正价的原因_______ 。
(3) 中氢元素的化合价为
中氢元素的化合价为 价,写出
价,写出 的结构式
的结构式_______ ,其所含共价键的类型为_______ ;若其分子的极性与 相同,则它是
相同,则它是_______ (选填“极性”或“非极性”)分子。
(4)配平离子方程式:_______ 。
_______NO+_______ _______
_______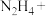 _______
_______ _______
_______
若反应所得的氧化产物比还原产物多1.5mol,则该反应转移的电子为_______ mol。
 的转化途径如下图所示:
的转化途径如下图所示:
完成下列填空:
(1)上述转化过程
a.所处的电子亚层相同 b.自旋方向相同
c.占据的轨道相同 d.运动状态相同
(2)从原子结构角度解释NO分子中氮元素化合价呈正价的原因
(3)
 中氢元素的化合价为
中氢元素的化合价为 价,写出
价,写出 的结构式
的结构式 相同,则它是
相同,则它是(4)配平离子方程式:
_______NO+_______
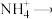 _______
_______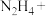 _______
_______ _______
_______
若反应所得的氧化产物比还原产物多1.5mol,则该反应转移的电子为
您最近一年使用:0次
2023-04-05更新
|
231次组卷
|
3卷引用:专题18 结构与性质
2023·上海宝山·一模
7 . 氨基钠( )是重要的化学试剂,其与氧气的反应如下:
)是重要的化学试剂,其与氧气的反应如下: 。下列说法正确的是
。下列说法正确的是
 )是重要的化学试剂,其与氧气的反应如下:
)是重要的化学试剂,其与氧气的反应如下: 。下列说法正确的是
。下列说法正确的是A. |
B.每消耗 ,转移电子数是 ,转移电子数是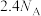 |
C. 是氧化产物 是氧化产物 |
D. 中N的化合价部分发生变化 中N的化合价部分发生变化 |
您最近一年使用:0次
2023高一下·上海嘉定·学业考试
名校
8 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
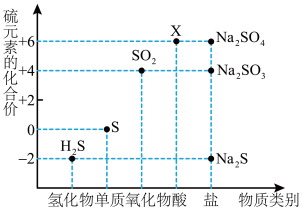
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
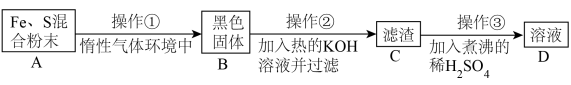
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
2023·上海普陀·二模
9 . 工业上可利用反应Na2SO4 + 2C Na2S + 2CO2↑来制备硫化钠,下列说法错误的是
Na2S + 2CO2↑来制备硫化钠,下列说法错误的是
 Na2S + 2CO2↑来制备硫化钠,下列说法错误的是
Na2S + 2CO2↑来制备硫化钠,下列说法错误的是A.Na2S溶液显碱性是由于S2-+ 2H2O H2S + 2OH- H2S + 2OH- |
| B.反应中,消耗1 mol碳时,可生成22.4 L 标准状况下的CO2 |
| C.反应中,生成1 mol Na2S时,转移8 mol电子 |
| D.该反应中氧化剂和还原剂的物质的量比为1∶2 |
您最近一年使用:0次
2023·上海徐汇·一模
解题方法
10 . NH3和NO2在催化剂作用下发生反应:8NH3+6NO2=7N2+12H2O,若还原产物比氧化产物少0.1mol,下列说法正确的是
| A.还原剂比氧化剂多0.2mol | B.转移电子的物质的量为3.6mol |
| C.生成32.56L的气体(标准状况下) | D.被还原的氮原子质量为11.2g |
您最近一年使用:0次



