名校
解题方法
1 . NaClO2是一种重要的杀菌消毒剂,其一种生产工艺如图:

(1)NaClO2中Cl的化合价为_______ 。
(2)“反应”步骤中的氧化剂是_______。
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2,发生如下反应:2NaOH+H2O2+2ClO2=2NaClO2+O2+2H2O。
①用单线桥表示电子转移方向和数目_______ 。
②此吸收反应中,氧化产物是_______ ,氧化剂与还原剂的物质的量之比为_______ 。
③比较氧化性:ClO2_______ O2(填“>”、“<”或“=”)。
(4)硫代硫酸钠可作为脱氯剂,已知25.0mL0.1mol/LNa2S2O3溶液恰好把224mL(标准状况)Cl2完全转化为Cl-离子,则S2O 将转化成_______。
将转化成_______。
(5)往100mL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/4的溴离子被氧化成溴单质。则原溴化亚铁溶液的物质的量浓度为_______ mol·L-1。

(1)NaClO2中Cl的化合价为
(2)“反应”步骤中的氧化剂是_______。
| A.硫酸 | B.SO2 | C.NaClO3 | D.ClO2 |
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2,发生如下反应:2NaOH+H2O2+2ClO2=2NaClO2+O2+2H2O。
①用单线桥表示电子转移方向和数目
②此吸收反应中,氧化产物是
③比较氧化性:ClO2
(4)硫代硫酸钠可作为脱氯剂,已知25.0mL0.1mol/LNa2S2O3溶液恰好把224mL(标准状况)Cl2完全转化为Cl-离子,则S2O
 将转化成_______。
将转化成_______。| A.S2- | B.S | C.SO | D.SO |
(5)往100mL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/4的溴离子被氧化成溴单质。则原溴化亚铁溶液的物质的量浓度为
您最近一年使用:0次
名校
2 . 吸入氧气、排出二氧化碳,这看似再简单不过的新陈代谢,在遥远的太空中却并不容易,因为在航天服、航天器、空间站等密闭系统中,CO2浓度会高得多,而超过一定浓度会导致呼吸急促、头晕头痛、昏迷甚至死亡,因此必须通过一定方法将CO2清除。
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为___________ 。采用LiOH而不用NaOH的原因是___________ 。
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是___________ 变化。
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
Ⅳ.富集CO2的原电池模拟装置如图:
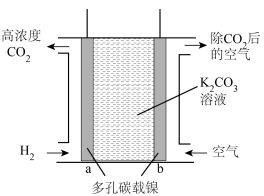
(4)b极为___________ 极,a电极上发生的电极反应为___________ 。
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(6)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:
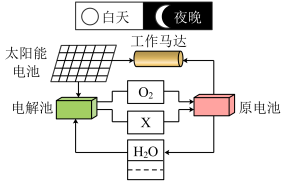
关于该循环系统下列说法正确的是
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
| A.CO2的最终产物为CH4和O2 |
| B.电解水装置中,反应物的能量高于生成物的能量 |
| C.萨巴蒂尔反应器中反应的氧化剂与还原剂物质的量之比为1∶4 |
| D.物质转化中O、H原子的利用率均为100% |
Ⅳ.富集CO2的原电池模拟装置如图:

(4)b极为
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是
(6)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:

关于该循环系统下列说法正确的是
| A.该系统中存在着太阳能、电能、化学能和机械能之间的相互转化 |
| B.电解池中可选用CuSO4来增强水的导电性 |
| C.太阳能电池帆板的主要成分为SiO2 |
| D.利用太阳能代替化石能源符合“低碳经济” |
您最近一年使用:0次
2023-10-24更新
|
460次组卷
|
3卷引用:上海市复旦大学附属中学2023-2024学年高三上学期暑期学习评估检测化学试题
名校
3 . 氮循环是大气中的氮气经微生物等作用进入土壤与海洋,为动植物所利用,最终又在微生物的参与下返回大气,如此反复循环,建立起的平衡。
(1)土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:___ ____
____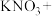 ___
___ ___
___ ___
___ ___KOH,配平上述反应方程式,并标出电子转移的方向和数目
___KOH,配平上述反应方程式,并标出电子转移的方向和数目__________________________ 。
(2)氨态氮( )与亚硝态氮(
)与亚硝态氮( )可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为
)可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为___________ mol。
(1)土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:___
 ____
____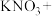 ___
___ ___
___ ___
___ ___KOH,配平上述反应方程式,并标出电子转移的方向和数目
___KOH,配平上述反应方程式,并标出电子转移的方向和数目(2)氨态氮(
 )与亚硝态氮(
)与亚硝态氮( )可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为
)可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02mol氮气时,转移电子的物质的量为
您最近一年使用:0次
名校
4 . 双碱法脱除烟气中 的过程如图所示。下列有关说法
的过程如图所示。下列有关说法不正确 的是

 的过程如图所示。下列有关说法
的过程如图所示。下列有关说法
A.脱除 的目的是防止污染空气 的目的是防止污染空气 | B.过程I中, 表现出还原性 表现出还原性 |
C.脱除 的过程中, 的过程中, 可以循环利用 可以循环利用 | D.过程Ⅱ中,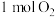 可氧化 可氧化 |
您最近一年使用:0次
2023-02-16更新
|
731次组卷
|
4卷引用: 上海交通大学附属中学2022-2023学年高三下学期开学摸底考试化学试题
5 . 某废气(含 )脱硫的方法是将废气与空气混合,再通入由
)脱硫的方法是将废气与空气混合,再通入由 、
、 、
、 组成的混合液中,脱硫转化的流程如图所示,下列说法错误的是
组成的混合液中,脱硫转化的流程如图所示,下列说法错误的是

 )脱硫的方法是将废气与空气混合,再通入由
)脱硫的方法是将废气与空气混合,再通入由 、
、 、
、 组成的混合液中,脱硫转化的流程如图所示,下列说法错误的是
组成的混合液中,脱硫转化的流程如图所示,下列说法错误的是
A.氧化性: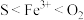 |
B.转化过程中参与循环的离子有 、 、 、 、 |
| C.过程Ⅱ为氧化还原反应,两种反应物的物质的量比为1∶1 |
D.过程Ⅲ中每转移0.1mol电子会生成0.1mol的 |
您最近一年使用:0次
2023-02-16更新
|
358次组卷
|
2卷引用: 上海交通大学附属中学2022-2023学年高三下学期开学摸底考试化学试题
名校
解题方法
6 . 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2S2O3与硫黄(S)共煮得到,装置如图。(已知:Na2S2O3在酸性溶液中不能稳定存在,会发生歧化反应。)

(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲(浓硫酸)并加热,烧瓶中反应的化学方程式:Cu+2H2SO4(浓)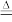 CuSO4+SO2↑+2H2O。生成物中,属于非电解质的是
CuSO4+SO2↑+2H2O。生成物中,属于非电解质的是___________ 。每生成0.5mol还原产物,消耗Cu的质量为___________ ,该过程中体现出浓硫酸___________ 的性质。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性,若呈酸性,则会发生___________ 和___________ (都用离子方程式表示)。
②装置B、D的试剂相同,均为___________ 。
步骤3:将C中所得混合物分离提纯后得产品。
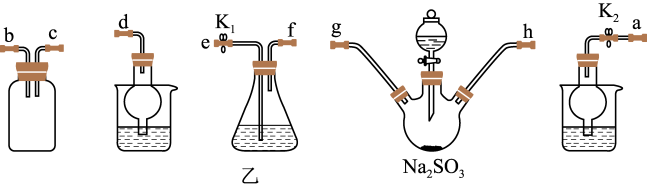
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器见下图,按气流方向连接各仪器,接口顺序为a→g,h→___________ ,___________ →___________ ,___________ →d。
(4)Na2S2O3还原性强,工业上常用来除去溶液中残留的Cl2,往溶液中加入适量的Na2S2O3溶液,使其恰好与残留的Cl2完全反应,离子方程式为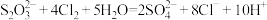 ,请设计实验方案,证明溶液中有Cl-
,请设计实验方案,证明溶液中有Cl-___________ 。

(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲(浓硫酸)并加热,烧瓶中反应的化学方程式:Cu+2H2SO4(浓)
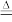 CuSO4+SO2↑+2H2O。生成物中,属于非电解质的是
CuSO4+SO2↑+2H2O。生成物中,属于非电解质的是(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性,若呈酸性,则会发生
②装置B、D的试剂相同,均为
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器见下图,按气流方向连接各仪器,接口顺序为a→g,h→

(4)Na2S2O3还原性强,工业上常用来除去溶液中残留的Cl2,往溶液中加入适量的Na2S2O3溶液,使其恰好与残留的Cl2完全反应,离子方程式为
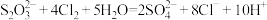 ,请设计实验方案,证明溶液中有Cl-
,请设计实验方案,证明溶液中有Cl-
您最近一年使用:0次
2022-04-25更新
|
766次组卷
|
3卷引用:上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题
上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题(已下线)微专题22 新型含硫化合物的制备与性质探究(Na2S2O3 Na2S2O4 Na2S4O6 )-备战2023年高考化学一轮复习考点微专题福建省莆田锦江中学2022-2023学年高三上学期第一次月考化学试题
7 . 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
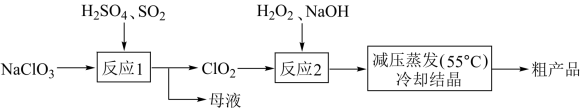

| A.反应1中,每生成1molClO2有0.5molSO2被氧化 |
| B.从母液中可以提取Na2SO4 |
| C.反应2中,氧化剂与还原剂的物质的量之比为1∶2 |
| D.采用减压蒸发可能是为了防止NaClO2受热分解 |
您最近一年使用:0次
2022-04-25更新
|
437次组卷
|
3卷引用:上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题
上海交通大学附属中学2021-2022学年高一下学期开学摸底考试化学试题(已下线)第03练 氧化还原反应-2023年高考化学一轮复习小题多维练(全国通用)河南省郑州市实验中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
8 . 向FeBr2和FeI2的混合溶液中通入氯气至恰好完全反应,Fe2+、I-、Br-的物质的量的变化如下图所示。下列说法正确的是
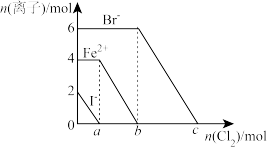

A.还原性: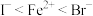 |
| B.通入氯气的总物质的量为6mol |
C.若检验出反应液中有Fe3+,则 |
| D.c点时加入过量NaOH溶液,反应后溶液中只含Na+、H+、Cl-、OH-四种离子 |
您最近一年使用:0次
名校
9 . 现有下列六种物质:
①液态HCl② 溶液③KOH固体④
溶液③KOH固体④ ⑤熔融
⑤熔融 ⑥
⑥ 胶体⑦
胶体⑦ ,请回答下列问题。
,请回答下列问题。
(1)上述物质中,属于电解质的是_______ ;(填写物质的序号,下同);属于非电解质的是_______ ;在题中状态下既是电解质又能导电的是_______ ;写出 的电离方程式:
的电离方程式:_______ 。
(2)②与少量 溶液反应的离子方程式为:
溶液反应的离子方程式为:_______ 。
(3)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备 气体的反应原理如下:
气体的反应原理如下:
_______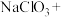 _______
_______ _______
_______ _______
_______ _______
_______ _______NaCl
_______NaCl
配平上述方程式,并标出电子转移的方向和数目(单线桥)_______ 。
(4)该反应中,被还原的元素是_______ ;转移1mol电子时,生成气体的物质的量是_______ 。
①液态HCl②
 溶液③KOH固体④
溶液③KOH固体④ ⑤熔融
⑤熔融 ⑥
⑥ 胶体⑦
胶体⑦ ,请回答下列问题。
,请回答下列问题。(1)上述物质中,属于电解质的是
 的电离方程式:
的电离方程式:(2)②与少量
 溶液反应的离子方程式为:
溶液反应的离子方程式为:(3)二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备
 气体的反应原理如下:
气体的反应原理如下:_______
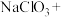 _______
_______ _______
_______ _______
_______ _______
_______ _______NaCl
_______NaCl配平上述方程式,并标出电子转移的方向和数目(单线桥)
(4)该反应中,被还原的元素是
您最近一年使用:0次
名校
解题方法
10 . 在酸性条件下,某金属离子M3+与ClO 发生氧化还原反应,氧化产物M2O
发生氧化还原反应,氧化产物M2O 和还原产物Cl-的物质的量之比为1:1,则M2O
和还原产物Cl-的物质的量之比为1:1,则M2O 中M的化合价是
中M的化合价是
 发生氧化还原反应,氧化产物M2O
发生氧化还原反应,氧化产物M2O 和还原产物Cl-的物质的量之比为1:1,则M2O
和还原产物Cl-的物质的量之比为1:1,则M2O 中M的化合价是
中M的化合价是| A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2021-12-10更新
|
243次组卷
|
3卷引用:上海市七宝中学2021-2022学年高一下学期开学摸底测试化学试题



