名校
1 . 铜是使用广泛的一种金属。下图是某高砷银铜精矿制取铜、银的工艺。该矿石的主要成分是CuS,还含有Ag、As、Ca、Si、Al等的化合物。
①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②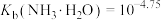 。
。
③萃取原理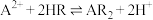 。
。
回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为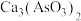 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式___________ 。
(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是___________ 。
(3)写出氨浸铜反应的离子方程式___________ 。氨铵比1:1时氨浸铜效果最好,此时溶液pH=___________ 。
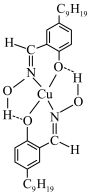
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为___________ ,萃取时萃取剂分子中___________ 键断裂。___________ 。
(6)浸银液含 ,还原时氧化产物为
,还原时氧化产物为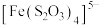 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为___________ 。

①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②
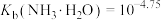 。
。③萃取原理
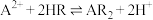 。
。回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为
 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是
(3)写出氨浸铜反应的离子方程式
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为
(6)浸银液含
 ,还原时氧化产物为
,还原时氧化产物为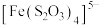 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
2024-04-21更新
|
201次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
名校
解题方法
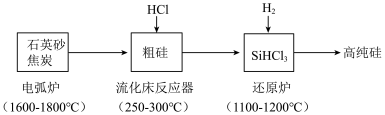
2 . 高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:____________ 。当有1molC参与反应时,该反应转移的电子数是_____________ 。
(2)还原炉中发生的化学反应方程式为:____________ 。
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有_____________ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为____________ 。
(5)关于硅及其相关化合物的叙述正确的是_____________
A.自然界中存在天然游离的硅单质
B.已知C与Si的最高正价都是正四价,由于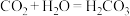 ,因此
,因此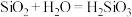
C.硅元素在金属与非金属的分界线处,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
(2)还原炉中发生的化学反应方程式为:
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与Si的最高正价都是正四价,由于
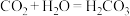 ,因此
,因此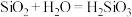
C.硅元素在金属与非金属的分界线处,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
您最近一年使用:0次
解题方法
3 . 钯(Pd)是航天、航空等高科技领域不可缺少的关键材料。一种从铂钯精矿[含有Pt、Pd、Au、Cu、Bi]中分离提取钯的工艺流程如图所示:
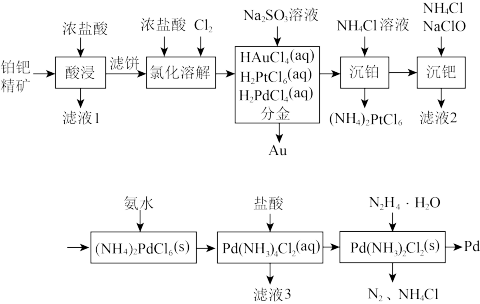
(1)“滤液1”中含有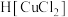 和
和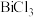 ,
,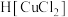 中Cu的化合价为
中Cu的化合价为________ ;Bi与As在周期表中位于同一主族,基态As原子的简化电子排布式为________ 。
(2)“氯化溶解”时氯气的作用是_________ 。
(3)“分金”时,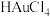 的氧化性
的氧化性____ (填“大于”或“小于”)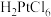 ,理由是
,理由是_____ 。
(4)“沉铂”时发生反应的化学方程式为_________ 。
(5)“沉钯”时反应的化学方程式为___________ 。“滤液3”可以进入到________ 中循环利用。
(6) (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为________ 。

(1)“滤液1”中含有
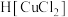 和
和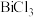 ,
,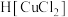 中Cu的化合价为
中Cu的化合价为(2)“氯化溶解”时氯气的作用是
(3)“分金”时,
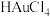 的氧化性
的氧化性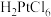 ,理由是
,理由是(4)“沉铂”时发生反应的化学方程式为
(5)“沉钯”时反应的化学方程式为
(6)
 (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
2024-04-09更新
|
277次组卷
|
3卷引用:山西省晋中市2024届高三第二次优生测试理综合化学试题-
4 . 目前支原体肺炎流行,及时消毒有利于降低感染几率。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂等,其中含氯消毒剂的家族最庞大、应用最广泛。
(1)次氯酸钠( )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为___________ 。
(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是___________ ,若生成标况下44.8L的 ,转移电子的数目为
,转移电子的数目为___________ 。
(3)如果在不同温度、浓度的条件下, 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,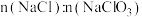 为
为___________ ,整个过程,参加反应所需 与氯气的物质的量之比为
与氯气的物质的量之比为___________ 。
若将 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:
(4) 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法___________ 。
A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
亚氯酸钠( )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。 在发生器中发生
在发生器中发生________ (氧化或还原)反应,该反应的还原产物为_________ ,吸收塔中温度不宜过高,否则会导致 产率下降,原因是
产率下降,原因是___________ 。
(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为___________ 。(保留两位小数)。
(1)次氯酸钠(
 )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是
 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是 ,转移电子的数目为
,转移电子的数目为(3)如果在不同温度、浓度的条件下,
 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,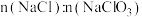 为
为 与氯气的物质的量之比为
与氯气的物质的量之比为若将
 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:(4)
 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
A. amol amol | B. amol amol | C. amol amol | D.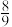 amol amol |
亚氯酸钠(
 )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。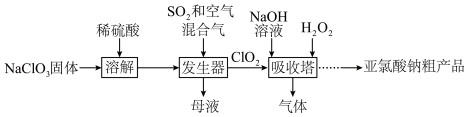
 在发生器中发生
在发生器中发生 产率下降,原因是
产率下降,原因是(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克
 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2024-02-02更新
|
0次组卷
|
2卷引用:山西省运城市景胜中学2023-2024学年高一下学期3月月考化学试题
解题方法
5 . 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂。
(1)K2FeO4可以去除水中的重金属,主要依靠其在水中分解后产生的Fe(OH)3胶体沉淀的吸附和共沉作用。可通过___________ 鉴别Fe(OH)3胶体和K2FeO4溶液。
(2)在碱性条件下,KClO饱和溶液可将Fe(NO3)3转化为K2FeO4,K2FeO4中Fe的化合价为___________ 价,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(3)K2FeO4可利用Na2FeO4制得。干法制备Na2FeO4的主要反应为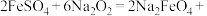
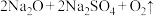 。该反应中氧化产物为
。该反应中氧化产物为___________ (填化学式),每生成1molO2,反应中转移的电子数为___________  。
。
(4)实验室需要使用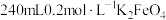 溶液。
溶液。
①配制K2FeO4溶液的过程中需要使用的玻璃仪器有烧杯、量筒、胶头滴管、___________ 和___________ 。
②用托盘天平称量___________ gK2FeO4固体。
③定容时,俯视刻度线将导致配得的溶液浓度___________ (填“偏低”“偏高”或“无影响”)。
(1)K2FeO4可以去除水中的重金属,主要依靠其在水中分解后产生的Fe(OH)3胶体沉淀的吸附和共沉作用。可通过
(2)在碱性条件下,KClO饱和溶液可将Fe(NO3)3转化为K2FeO4,K2FeO4中Fe的化合价为
(3)K2FeO4可利用Na2FeO4制得。干法制备Na2FeO4的主要反应为
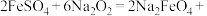
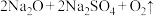 。该反应中氧化产物为
。该反应中氧化产物为 。
。(4)实验室需要使用
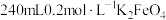 溶液。
溶液。①配制K2FeO4溶液的过程中需要使用的玻璃仪器有烧杯、量筒、胶头滴管、
②用托盘天平称量
③定容时,俯视刻度线将导致配得的溶液浓度
您最近一年使用:0次
解题方法
6 . 高铁酸钾(K2FeO4)是一种高效多功能的绿色消毒剂,某兴趣小组欲利用废铁屑(主要成分为Fe,还含有少量 和
和 )制取高铁酸钾,其工艺流程图如下。
)制取高铁酸钾,其工艺流程图如下。
(1)“滤渣”的主要成分为___________ 。
(2)“操作1”所需的玻璃仪器包括___________ 。
(3)写出 的电子式
的电子式___________ 。
(4)加入饱和 溶液时发生反应
溶液时发生反应 ,试解释该反应能发生的原因
,试解释该反应能发生的原因___________ 。
(5) 处理水时,不仅能杀菌消毒,还能形成
处理水时,不仅能杀菌消毒,还能形成___________ (填化学式)吸附水中悬浮杂质而净化水。
(6)高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体。试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式___________ 。
(7)若生成 的反应原理可表示为:
的反应原理可表示为: ,当反应中转移电子总数为
,当反应中转移电子总数为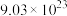 时,生成
时,生成 的物质的量为
的物质的量为___________  。
。
 和
和 )制取高铁酸钾,其工艺流程图如下。
)制取高铁酸钾,其工艺流程图如下。
(1)“滤渣”的主要成分为
(2)“操作1”所需的玻璃仪器包括
(3)写出
 的电子式
的电子式(4)加入饱和
 溶液时发生反应
溶液时发生反应 ,试解释该反应能发生的原因
,试解释该反应能发生的原因(5)
 处理水时,不仅能杀菌消毒,还能形成
处理水时,不仅能杀菌消毒,还能形成(6)高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体。试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式
(7)若生成
 的反应原理可表示为:
的反应原理可表示为: ,当反应中转移电子总数为
,当反应中转移电子总数为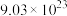 时,生成
时,生成 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
2024-01-06更新
|
107次组卷
|
2卷引用:山西运城盐湖五中2023-2024学年高三上学期期末考试化学试题
7 . Cu和 在工农业生产中用途广泛,用黄铜矿(主要成分为
在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取Cu和
,其中Cu为+2价、Fe为+2价)制取Cu和 的工艺流程如图所示:
的工艺流程如图所示:
(1)“高温焙烧”时发生的反应是 ,该反应的氧化产物是
,该反应的氧化产物是___________ (填化学式),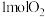 参加反应时,反应转移电子
参加反应时,反应转移电子___________ mol。
(2)向滤液A中通入 的目的是
的目的是___________ 。
(3)由滤渣“焙烧”得到 的化学方程式为
的化学方程式为___________ 。
(4)某同学想用酸性 溶液检验溶液B中是否还有
溶液检验溶液B中是否还有 ,你认为是否合适?
,你认为是否合适?___________ (填“是”或“否”),请简述理由:___________ 。
(5)流程中产生的 尾气可以与
尾气可以与 尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?
尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?___________ (填“是”或“否”),请简述理由:___________ 。
 在工农业生产中用途广泛,用黄铜矿(主要成分为
在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取Cu和
,其中Cu为+2价、Fe为+2价)制取Cu和 的工艺流程如图所示:
的工艺流程如图所示: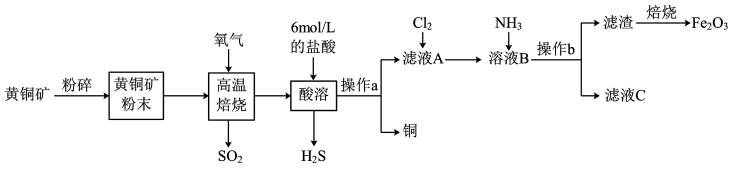

(1)“高温焙烧”时发生的反应是
 ,该反应的氧化产物是
,该反应的氧化产物是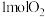 参加反应时,反应转移电子
参加反应时,反应转移电子(2)向滤液A中通入
 的目的是
的目的是(3)由滤渣“焙烧”得到
 的化学方程式为
的化学方程式为(4)某同学想用酸性
 溶液检验溶液B中是否还有
溶液检验溶液B中是否还有 ,你认为是否合适?
,你认为是否合适?(5)流程中产生的
 尾气可以与
尾气可以与 尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?
尾气反应得到单质硫,实现变废为宝。两尾气相互反应后,硫元素是否可以全部回收利用?
您最近一年使用:0次
2023-12-23更新
|
126次组卷
|
2卷引用:山西运城盐湖五中2023-2024学年高一上学期期末检测化学模拟试卷
名校
8 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,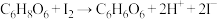 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中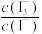 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到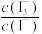 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,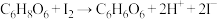 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
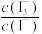 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到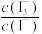 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
105次组卷
|
3卷引用:山西省朔州市怀仁市2023-2024学年高二上学期1月期末化学试题
名校
9 .  有高毒性,在溶液中以
有高毒性,在溶液中以 或
或 的形式存在,不同
的形式存在,不同 条件下两者可相互转化(
条件下两者可相互转化( )。常用还原法、微生物电化学法、沉淀法处理含
)。常用还原法、微生物电化学法、沉淀法处理含 的废水。
的废水。
(1)向废水中加入 或
或 等还原剂可将
等还原剂可将 还原为低毒性
还原为低毒性 ,再调节溶液
,再调节溶液 使
使 转化为
转化为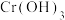 沉淀除去。
沉淀除去。
①酸性废水中 将
将 还原为
还原为 的离子方程式为
的离子方程式为___________ 。
②其他条件相同,在不改变所加铁屑总量的情况下,加入烟道灰(细小的活性炭),可增大 的去除率,其原因是
的去除率,其原因是___________ 。
(2)利用微生物电化学法可有效处理含有机物和 的酸性废水,其工作原理如图所示。
的酸性废水,其工作原理如图所示。
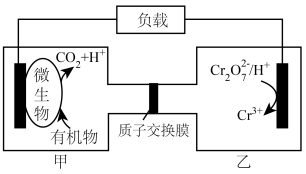
①若废水中的有机物是 ,则甲池中电极反应式为
,则甲池中电极反应式为___________ 。
②甲池产生 (标准状况)
(标准状况) 时,理论上乙池中
时,理论上乙池中 的物质的量减少
的物质的量减少___________ 。
(3)已知 易溶于水,
易溶于水,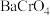 难溶于水。利用沉淀法有效去除酸性废水中
难溶于水。利用沉淀法有效去除酸性废水中 的实验操作为
的实验操作为___________ 。
 有高毒性,在溶液中以
有高毒性,在溶液中以 或
或 的形式存在,不同
的形式存在,不同 条件下两者可相互转化(
条件下两者可相互转化( )。常用还原法、微生物电化学法、沉淀法处理含
)。常用还原法、微生物电化学法、沉淀法处理含 的废水。
的废水。(1)向废水中加入
 或
或 等还原剂可将
等还原剂可将 还原为低毒性
还原为低毒性 ,再调节溶液
,再调节溶液 使
使 转化为
转化为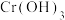 沉淀除去。
沉淀除去。①酸性废水中
 将
将 还原为
还原为 的离子方程式为
的离子方程式为②其他条件相同,在不改变所加铁屑总量的情况下,加入烟道灰(细小的活性炭),可增大
 的去除率,其原因是
的去除率,其原因是(2)利用微生物电化学法可有效处理含有机物和
 的酸性废水,其工作原理如图所示。
的酸性废水,其工作原理如图所示。
①若废水中的有机物是
 ,则甲池中电极反应式为
,则甲池中电极反应式为②甲池产生
 (标准状况)
(标准状况) 时,理论上乙池中
时,理论上乙池中 的物质的量减少
的物质的量减少(3)已知
 易溶于水,
易溶于水,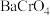 难溶于水。利用沉淀法有效去除酸性废水中
难溶于水。利用沉淀法有效去除酸性废水中 的实验操作为
的实验操作为
您最近一年使用:0次
2023-11-19更新
|
288次组卷
|
3卷引用:山西省晋城市第一中学校2023-2024学年高二上学期第五次调研考试化学试题
解题方法
10 . 已知A、B、C、D、E、F六种常见物质存在如图所示转化关系(部分生成物和反应条件略去)。

(1)若 均为氧化物:
均为氧化物:
①若 为单质,向
为单质,向 溶液中滴加
溶液中滴加 溶液,溶液显红色,
溶液,溶液显红色, 为
为___________ (填化学式);写出 的离子方程式:
的离子方程式:___________ 。
②若 是含钠正盐,其水溶液呈碱性,
是含钠正盐,其水溶液呈碱性, 是一种温室气体,写出
是一种温室气体,写出 的一条用途:
的一条用途:___________ ; 的水溶液呈碱性的原因为
的水溶液呈碱性的原因为___________ (用离子方程式表示)。
(2)若 为固体氧化物,
为固体氧化物, 为气体单质,
为气体单质, 进行焰色试验时,火焰呈黄色,写出化合物
进行焰色试验时,火焰呈黄色,写出化合物 的电子式:
的电子式:___________ ;每生成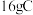 ,转移的电子的物质的量为
,转移的电子的物质的量为___________  。
。
(3)若 为
为 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:___________ 。

(1)若
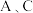 均为氧化物:
均为氧化物:①若
 为单质,向
为单质,向 溶液中滴加
溶液中滴加 溶液,溶液显红色,
溶液,溶液显红色, 为
为 的离子方程式:
的离子方程式:②若
 是含钠正盐,其水溶液呈碱性,
是含钠正盐,其水溶液呈碱性, 是一种温室气体,写出
是一种温室气体,写出 的一条用途:
的一条用途: 的水溶液呈碱性的原因为
的水溶液呈碱性的原因为(2)若
 为固体氧化物,
为固体氧化物, 为气体单质,
为气体单质, 进行焰色试验时,火焰呈黄色,写出化合物
进行焰色试验时,火焰呈黄色,写出化合物 的电子式:
的电子式: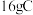 ,转移的电子的物质的量为
,转移的电子的物质的量为 。
。(3)若
 为
为 ,写出
,写出 与
与 反应的化学方程式:
反应的化学方程式:
您最近一年使用:0次



