1 . 黑木耳富含蛋白质、铁、具有还原性的维生素C等,每100 g黑木耳含铁量高达185 mg。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。____________ 。
(2)步骤④检验Fe3+所用试剂是_____________ (填化学式)溶液。
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的阳离子 的离子符号为____________ 。
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。_______ (填序号)。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为_______________ 。
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是_______________ 。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。
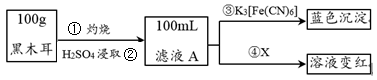
(2)步骤④检验Fe3+所用试剂是
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是
您最近一年使用:0次
名校
2 . Cr2O 毒性较强,常用NaHSO3处理工业废水中的Cr2O
毒性较强,常用NaHSO3处理工业废水中的Cr2O ,反应的离子方程式为:H+ +Cr2O
,反应的离子方程式为:H+ +Cr2O +HSO
+HSO
 Cr3++SO
Cr3++SO +H2O(未配平),下列关于该反应的说法正确的是
+H2O(未配平),下列关于该反应的说法正确的是
 毒性较强,常用NaHSO3处理工业废水中的Cr2O
毒性较强,常用NaHSO3处理工业废水中的Cr2O ,反应的离子方程式为:H+ +Cr2O
,反应的离子方程式为:H+ +Cr2O +HSO
+HSO
 Cr3++SO
Cr3++SO +H2O(未配平),下列关于该反应的说法正确的是
+H2O(未配平),下列关于该反应的说法正确的是| A.氧化剂和还原剂的计量数之比为3:1 | B.Cr3+是氧化反应的产物 |
C. 发生还原反应 发生还原反应 | D.消耗5 molH+时转移6mol电子 |
您最近一年使用:0次
解题方法
3 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是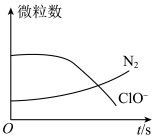
| A.该反应中Cl-为氧化产物 | B.消耗1mol还原剂微粒,转移6mol电子 |
C. 被ClO-氧化成N2 被ClO-氧化成N2 | D.该反应为非氧化还原反应 |
您最近一年使用:0次
4 . 改善大气质量、进行污水处理和将垃圾资源化等要靠化学等科学的发展。
(1)为了保护环境,防治酸雨的方法是减少________ 的排放(填“ ”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用
”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用________ 。(填“ ”或“氟氯代烷”)
”或“氟氯代烷”)
(2)垃圾是放错地方的资源。下列垃圾处理方式正确的是________ (填字母代号)。
a.回收利用易拉罐 b.焚烧废旧报纸 c.随意丢弃废旧电池
我国“十四五”规划中已明确提到“碳达峰”、“碳中和”的目标,请回答下列问题:
(3)写出碳元素的两种同素异形体名称________ 。(任写两种)
(4)“碳达峰”、“碳中和”的“碳”主要指的具体物质是________ ,其所属物质类别为________ 。(填写下列正确的选项代号)
A.电解质 B.非电解质 C.酸性氧化物
(5)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程为:________ ,该反应中还原剂是________ 。
(6)某化学兴趣小组同学将燃烧的镁条插入盛满 的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为
的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为 ,试用双线桥分析该反应电子的得失及数目:
,试用双线桥分析该反应电子的得失及数目:________ 。
(1)为了保护环境,防治酸雨的方法是减少
 ”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用
”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用 ”或“氟氯代烷”)
”或“氟氯代烷”)(2)垃圾是放错地方的资源。下列垃圾处理方式正确的是
a.回收利用易拉罐 b.焚烧废旧报纸 c.随意丢弃废旧电池
我国“十四五”规划中已明确提到“碳达峰”、“碳中和”的目标,请回答下列问题:

(3)写出碳元素的两种同素异形体名称
(4)“碳达峰”、“碳中和”的“碳”主要指的具体物质是
A.电解质 B.非电解质 C.酸性氧化物
(5)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程为:
(6)某化学兴趣小组同学将燃烧的镁条插入盛满
 的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为
的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为 ,试用双线桥分析该反应电子的得失及数目:
,试用双线桥分析该反应电子的得失及数目:
您最近一年使用:0次
解题方法
5 . 按要求写出或完成下列方程式。(共15分)
(1)HNO3的电离方程式:___________ 。
(2)Na2CO3的电离方程式:___________ 。
(3)Zn与HCl反应的离子方程式:___________ 。
(4)HCl和NaOH反应的离子方程式:___________ 。
(5)将下列方程式配平:___________ 。
_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑
(1)HNO3的电离方程式:
(2)Na2CO3的电离方程式:
(3)Zn与HCl反应的离子方程式:
(4)HCl和NaOH反应的离子方程式:
(5)将下列方程式配平:
_______KMnO4+_______HCl(浓) _______KCl+_______MnCl2+_______H2O+_______Cl2↑
您最近一年使用:0次
解题方法
6 . 钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
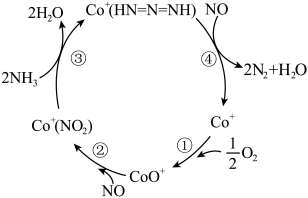
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
7 . 工业上用铝土矿(主要成份是 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
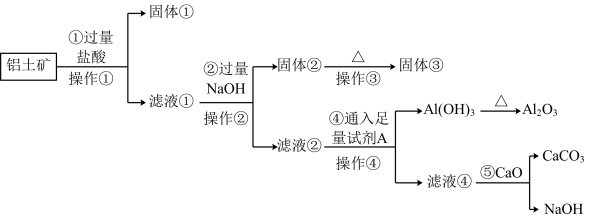
请回答下列问题:
(1)操作①的名称是_______ ,操作③用到的仪器有酒精灯、三脚架、泥三角、_______ 。
(2)写出加入过量 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:________ 。
(3)流程中的 最好选用
最好选用________ ,发生反应的离子方程式为________ 。
(4)写出反应⑤的化学反应方程式______ ,上述流程中可以循环利用的物质为____ (填化学式)。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为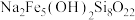 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为______ 。将 该矿石用足量
该矿石用足量______ (填盐酸或硫酸)溶解后,加入过量铜粉使溶液中的铁元素全部变为 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
请回答下列问题:
(1)操作①的名称是
(2)写出加入过量
 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:(3)流程中的
 最好选用
最好选用(4)写出反应⑤的化学反应方程式
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为
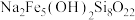 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为 该矿石用足量
该矿石用足量 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-03-03更新
|
212次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
8 . 发蓝工艺是一种材料保护技术,钢铁零件的发蓝处理实质是使钢铁表面通过氧化反应,生成有一定厚度、均匀、致密、附着力强、耐腐蚀性能好的深蓝色氧化膜。钢铁零件经历如图转化进行发蓝处理,已知 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是
 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是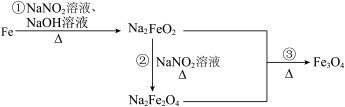
A.钢铁零件发蓝处理所得的深蓝色氧化膜是 |
| B.反应①中氧化剂和还原剂的物质的量之比为3∶1 |
C.反应②的离子方程式为 |
| D.反应③属于氧化还原反应 |
您最近一年使用:0次
名校
9 . 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊 法制备亚氯酸钠的流程如图:
法制备亚氯酸钠的流程如图: ,该反应的还原产物是
,该反应的还原产物是___________ (写化学式)。
(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法分析此化学反应。___________
________ClO2+ ________H2O2+ ________OH-=________ +________H2O+ _______□
+________H2O+ _______□
(3)NaClO2中Cl的化合价为___________ ,H2O2在反应②中___________ (填字母)。
A.只能作氧化剂 B.只能作还原剂 C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊 法制备NaClO2的实验装置如图甲所示:
法制备NaClO2的实验装置如图甲所示:
②当温度低于38℃时,NaClO2饱和溶液中析出的晶体是NaClO2∙3H2O;当温度在 38~60℃时,析出NaClO2;温度高于 60℃时,NaClO2分解。
C中将装置浸入冰水浴中的目的是___________ 。
 法制备亚氯酸钠的流程如图:
法制备亚氯酸钠的流程如图: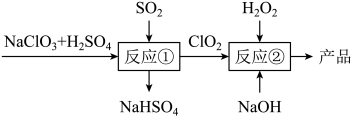
 ,该反应的还原产物是
,该反应的还原产物是(2)在□补充反应②另一种产物,并配平此离子方程式,然后用单线桥法分析此化学反应。
________ClO2+ ________H2O2+ ________OH-=________
 +________H2O+ _______□
+________H2O+ _______□(3)NaClO2中Cl的化合价为
A.只能作氧化剂 B.只能作还原剂 C.既能作氧化剂也能作还原剂
(4)实验室采用马蒂逊
 法制备NaClO2的实验装置如图甲所示:
法制备NaClO2的实验装置如图甲所示:
②当温度低于38℃时,NaClO2饱和溶液中析出的晶体是NaClO2∙3H2O;当温度在 38~60℃时,析出NaClO2;温度高于 60℃时,NaClO2分解。
C中将装置浸入冰水浴中的目的是
您最近一年使用:0次
2024-02-24更新
|
173次组卷
|
2卷引用:湖南省衡阳市衡阳县第五中学2023-2024学年高一下学期第一次月考化学试题
名校
10 . I.铝土矿是工业上制备金属铝的主要原料,其主要成分是 ,同时还含有
,同时还含有 、
、 。工业上可使用碱浸法提取铝土矿中的
。工业上可使用碱浸法提取铝土矿中的 ,其工业流程如图所示。根据图示信息,请回答下列问题:
,其工业流程如图所示。根据图示信息,请回答下列问题:_______ ,滤渣B的主要成分是_______ (填化学式)。
(2)实验室中进行煅烧时最适合用来盛放 固体的实验仪器名称是
固体的实验仪器名称是_______ 。
(3)用 与C、
与C、 在高温条件下反应可制取
在高温条件下反应可制取 ,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是
,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是_______ 。
Ⅱ.高铁酸钾( )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程: 的部分性质如下:
的部分性质如下:
(4)写出①中发生的离子方程式:_______ 。
(5)②中加入NaOH固体的目的是_______ (填字母序号)
A.加入NaOH固体做氧化剂
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成
(6)完成④中反应的离子方程式:_______ 。
(7)⑥中洗涤时,洗涤剂最好选用_______(填字母序号)。
(8)现取洗涤并干燥后 样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
 ,同时还含有
,同时还含有 、
、 。工业上可使用碱浸法提取铝土矿中的
。工业上可使用碱浸法提取铝土矿中的 ,其工业流程如图所示。根据图示信息,请回答下列问题:
,其工业流程如图所示。根据图示信息,请回答下列问题: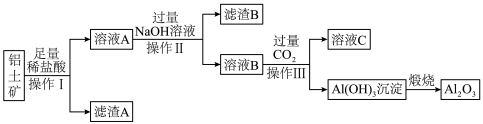
(2)实验室中进行煅烧时最适合用来盛放
 固体的实验仪器名称是
固体的实验仪器名称是(3)用
 与C、
与C、 在高温条件下反应可制取
在高温条件下反应可制取 ,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是
,每消耗0.5mol碳单质,转移1mol电子,反应的化学方程式是Ⅱ.高铁酸钾(
 )具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程:
)具有极强的氧化性和优良的絮凝功能,是一种绿色环保多功能型水处理剂。下图是生产高铁酸钾的一种工艺流程: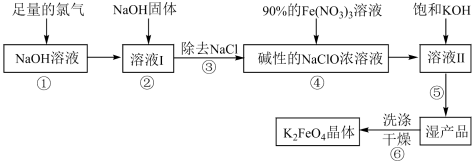
 的部分性质如下:
的部分性质如下:溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中Fe变为+3价并放出 |
(4)写出①中发生的离子方程式:
(5)②中加入NaOH固体的目的是
A.加入NaOH固体做氧化剂
B.为后续反应提供碱性环境
C.NaOH固体溶解时会放出较多的热量,有利于后续生成

(6)完成④中反应的离子方程式:
(7)⑥中洗涤时,洗涤剂最好选用_______(填字母序号)。
A. | B.KOH溶液 | C.异丙醇 | D. 溶液 溶液 |
(8)现取洗涤并干燥后
 样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
2024-02-20更新
|
196次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高一下学期选科适应性检测化学试卷



