名校
1 . 2023年10月26日11时14分,神舟十七号载人飞船在酒泉卫星发射中心点火发射。飞船返回地球时,为了减弱返回舱着陆的速度,反推发动机的燃料是高氯酸铵 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
(1)二氧化氯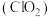 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。
①Cl和O分别形成简单氢化物的稳定性比较_______ >_______
②在酸性条件下,由 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为_______ ;该反应中还原剂与氧化剂的物质的量之比为_______ 。
(2)高氯酸铵中铵根离子的电子式为_______ ;高氯酸铵和铝粉中的元素所形成的简单离子中,核外电子数相同、半径由小到大的顺序是_______ (用离子符号表示)。
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是_______ 。
(4)高氯酸铵和铝粉反应除了生成 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式_______ 。
 和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:
和铝粉混合物。请回答与高氮酸铵和铝粉相关元素的问题:(1)二氧化氯
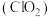 和过氧化氢均有强氧化性。
和过氧化氢均有强氧化性。①Cl和O分别形成简单氢化物的稳定性比较
②在酸性条件下,由
 和双氧水反应制备
和双氧水反应制备 ,其反应的离子方程式为
,其反应的离子方程式为(2)高氯酸铵中铵根离子的电子式为
(3)氮元素的非金属性较强,N2分子的性质比较稳定,其原因是
(4)高氯酸铵和铝粉反应除了生成
 和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
和N2外,还有另外两种不含氮元素的物质生成,请写出其化学方程式
您最近一年使用:0次
名校
2 . 硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为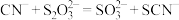 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
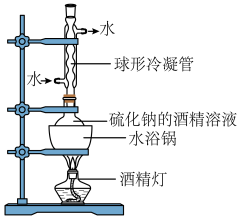
图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是___________ 。
(3)利用图2装置制备 。
。
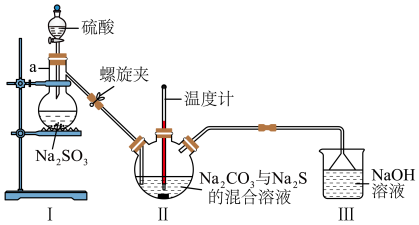
图2
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置 Ⅲ 的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用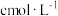 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为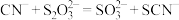 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是
(3)利用图2装置制备
 。
。
图2
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置 Ⅲ 的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用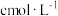 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-02-13更新
|
95次组卷
|
2卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
名校
解题方法
3 . 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)为提高酸浸速率,可采用的措施是__________ 。
(2)煅烧时,Cr2O3发生反应的化学方程式为______ 。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________ (写化学式)。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。已知含铬酸性废水中存在着CrO 和Cr2O
和Cr2O 相互转化的平衡,请用离子方程式表示它们之间的转化反应
相互转化的平衡,请用离子方程式表示它们之间的转化反应________ 。
(5)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。
①氧化还原滴定过程中的离子方程式为_______ 。
②滴定到达终点的现象是________ 。
③若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为_______ %。[已知M(Na2Cr2O7)=262g·mol-1,计算结果保留三位有效数字]

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)为提高酸浸速率,可采用的措施是
(2)煅烧时,Cr2O3发生反应的化学方程式为
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。已知含铬酸性废水中存在着CrO
 和Cr2O
和Cr2O 相互转化的平衡,请用离子方程式表示它们之间的转化反应
相互转化的平衡,请用离子方程式表示它们之间的转化反应(5)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。
①氧化还原滴定过程中的离子方程式为
②滴定到达终点的现象是
③若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中Na2Cr2O7的纯度为
您最近一年使用:0次
名校
解题方法
4 . 如图是硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图:

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是___________ 。
(2)酸浸、过滤后滤液A中的金属阳离子是___________ 。
(3)煅烧FeCO3生成产品I的化学方程式为___________ 。
(4)产品Ⅱ的化学式为___________ 。
(5)写出步骤Ⅳ反应的离子方程式___________ 。

请回答下列问题:
(1)酸浸时,将硫铁矿烧渣粉碎的原因是
(2)酸浸、过滤后滤液A中的金属阳离子是
(3)煅烧FeCO3生成产品I的化学方程式为
(4)产品Ⅱ的化学式为
(5)写出步骤Ⅳ反应的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 用硝酸氧化蔗糖水解的产物可以制备草酸。实验过程如下:

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
请回答下列问题:
(1)实验①加入少许硫酸的目的是___________ 。
(2)冷凝水进水方向是___________ 口(填“a”或“b”)。
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 ___________ 和 ___________ 的洗气瓶。
(4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 ___________ 。滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为 ___________ 。

①将蔗糖溶液与少许硫酸混合水浴加热;
②控制反应温度,边搅拌边缓慢滴加混酸(65% HNO3、98% H2SO4的混合溶液),装置如图1所示(加热、搅拌和仪器固定装置均已略去);
硝酸氧化蔗糖水解液过程中发生反应:C6H12O6+12HNO3
 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O请回答下列问题:
(1)实验①加入少许硫酸的目的是
(2)冷凝水进水方向是
(3)利用草酸晶体分解制备CO的原理为H2C2O4•xH2O
 CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有
CO↑+CO2↑+(x+1)H2O,欲获得纯净干燥的CO气体,应将分解气依次通过盛有 (4)将产品在90℃以下的恒温箱内烘干至恒重,得到二水合草酸。用酸性KMnO4标准溶液滴定,反应的离子方程式为2MnO
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。称取该样品0.12g,加适量水完全溶解,然后用0.020mol/L的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为
您最近一年使用:0次
6 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)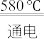 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.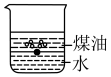 | B.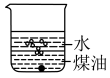 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
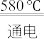 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近一年使用:0次
名校
解题方法
7 . 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)为原料制备还原性物质CuCl。下列说法不正确的是
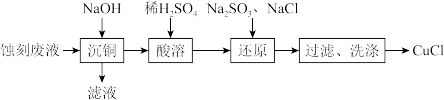

| A.“沉铜”得到的沉淀主要为Cu(OH)2 |
B.“还原”时离子方程式为SO +Cu2++Cl-+H2O=CuCl↓+SO +Cu2++Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行 |
| D.可循环利用的物质为H2SO4 |
您最近一年使用:0次
2023-11-07更新
|
654次组卷
|
5卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
8 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。

(1)Na2Cr2O7中Cr元素的化合价是___________ ,在上述转化中,Cr元素化合价不变的步骤是___________ (填序号)。
(2)下列物质中能实现反应①转化的是___________ 。(填字母)
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生___________ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:___________ 。
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:___________ 。
(4)反应④在碱性条件下发生,反应的离子方程式为: ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式___________ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)下列物质中能实现反应①转化的是
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:
(4)反应④在碱性条件下发生,反应的离子方程式为:
 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
9 . 储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:C+K2Cr2O7+H2SO4→CO2↑+K2SO4+Cr2(SO4)3+H2O(未配平)。回答下列问题。
(1)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(2)该反应中,K2Cr2O7表现出___________ (选填“氧化性”或“还原性”),K2Cr2O7发生了___________ (选填“氧化反应”或“还原反应”)。
(3)H2SO4在该反应中表现出___________(填字母)。
(4)配平上述方程式:________ 。每生成2分子H2O,该反应转移_________ 个电子。
(1)该反应中,还原剂是
(2)该反应中,K2Cr2O7表现出
(3)H2SO4在该反应中表现出___________(填字母)。
| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
您最近一年使用:0次
名校
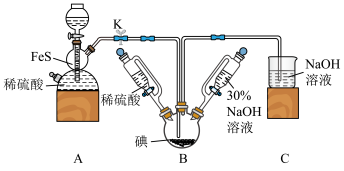
10 . 碘化钠可用于医学和摄影。实验室制备NaI的基本实验步骤为:①检查装置气密性;②关闭K,向B中滴入30%NaOH溶液3;③打开K,通入H2S至饱和制得NaI,同时有黄色沉淀产生;④关闭K,水浴加热,充分逸出H2S;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸
回答下列问题:
(1)A装置中的仪器名称为_______ ,利用此装置还可以制取 _______ (任写一种合理即可)。
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是_______ 。
(3)A装置中发生反应的化学方程式为_______ 。
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为_______ 。
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、_______ 等操作。
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为_______ 。

回答下列问题:
(1)A装置中的仪器名称为
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是
(3)A装置中发生反应的化学方程式为
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为
您最近一年使用:0次



