名校
解题方法
1 . 回答下列问题:
(1)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
①NaClO2中Cl的化合价为_______ 。
②写出步骤一中生成ClO2的化学方程式_______ 。
③步骤二反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中氧化产物是_______ 。
(2)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
脱硫过程中SO2主要转化为________ (填离子符号);脱硝过程NO主要转化为_______ (填离子符号),脱硝过程主要反应的离子方程式为_______ 。
(3)NaClO2可以促使氨转化为氮肥,含氮量是衡量肥效的指标之一,常见氮肥:CO(NH2)2(尿素)、NH4NO3和(NH4)2SO4。等物质的量NH4NO3和(NH4)2SO4的混合物,与足量氢氧化钠加热,产生气体10.08L(标准状况下),固体混合物质量为_______ g。
(1)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
①NaClO2中Cl的化合价为
②写出步骤一中生成ClO2的化学方程式
③步骤二反应中,氧化剂与还原剂的物质的量之比为
(2)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
| 离子 | SO | SO | NO | NO | Cl- |
| c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-6 | 3.4×10-3 |
(3)NaClO2可以促使氨转化为氮肥,含氮量是衡量肥效的指标之一,常见氮肥:CO(NH2)2(尿素)、NH4NO3和(NH4)2SO4。等物质的量NH4NO3和(NH4)2SO4的混合物,与足量氢氧化钠加热,产生气体10.08L(标准状况下),固体混合物质量为
您最近一年使用:0次
名校
解题方法
2 . 配平下列方程式或完成下列问题
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO +______H2O。
+______H2O。________ 。
(2)______FeS2+______O2 ______Fe2O3+______SO2。
______Fe2O3+______SO2。________ 。
(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。________ 。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。________ 。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______ =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。________ 。
(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____________ 。
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:___________________________ 。
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为___________ 。
(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:
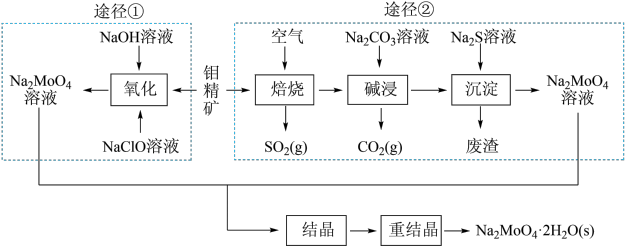
回答下列问题:
途径①制备钼酸钠溶液,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________ 。
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO
 +______H2O。
+______H2O。(2)______FeS2+______O2
 ______Fe2O3+______SO2。
______Fe2O3+______SO2。(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______
 =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
途径①制备钼酸钠溶液,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
名校
3 . 可利用如图所示的工艺流程减少 的排放,下列说法错误的是
的排放,下列说法错误的是
 的排放,下列说法错误的是
的排放,下列说法错误的是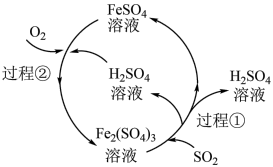
| A.在上述流程中共有三种元素的化合价发生了变化 |
| B.每处理1mol SO2,需要消耗标准状况下22.4L O2 |
| C.在上述流程中Fe2(SO4)3相当于催化剂,无需额外补充 |
D.过程①的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO +4H+ +4H+ |
您最近一年使用:0次
2023-08-24更新
|
204次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
名校
4 . 运动会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为KClO3+P=P2O5+KCl(未配平)。下列有关该反应的叙述中,正确的是
| A.氯酸钾被氧化 |
| B.反应中每生成1个P2O5时,就转移5个电子 |
| C.单质P被还原,发生还原反应 |
| D.配平后反应的化学方程式为5KClO3+6P=3P2O5+5KCl |
您最近一年使用:0次
2023-08-17更新
|
884次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高一9月月考化学试题
2023·全国·模拟预测
名校
解题方法
5 . 一种利用微生物从黄铜矿(主要成分为 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是

 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是
A.转化过程中 和 和 可以循环使用 可以循环使用 |
B.微生物的作用下, 作催化剂 作催化剂 |
C.若 中的铜元素最终全部转化为 中的铜元素最终全部转化为 ,当有2mol ,当有2mol 生成时,理论上消耗4.25mol 生成时,理论上消耗4.25mol |
D.在硫酸介质中用 替代 替代 也能高效实现将 也能高效实现将 氧化为 氧化为 |
您最近一年使用:0次
2023-04-11更新
|
392次组卷
|
5卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题
宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题(已下线)化学押题卷(二)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)选择题6-10内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷
名校
6 . 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂。其溶于水与水结合放出氧气并有絮状沉淀产生,常用作净水剂。其生产工艺如下:
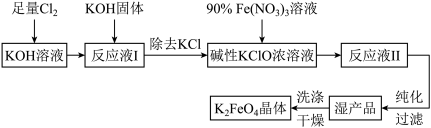
回答下列问题:
(1)写出Cl2与KOH溶液反应的化学方程式___________ 。
(2)在“反应液I”中加入KOH固体的目的是___________ 。
(3)写出Fe(NO3)3溶液与碱性KClO溶液反应的离子方程式___________ 。
(4)K2FeO4可作为新型多功能水处理剂的原因是___________ 。
(5)从“反应液II”中分离出K2FeO4后,副产品有___________ (写化学式)。实验室模拟工业流程中“过滤”操作用到的主要玻璃仪器有___________ 。
(6)该工艺每得到1.98kg K2FeO4,理论上消耗Cl2的物质的量为___________ mol。

回答下列问题:
(1)写出Cl2与KOH溶液反应的化学方程式
(2)在“反应液I”中加入KOH固体的目的是
(3)写出Fe(NO3)3溶液与碱性KClO溶液反应的离子方程式
(4)K2FeO4可作为新型多功能水处理剂的原因是
(5)从“反应液II”中分离出K2FeO4后,副产品有
(6)该工艺每得到1.98kg K2FeO4,理论上消耗Cl2的物质的量为
您最近一年使用:0次
2023-04-06更新
|
241次组卷
|
3卷引用:宁夏吴忠中学2022-2023学年高一下学期学业水平模拟考试(三)化学(B)试题
名校
解题方法
7 . 研究小组以 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂
(1)无水 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。

①仪器a的名称为________ 。
②本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、________ 。
③反应管的温度升到660℃时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为________ 。 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是________ (填化学式)。
④反应管右端有15cm在加热炉外,其作用是________________ 。
(2) 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)

将制备的无水 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为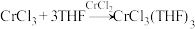 。
。
实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。
①锌粉的作用是________________ (用化学方程式表示)。
② 和
和 在THF的溶解性分别为
在THF的溶解性分别为________ 、________ (填“溶”或“不溶”)。
③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为________ %。[已知: 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
 (绿色固体)、
(绿色固体)、 、THF(四氯呋喃,液体)等物质为原料制备固体配合物
、THF(四氯呋喃,液体)等物质为原料制备固体配合物 ,该配合物可作为有机反应的催化剂
,该配合物可作为有机反应的催化剂(1)无水
 (紫色固体,易升华)的制备装置如图所示(夹持装置略)。
(紫色固体,易升华)的制备装置如图所示(夹持装置略)。
①仪器a的名称为
②本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、③反应管的温度升到660℃时发生反应,生成
 和
和 (光气),其化学方程式为
(光气),其化学方程式为 有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是
有剧毒,与水反应生成两种酸性气体,b装置中生成的盐是④反应管右端有15cm在加热炉外,其作用是
(2)
 的合成装置如图所示(搅拌和夹持装置咯)
的合成装置如图所示(搅拌和夹持装置咯)
将制备的无水
 和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为
和极少量锌粉放入滤纸套筒内,双颈烧瓶中加入足量无水THF。制备反应的原理为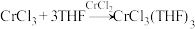 。
。实验时烧瓶中THF受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与滤纸套筒内的物质接触。当液面达到虹吸管3顶端时,经虹吸管3返回双颈烧瓶.从而实现了THF与
 的连续反应及产物的连续萃取。
的连续反应及产物的连续萃取。①锌粉的作用是
②
 和
和 在THF的溶解性分别为
在THF的溶解性分别为③合成反应完成后,取下双颈烧瓶,蒸发THF得到固体产品6.7410g。则该实验的产率为
 的摩尔质量为152g/mol;
的摩尔质量为152g/mol; 的摩尔质量为374.5g/mol]
的摩尔质量为374.5g/mol]
您最近一年使用:0次
2023-03-14更新
|
700次组卷
|
4卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第五次月考理科综合试题
8 . 短周期主族元素W,X,Y,Z,M,Q的原子序数依次增大,在元素周期表中W的原子半径最小(稀有气体元素除外),X与Y相邻且Y的最外层电子数是次外层的3倍,Y,Z的最外层电子数之和与Q的最外层电子数相等,M是地壳中含量最多的金属元素。回答下列问题:
(1)X在元素周期表中的位置是_______ ;Q的元素符号是_______ 。
(2)M的离子结构示意图是_______ ;由W,Y,Z三种元素组成的既含离子键又含共价键的化合物的电子式是_______ 。
(3)简单氢化物的热稳定性:X_______ (填“小于”或“大于”)Y。
(4)X、Y、Z的简单离子的半径由小到大的顺序为_______ (用离子符号表示)。
(5)M单质与Z的最高价氧化物对应的水化物反应的化学方程式是_______ 。
(6)W和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是_______ (填化学式),此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为_______ 。
(1)X在元素周期表中的位置是
(2)M的离子结构示意图是
(3)简单氢化物的热稳定性:X
(4)X、Y、Z的简单离子的半径由小到大的顺序为
(5)M单质与Z的最高价氧化物对应的水化物反应的化学方程式是
(6)W和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为
您最近一年使用:0次
2023-02-09更新
|
122次组卷
|
2卷引用:宁夏银川市贺兰县景博中学2022-2023学年高一下学期第一次质量检测化学试题
9 . 在特定碱性条件下,过量 可将Cr(Ⅲ)完全氧化成Cr(Ⅵ),其反应为
可将Cr(Ⅲ)完全氧化成Cr(Ⅵ),其反应为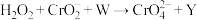 (未配平),下列有关说法错误的是
(未配平),下列有关说法错误的是
 可将Cr(Ⅲ)完全氧化成Cr(Ⅵ),其反应为
可将Cr(Ⅲ)完全氧化成Cr(Ⅵ),其反应为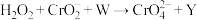 (未配平),下列有关说法错误的是
(未配平),下列有关说法错误的是A.W是 |
| B.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
C.  参加反应时,转移电子的物质的量为 参加反应时,转移电子的物质的量为 |
D.在酸性条件下 可以转化为 可以转化为 |
您最近一年使用:0次
2023-01-14更新
|
103次组卷
|
2卷引用:宁夏六盘山高级中学2022-2023学年高三上学期期末考试化学试题
名校
10 . 填空题
(1)现有以下物质:①Al2(SO4)3晶体,②稀盐酸 ,③冰醋酸(固态纯醋酸) ,④石墨, ⑤酒精(C2H5OH),⑥食盐水,⑦葡萄糖(C6H12O6),请回答下列问题:
Ⅰ.以上物质中属于电解质的是_______ (填序号,下同)。
Ⅱ.以上物质中属于非电解质的是_______ 。
Ⅲ.请写出①在水溶液中的电离方程式_______ 。
(2)配平化学方程式:_______ 。_______Cu + _______HNO3(稀)  _______Cu(NO3)2 + _______NO↑+_______H2O
_______Cu(NO3)2 + _______NO↑+_______H2O
(3)新生成的氢氧化亚铁在空气中会迅速变为灰绿色、最后变为红褐色,其过程中涉及到的化学方程式为:_______ 。
(1)现有以下物质:①Al2(SO4)3晶体,②稀盐酸 ,③冰醋酸(固态纯醋酸) ,④石墨, ⑤酒精(C2H5OH),⑥食盐水,⑦葡萄糖(C6H12O6),请回答下列问题:
Ⅰ.以上物质中属于电解质的是
Ⅱ.以上物质中属于非电解质的是
Ⅲ.请写出①在水溶液中的电离方程式
(2)配平化学方程式:
 _______Cu(NO3)2 + _______NO↑+_______H2O
_______Cu(NO3)2 + _______NO↑+_______H2O(3)新生成的氢氧化亚铁在空气中会迅速变为灰绿色、最后变为红褐色,其过程中涉及到的化学方程式为:
您最近一年使用:0次
2022-12-11更新
|
167次组卷
|
3卷引用:宁夏银川市第三十一中学2021-2022学年高一上学期期末学业检测化学试题



