1 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)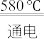 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.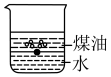 | B.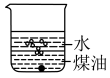 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
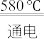 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近一年使用:0次
名校
解题方法
2 . 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)为原料制备还原性物质CuCl。下列说法不正确的是
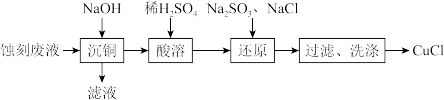

| A.“沉铜”得到的沉淀主要为Cu(OH)2 |
B.“还原”时离子方程式为SO +Cu2++Cl-+H2O=CuCl↓+SO +Cu2++Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行 |
| D.可循环利用的物质为H2SO4 |
您最近一年使用:0次
2023-11-07更新
|
677次组卷
|
5卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
3 . 请回答:
(1)Na2O2的电子式___________ 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________ 。
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______
① 请配平上述化学方程式。___________
② 浓盐酸在反应中显示出来的性质是___________
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为___________ 。
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的___________ 倍。
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(1)Na2O2的电子式
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______

① 请配平上述化学方程式。
② 浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
名校
4 . 碘化钠可用于医学和摄影。实验室制备NaI的基本实验步骤为:①检查装置气密性;②关闭K,向B中滴入30%NaOH溶液3;③打开K,通入H2S至饱和制得NaI,同时有黄色沉淀产生;④关闭K,水浴加热,充分逸出H2S;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸
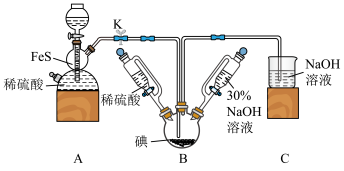
回答下列问题:
(1)A装置中的仪器名称为_______ ,利用此装置还可以制取 _______ (任写一种合理即可)。
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是_______ 。
(3)A装置中发生反应的化学方程式为_______ 。
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为_______ 。
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、_______ 等操作。
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为_______ 。

回答下列问题:
(1)A装置中的仪器名称为
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是
(3)A装置中发生反应的化学方程式为
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为
您最近一年使用:0次
名校
5 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
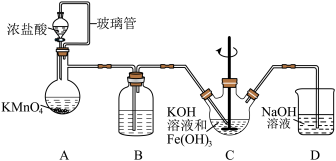
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
583次组卷
|
3卷引用:宁夏石嘴山市平罗中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
6 . 回答下列问题:
(1)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
①NaClO2中Cl的化合价为_______ 。
②写出步骤一中生成ClO2的化学方程式_______ 。
③步骤二反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中氧化产物是_______ 。
(2)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
脱硫过程中SO2主要转化为________ (填离子符号);脱硝过程NO主要转化为_______ (填离子符号),脱硝过程主要反应的离子方程式为_______ 。
(3)NaClO2可以促使氨转化为氮肥,含氮量是衡量肥效的指标之一,常见氮肥:CO(NH2)2(尿素)、NH4NO3和(NH4)2SO4。等物质的量NH4NO3和(NH4)2SO4的混合物,与足量氢氧化钠加热,产生气体10.08L(标准状况下),固体混合物质量为_______ g。
(1)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
步骤一:利用NaClO3在硫酸作用下与SO2反应生成ClO2和一种酸式盐
步骤二:将ClO2在NaOH溶液中与H2O2反应即可生成NaClO2
①NaClO2中Cl的化合价为
②写出步骤一中生成ClO2的化学方程式
③步骤二反应中,氧化剂与还原剂的物质的量之比为
(2)NaClO2溶液可同时吸收含有SO2、NO的烟气。反应温度为323K,NaClO2溶液浓度为5×10-3mol/L。在碱性环境中,反应一段时间后溶液中离子浓度的分析结果如表。
| 离子 | SO | SO | NO | NO | Cl- |
| c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-6 | 3.4×10-3 |
(3)NaClO2可以促使氨转化为氮肥,含氮量是衡量肥效的指标之一,常见氮肥:CO(NH2)2(尿素)、NH4NO3和(NH4)2SO4。等物质的量NH4NO3和(NH4)2SO4的混合物,与足量氢氧化钠加热,产生气体10.08L(标准状况下),固体混合物质量为
您最近一年使用:0次
名校
解题方法
7 . 配平下列方程式或完成下列问题
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO +______H2O。
+______H2O。________ 。
(2)______FeS2+______O2 ______Fe2O3+______SO2。
______Fe2O3+______SO2。________ 。
(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。________ 。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。________ 。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______ =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。________ 。
(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____________ 。
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:___________________________ 。
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为___________ 。
(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:
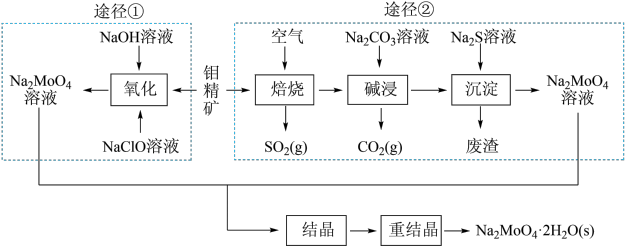
回答下列问题:
途径①制备钼酸钠溶液,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________ 。
(1)______ClO-+______Fe(OH)3+_______OH-=______Cl-+______FeO
 +______H2O。
+______H2O。(2)______FeS2+______O2
 ______Fe2O3+______SO2。
______Fe2O3+______SO2。(3)____KI+____KIO3+____H2SO4=____I2+____K2SO4+____H2O。
(4)____S+____KOH=____K2S+____K2SO3+____H2O。
(5)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
KOCN+______Cl2+______
 =______K2CO3+______N2+______KCl+______
=______K2CO3+______N2+______KCl+______ 。
。(6)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(7)黑火药的成分是硝酸钾、硫磺、木炭。当加热或点燃时会发生剧烈反应而爆炸。生成物中硫元素变为最低价,碳、氮两元素均变成空气中常见的气体。
写出有关反应的化学方程式:
(8)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为:
、NO转化为: 、
、 。当烟气中
。当烟气中 和NO的体积比为2:1时,其离子方程式为
和NO的体积比为2:1时,其离子方程式为(9)研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体(Na2MoO4·2H2O)的途径如图所示:

回答下列问题:
途径①制备钼酸钠溶液,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
名校
8 . 可利用如图所示的工艺流程减少 的排放,下列说法错误的是
的排放,下列说法错误的是
 的排放,下列说法错误的是
的排放,下列说法错误的是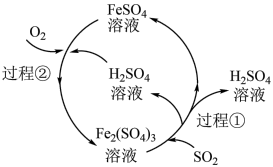
| A.在上述流程中共有三种元素的化合价发生了变化 |
| B.每处理1mol SO2,需要消耗标准状况下22.4L O2 |
| C.在上述流程中Fe2(SO4)3相当于催化剂,无需额外补充 |
D.过程①的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO +4H+ +4H+ |
您最近一年使用:0次
2023-08-24更新
|
204次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高三上学期开学检测化学试题
9 . 为探究甲醛与新制Cu(OH)2反应的产物,设计了如下实验。回答下列问题:
I.反应装置如下:
(1)仪器a的名称是___________ ,该反应需控制温度为65℃,宜采用的加热方式为___________ (填标号)。
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
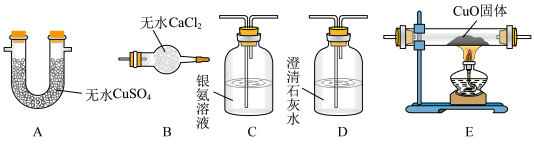
(2)为确定气体成分,下列实验装置的连接顺序是___________ ( 按气流方向填大写字母,个别装置可重复使用)。(已知:CO与银氨溶液能发生氧化还原反应)___________ 。
(3)为确定溶液中产物与固体产物,小组做了以下实验: (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。
①由实验现象可知,液体产物中存在离子是___________ (填离子符号)。
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为___________ 。
③滤液2在空气中放置一段时间后,显蓝色的离子是___________ (填离子符号)。
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是___________ 。
I.反应装置如下:
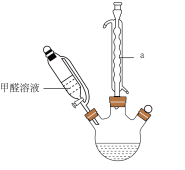
(1)仪器a的名称是
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
| 气体产物 | H2、CO、CO2 |
| 溶液中产物 | HCOO-、 |
| 固体产物 | Cu、Cu2O |
(3)为确定溶液中产物与固体产物,小组做了以下实验:
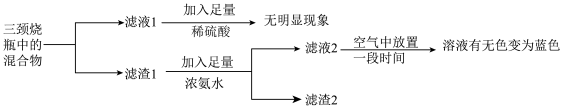
 (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。①由实验现象可知,液体产物中存在离子是
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为
③滤液2在空气中放置一段时间后,显蓝色的离子是
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是
您最近一年使用:0次
2023-06-19更新
|
106次组卷
|
4卷引用:宁夏回族自治区石嘴山市第三中学2022-2023学年高三下学期第四次模拟考试理综化学试题
2023·全国·模拟预测
名校
解题方法
10 . 一种利用微生物从黄铜矿(主要成分为 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是

 )中提取铜元素的具体操作过程如图所示。下列说法正确的是
)中提取铜元素的具体操作过程如图所示。下列说法正确的是
A.转化过程中 和 和 可以循环使用 可以循环使用 |
B.微生物的作用下, 作催化剂 作催化剂 |
C.若 中的铜元素最终全部转化为 中的铜元素最终全部转化为 ,当有2mol ,当有2mol 生成时,理论上消耗4.25mol 生成时,理论上消耗4.25mol |
D.在硫酸介质中用 替代 替代 也能高效实现将 也能高效实现将 氧化为 氧化为 |
您最近一年使用:0次
2023-04-11更新
|
392次组卷
|
5卷引用:宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题
宁夏回族自治区银川一中2023-2024学年高三上学期第一次月考理科综合化学试题(已下线)化学押题卷(二)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)选择题6-10内蒙古通辽市/科左中旗民族职专·实验高中2023-2024学年高三上学期第二次月考化学试卷



