解题方法
1 . 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2)。工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,发生的反应为aFeCl2 +bO2 + cH2O dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是
 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是| A.a+b+d=7 |
| B.该反应中,每消耗3.2gO2,同时生成32 g Fe2O3 |
| C.该反应中,HCl既是氧化产物也是还原产物 |
| D.将生成的气体通入碳酸氢钙溶液中,会有碳酸钙沉淀生成 |
您最近半年使用:0次
解题方法
2 . 天然气是一种应用广泛的燃料,含有少量 气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是
气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是

 气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是
气体。在酸性溶液中,通过甲、乙两个过程实现天然气的脱硫,原理如图所示。下列说法正确的是
A.过程甲发生的离子反应为 |
B.过程乙中每 参加反应,需消耗 参加反应,需消耗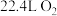 (标准状况) (标准状况) |
C.通过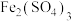 和 和 的相互转化,天然气中的 的相互转化,天然气中的 间接被 间接被 氧化 氧化 |
| D.天然气脱硫一段时间后,溶液酸性增强 |
您最近半年使用:0次
名校
解题方法
3 . 下列反应的离子方程式正确的是
A.酸性 溶液与 溶液与 反应: 反应: |
B. 溶液与 溶液与 溶液反应: 溶液反应: |
C. 溶液与NaOH溶液混合: 溶液与NaOH溶液混合: |
D.向水中通入 : : |
您最近半年使用:0次
2022-11-14更新
|
106次组卷
|
2卷引用:山东省青岛第一中学2022-2023学年高一上学期期中考试化学试题
4 . 回答下列问题:
(1)分别写出由钠在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2:___________ ;
②Na2O:___________ ;
(2)分别写出由铁单质在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①FeCl2:___________ ;
②FeCl3:___________ ;
(3)指出氧在下列各物质中的化合价。
O3:___________ ;Na2O2:___________ ;Na2O:___________ 。
(4) KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式___________ 。
(1)分别写出由钠在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2:
②Na2O:
(2)分别写出由铁单质在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①FeCl2:
②FeCl3:
(3)指出氧在下列各物质中的化合价。
O3:
(4) KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式
您最近半年使用:0次
名校
5 . 按要求完成下列方程式
(1)已知在酸性介质中FeSO4能将+6价铬还原成+3价铬。写出Cr2O 与FeSO4溶液在酸性条件下反应的离子方程式:
与FeSO4溶液在酸性条件下反应的离子方程式:___________ 。
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:___________ 。
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式:___________ 。
(4)生产硫化钠大多采用无水芒硝Na2SO4-碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:___________ 。
(1)已知在酸性介质中FeSO4能将+6价铬还原成+3价铬。写出Cr2O
 与FeSO4溶液在酸性条件下反应的离子方程式:
与FeSO4溶液在酸性条件下反应的离子方程式:(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式:
(4)生产硫化钠大多采用无水芒硝Na2SO4-碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:
您最近半年使用:0次
2021-01-07更新
|
665次组卷
|
4卷引用:山东省济宁市微山县第二中学2021-2022学年高三上学期第一学段考试化学试题
山东省济宁市微山县第二中学2021-2022学年高三上学期第一学段考试化学试题安徽省六安市城南中学2021届高三上学期第二次月考化学试题(已下线)第06讲 氧化还原反应(精讲)-2022年一轮复习讲练测(已下线)第06讲 氧化还原反应(讲)-2023年高考化学一轮复习讲练测(全国通用)
6 . NaNO2是一种食品添加剂,它与酸性KMnO4溶液的反应方程式为: +
+ +X→Mn2++
+X→Mn2++ +H2O,下列叙述中正确的是
+H2O,下列叙述中正确的是
 +
+ +X→Mn2++
+X→Mn2++ +H2O,下列叙述中正确的是
+H2O,下列叙述中正确的是| A.生成1molNaNO3需消耗0.4molKMnO4 | B.反应过程中溶液的pH减小 |
C.该反应中 被还原 被还原 | D.X可以是盐酸 |
您最近半年使用:0次
2020-11-20更新
|
188次组卷
|
2卷引用:山东省泰安市宁阳一中2021届高三上学期模块考试化学试题
7 . 高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂,工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→ +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是A.由上述反应可知,ClO-的氧化性强于 |
| B.高铁酸钾中铁显+6价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+与水反应形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近半年使用:0次
2020-09-08更新
|
544次组卷
|
3卷引用:山东省济南市历城第二中学2021届高三上学期学情检测化学试题
名校
解题方法
8 . 自然界中的许多金属元素都能以硫化物的形式存在,硫铁矿(FeS2)就是其中一种,在矿区,开采出的硫铁矿石暴露在空气和水中,会发生下图所示转化。回答下列问题:

⑴FeS2的氧化产物Fe2(SO4)3易______ ,会使地下水和土壤呈______ 性;如果矿区中的水流或降雨不断淋洗硫铁矿,FeS2最终转化为____________ 。
⑵写出FeS2的电子式:____________ 。
⑶写出图中①③两个反应的离子方程式:
①____________________________________ ,
③____________________________________ 。

⑴FeS2的氧化产物Fe2(SO4)3易
⑵写出FeS2的电子式:
⑶写出图中①③两个反应的离子方程式:
①
③
您最近半年使用:0次
解题方法
9 . A、B、C、D、E五种短周期元素的原子序数逐渐增大。A是原子半径最小的元素,B可形成多种同素异形体,其中一种的硬度是自然界中最大的。D元素原子的最外层电子数是次外层电子数的3倍。E元素的M层电子数等于A和B的质子数之和。
(1)写出元素D在元素周期表中的位置:________________________ 。
(2)B、C、D三种元素的最简单氢化物的稳定性由强到弱的顺序是________________ (填化学式)。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:________________________________ 。
(4)ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:_________________________________ ;若反应消耗1 mol C2A4,则转移电子的物质的量为______________ 。
(1)写出元素D在元素周期表中的位置:
(2)B、C、D三种元素的最简单氢化物的稳定性由强到弱的顺序是
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间发生反应的一个离子方程式:
(4)ED2是一种具有强氧化性的新型消毒剂,一定条件下4mol ED2与5 mol C2A4恰好完全反应,请写出反应的化学方程式:
您最近半年使用:0次
9-10高二·山东·假期作业
10 . 在铜催化作用下氨气和氟气反应.得到一种三角锥形分子M和一种盐N.下列有关说法正确的是
| A.该反应中氨气和氟气的化学计量数之比为4∶3 | B.该反应的还原产物是M |
| C.M是极性分子,其还原性比NH3强 | D.N中只有一种化学键 |
您最近半年使用:0次



