1 . 化学在“三废”治理方面发挥着重要的作用。回答下列问题:
Ⅰ.制革厂含硫废水中主要含有 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。
(1) 的电子式为
的电子式为___________ ;
(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式___________ 。
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为___________ 。
Ⅱ.工业上用烟气制酸的废料(主要含S、Se、 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
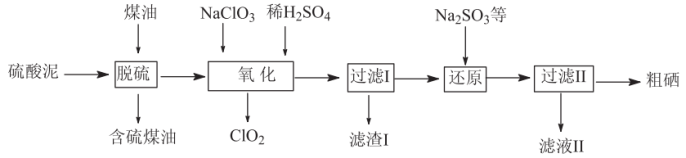
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是___________ 。
(5)“脱硫”过程中,温度控制在95℃,原因是___________ 。
(6)“氧化”过程中,Se转化成弱酸 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
Ⅲ.粗硒经过下列流程可获得亚硒酸钠( )。
)。
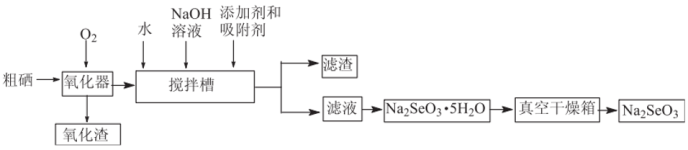
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产___________ t(精确到0.01t)含亚硒酸钠95%的产品。
Ⅰ.制革厂含硫废水中主要含有
 ,需要对含硫废水进行处理与利用。
,需要对含硫废水进行处理与利用。(1)
 的电子式为
的电子式为(2)废水混合处理不但可以同时处理不同类型的废水,同时可以获得某些化工原料。某地区使用含有硫离子的废水治理含有铜离子的废水,写出该反应的离子方程式
(3)部分地区采用空气催化氧化法脱硫。该方法以空气中的氧作为氧化剂,将废水中的
 转化为
转化为 ,反应中还原剂与氧化剂的物质的量之比为
,反应中还原剂与氧化剂的物质的量之比为Ⅱ.工业上用烟气制酸的废料(主要含S、Se、
 、CuO、ZnO、
、CuO、ZnO、 等)为原料提取硒,流程如图:
等)为原料提取硒,流程如图:
(4)硒与硫是同主族的相邻元素,其在周期表中的位置是
(5)“脱硫”过程中,温度控制在95℃,原因是
(6)“氧化”过程中,Se转化成弱酸
 ,该反应的离子方程式为
,该反应的离子方程式为Ⅲ.粗硒经过下列流程可获得亚硒酸钠(
 )。
)。
(7)已知在上述合成路线中粗硒在转化为二氧化硒时损失4%,搅拌槽中二氧化硒的利用率为95%,其他损耗忽略不计,试计算利用1t含硒79%的粗硒最终可生产
您最近一年使用:0次
名校
解题方法
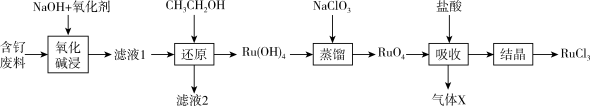
2 . 钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
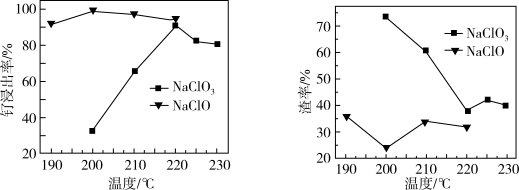
图1 图2
(2)滤液1中溶质主要成分为 、
、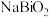 、
、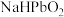 和
和_______ ;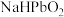 中
中 的化合价为
的化合价为_______ ; 转化为
转化为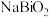 的化学方程式为
的化学方程式为_______ 。
(3)“还原”过程生成 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
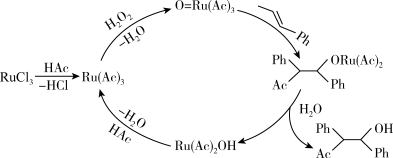
(5) 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
 )为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为
)为稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为 、
、 、
、 、
、 ,一种从中回收
,一种从中回收 制
制 的工艺流程如下:
的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度对钌浸出率和渣率分别如图1、图2所示,则适宜选择的氧化剂为

图1 图2
(2)滤液1中溶质主要成分为
 、
、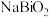 、
、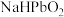 和
和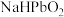 中
中 的化合价为
的化合价为 转化为
转化为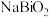 的化学方程式为
的化学方程式为(3)“还原”过程生成
 和乙醛,且
和乙醛,且 明显增大,则该过程的离子反应方程式为
明显增大,则该过程的离子反应方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)
 在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示(
在有机合成中有重要应用,其参与某有机物合成的路线如下图3所示( 代表乙酸,
代表乙酸, 代表苯基),则下列说法正确的是_______。
代表苯基),则下列说法正确的是_______。
A. 为催化剂 为催化剂 | B. 作还原剂 作还原剂 | C. 为中间产物 为中间产物 | D.主要生成物为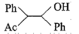 |
您最近一年使用:0次
2022-01-22更新
|
964次组卷
|
3卷引用:广东省茂名市2022届高三第一次综合测试(一模)化学试题
广东省茂名市2022届高三第一次综合测试(一模)化学试题(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)福建省厦门第一中学2021-2022学年高一下学期5月月考化学试题
名校
解题方法
3 . (I)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
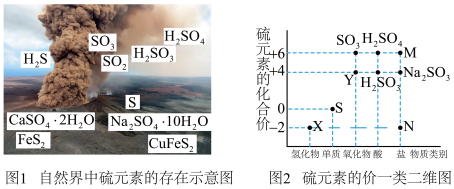
(1)图1中与图2中M、N对应的物质分别是____________ 、_____________ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为__________ 。
(3)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是___________ 。
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是______________ 。该反应体现了浓硫酸的____________ 性。
②这两种方案,你认为哪一种方案更合理?_______ 。理由是_________________ 。
(II)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:
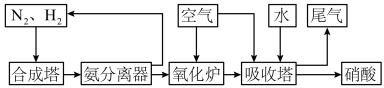
(1)合成塔中发生反应的化学方程式为__________ 。
(2)氨分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的________ 性质。
(3)氧化炉中,NH3转化为NO的化学方程式为_________ 。标准状况下,5.6LNH3被氧化为NO时转移电子的物质的量为________ 。
(4)①吸收塔中主要的反应的化学方程式为_______
②吸收塔中出来的尾气可用Na2CO3溶液吸收,主要反应为:
a.2NO2 + Na2CO3 = NaNO3 +NaNO2 +CO2
b.NO+NO2 + Na2CO3 = 2NaNO2+CO2
根据反应b,每产生22.4L(标准状况下)CO2,吸收液质量将增加______ g。
(5)写出铜分别于稀HNO3、浓HNO3反应的化学方程式__________

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
(II)氨和硝酸是重要的工业产品,如图是工业合成氨及制备硝酸的流程示意图:

(1)合成塔中发生反应的化学方程式为
(2)氨分离器中压强约为15MPa,温度约为-20°C,分离氨应用了氨的
(3)氧化炉中,NH3转化为NO的化学方程式为
(4)①吸收塔中主要的反应的化学方程式为
②吸收塔中出来的尾气可用Na2CO3溶液吸收,主要反应为:
a.2NO2 + Na2CO3 = NaNO3 +NaNO2 +CO2
b.NO+NO2 + Na2CO3 = 2NaNO2+CO2
根据反应b,每产生22.4L(标准状况下)CO2,吸收液质量将增加
(5)写出铜分别于稀HNO3、浓HNO3反应的化学方程式
您最近一年使用:0次
2023高一下·重庆·竞赛
名校
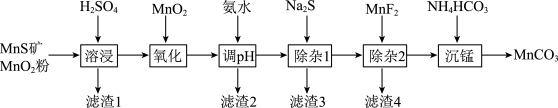
4 .  是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。用
是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。用 粉与
粉与 矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备
矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备 的工艺如下图所示:
的工艺如下图所示:
相关金属离子 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
(1)已知“滤渣1”含有S和 ,写出“溶浸”中生成S的化学方程式
,写出“溶浸”中生成S的化学方程式______ 。
(2)加入 氧化的是哪种离子
氧化的是哪种离子______ ?
(3)“调pH”控制的pH为4.7~6.0之间,写出“滤渣2”的化学式______ 。
(4)“除杂1”的目的是加入 除去
除去 和
和 ,分析该步骤不能通过调节pH除杂的原因
,分析该步骤不能通过调节pH除杂的原因______ 。
(5)写出“沉锰”的离子方程式______ 。
(6) 在空气中加热易转化为不同价态的锰的氧化物,某小组称取一定质量的
在空气中加热易转化为不同价态的锰的氧化物,某小组称取一定质量的 固体在空气中加热,测得固体质量的残留率随着温度的变化如图所示。
固体在空气中加热,测得固体质量的残留率随着温度的变化如图所示。

①写出从开始加热到A点过程中发生反应的化学方程式______ 。
②若D点对应的固体残留率为64.52%,写出D点残留固体的成分及物质的量之比______ 。
 是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。用
是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。用 粉与
粉与 矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备
矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备 的工艺如下图所示:
的工艺如下图所示:
相关金属离子
 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)已知“滤渣1”含有S和
 ,写出“溶浸”中生成S的化学方程式
,写出“溶浸”中生成S的化学方程式(2)加入
 氧化的是哪种离子
氧化的是哪种离子(3)“调pH”控制的pH为4.7~6.0之间,写出“滤渣2”的化学式
(4)“除杂1”的目的是加入
 除去
除去 和
和 ,分析该步骤不能通过调节pH除杂的原因
,分析该步骤不能通过调节pH除杂的原因(5)写出“沉锰”的离子方程式
(6)
 在空气中加热易转化为不同价态的锰的氧化物,某小组称取一定质量的
在空气中加热易转化为不同价态的锰的氧化物,某小组称取一定质量的 固体在空气中加热,测得固体质量的残留率随着温度的变化如图所示。
固体在空气中加热,测得固体质量的残留率随着温度的变化如图所示。
①写出从开始加热到A点过程中发生反应的化学方程式
②若D点对应的固体残留率为64.52%,写出D点残留固体的成分及物质的量之比
您最近一年使用:0次
解题方法
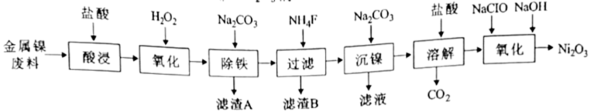
5 .  是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产
是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产 ,继而生产
,继而生产 的工艺流程如下:
的工艺流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
②当溶液中某离子浓度 ,可认为该离子已完全沉淀;
,可认为该离子已完全沉淀;
(1)“酸浸”时,需将金属镍废料粉碎的目的是________________ ;
(2)“除铁”过程中,应调节溶液pH的范围为_____________ ;
(3)滤渣B的主要成分是氟化钙和氟化镁,写出生成氟化钙的化学反应方程式___________ ;
(4)在“沉镍”操作中,若溶液中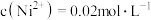 ,向其中加入等体积的
,向其中加入等体积的 溶液,使
溶液,使 沉淀完全,则所加
沉淀完全,则所加 溶液的浓度最小为
溶液的浓度最小为____________ (已知: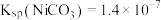 );
);
(5)“氧化”生成 的离子方程式为
的离子方程式为_______________ ;
 是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产
是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产 ,继而生产
,继而生产 的工艺流程如下:
的工艺流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 |
|
|
|
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
②当溶液中某离子浓度
 ,可认为该离子已完全沉淀;
,可认为该离子已完全沉淀;(1)“酸浸”时,需将金属镍废料粉碎的目的是
(2)“除铁”过程中,应调节溶液pH的范围为
(3)滤渣B的主要成分是氟化钙和氟化镁,写出生成氟化钙的化学反应方程式
(4)在“沉镍”操作中,若溶液中
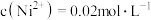 ,向其中加入等体积的
,向其中加入等体积的 溶液,使
溶液,使 沉淀完全,则所加
沉淀完全,则所加 溶液的浓度最小为
溶液的浓度最小为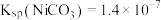 );
);(5)“氧化”生成
 的离子方程式为
的离子方程式为
您最近一年使用:0次
名校
解题方法
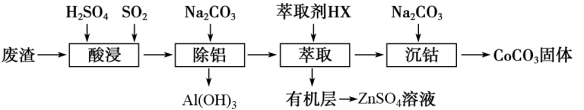
6 . 过渡金属催化的反应已成为重要的合成工具,贵金属成本高,会对环境造成的不利影响。因此研究成本低廉的含锰、铁、钴、镍、铜等催化剂应用成为热点。以下是以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
回答下列问题:
(1)“酸浸”时通入SO2的目的是____________ ,反应的离子方程式为______________ 。
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 __________________ 。
(3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是____________ 。
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:____________ 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是____________ 。

(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中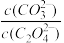 =
=___________ 。[已知Ksp(CoC2O4)=6.3×10-8 Ksp (CoCO3) =1.4×10- 13]

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(1)“酸浸”时通入SO2的目的是
(2)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 (3)“沉钴”时Na2CO3溶液需缓慢滴加的原因是
(4)用得到的CoCO3等为原料采用微波水热法和常规水热法可以制得两种CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。如图是两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:

(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中
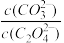 =
=
您最近一年使用:0次
2018-05-16更新
|
1056次组卷
|
6卷引用:广东省广州市第六中学2022届高三第二次月考化学试题
名校
解题方法
7 . 三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
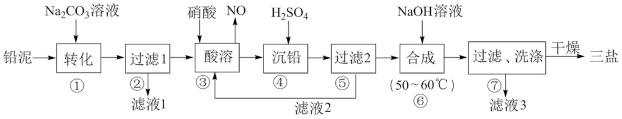
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题
(1)步骤①转化的目的是将PbSO4转化为PbCO3,反应的离子方程式为___________________ 。
(2)滤液3中的主要溶质为_____________ (填化学式)。
(3)步骤③酸溶时,铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________________ 。
(4)滤液2中可循环利用的溶质为___________ (填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)为___________ mol·L-1
(5)步骤⑥合成三盐的化学方程式为____________________________ 。若得到纯净干燥的三盐49.50 t,假设铅泥中的铅元素有80.00%转化为三盐,则铅泥中铅元素的质量分数为_____ 。[已知:三盐(3PbO·PbSO4·H2O)的相对分子质量为990,注意保留正确的有效数字]

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题
(1)步骤①转化的目的是将PbSO4转化为PbCO3,反应的离子方程式为
(2)滤液3中的主要溶质为
(3)步骤③酸溶时,铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为
(4)滤液2中可循环利用的溶质为
(5)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次






