名校
1 . 黄铁矿( )在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是
)在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是
 )在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是
)在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是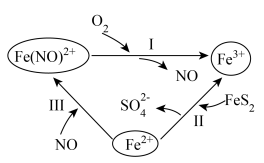
| A.反应Ⅰ、Ⅱ、Ⅲ均发生氧化还原反应 |
B.反应Ⅰ中氧化剂与还原剂的物质的量之比为 |
C.反应Ⅱ的离子方程式为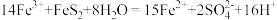 |
D.该过程的总反应为 |
您最近一年使用:0次
2024-05-16更新
|
225次组卷
|
3卷引用:重庆市荣昌永荣中学校2024届高三下学期模拟预测化学试题2
2 . 已知:2H++2 (黄色)
(黄色) H2O+
H2O+ (橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
(橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
Ⅰ.将2.4gCr(NO3)3·9H2O(M=400g/mol)溶解,逐滴加入6mol/LNaOH溶液,至产生的沉淀变为亮绿色的NaCrO2溶液。
Ⅱ.加入15%H2O2溶液,小火加热,溶液由亮绿色变为黄色。
Ⅲ.继续煮沸溶液15min,除尽剩余的H2O2,再滴加6mol/L醋酸溶液,调溶液呈弱酸性,溶液由黄色变为橙色,再滴加8滴醋酸溶液。
Ⅳ.将溶液加热近沸,滴加足量0.5mol/LPb(NO3)2溶液,继续煮沸5min。冷却后抽滤、热水洗涤、烘干称重,得黄色沉淀1.26g。
回答下列有关问题:
(1)结合步骤Ⅰ中相关信息判断Cr(OH)3是否属于两性氢氧化物?_______ 。实验中需先配制6mol/LNaOH溶液,配制过程中的部分操作如图所示,仪器X的名称为_______ ,图中操作不规范之处为_______ 。_______ 性。
(3)步骤Ⅲ中,煮沸除尽剩余H2O2的目的是:防止在得到橙色溶液时_______ 。
(4)步骤Ⅲ在加入Pb(NO3)2溶液前需加醋酸溶液调节溶液呈酸性,其目的是_______ ,否则制得的PbCrO4不纯。从平衡角度解释不宜调节酸性过强的原因是_______ 。
(5)由步骤Ⅳ中数据计算本实验的产率为_______ %(保留一位小数)。
 (黄色)
(黄色) H2O+
H2O+ (橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:
(橙色)。铬酸铅(PbCrO4,M=323g/mol)是一种黄色颜料,多用于油画及防锈涂料中。实验室中制备铬酸铅的步骤如下:Ⅰ.将2.4gCr(NO3)3·9H2O(M=400g/mol)溶解,逐滴加入6mol/LNaOH溶液,至产生的沉淀变为亮绿色的NaCrO2溶液。
Ⅱ.加入15%H2O2溶液,小火加热,溶液由亮绿色变为黄色。
Ⅲ.继续煮沸溶液15min,除尽剩余的H2O2,再滴加6mol/L醋酸溶液,调溶液呈弱酸性,溶液由黄色变为橙色,再滴加8滴醋酸溶液。
Ⅳ.将溶液加热近沸,滴加足量0.5mol/LPb(NO3)2溶液,继续煮沸5min。冷却后抽滤、热水洗涤、烘干称重,得黄色沉淀1.26g。
回答下列有关问题:
(1)结合步骤Ⅰ中相关信息判断Cr(OH)3是否属于两性氢氧化物?

(3)步骤Ⅲ中,煮沸除尽剩余H2O2的目的是:防止在得到橙色溶液时
(4)步骤Ⅲ在加入Pb(NO3)2溶液前需加醋酸溶液调节溶液呈酸性,其目的是
(5)由步骤Ⅳ中数据计算本实验的产率为
您最近一年使用:0次
名校
解题方法
3 . 纳米级 广泛用于化妆品和功能纤维领域。实验室利用普通
广泛用于化妆品和功能纤维领域。实验室利用普通 制备纳米
制备纳米 并测定其组成(夹持装置略去)。
并测定其组成(夹持装置略去)。
已知:① 可发生反应
可发生反应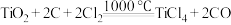 。
。
② 易挥发,沸点136.4℃,极易与水反应,与
易挥发,沸点136.4℃,极易与水反应,与 气体不反应。
气体不反应。
③ 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收
,可吸收 生成黑色颗粒
生成黑色颗粒 。
。
Ⅰ.制备
 时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)
时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)_____ ,_____ ,接通冷凝装置,开始实验。
(2)F中试剂为_______ ,发生反应的离子方程式为_______ 。
(3)该实验设计存在的缺陷是_______ 。
Ⅱ.制备
以 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米
,再控制温度生成纳米 。
。
Ⅲ.测定纳米 的组成
的组成
步骤i:取纳米 样品4.54g,用足量稀硫酸溶解得到
样品4.54g,用足量稀硫酸溶解得到 溶液,再用Al将
溶液,再用Al将 全部还原为
全部还原为 ,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
步骤ii:取待测液25.00mL,用如图装置进行电位滴定。用 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,指示电极的电位随
,指示电极的电位随 浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。 表示指示电极的电位,
表示指示电极的电位, 表示标准溶液的体积,
表示标准溶液的体积, 表示指示电极的电位改变量,
表示指示电极的电位改变量, 表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有
表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有_______ (填字母)。_______ (填化学式),若测定过程中加入Al不足,则导致
_______ (填“偏大”“偏小”或“无影响”)。
 广泛用于化妆品和功能纤维领域。实验室利用普通
广泛用于化妆品和功能纤维领域。实验室利用普通 制备纳米
制备纳米 并测定其组成(夹持装置略去)。
并测定其组成(夹持装置略去)。已知:①
 可发生反应
可发生反应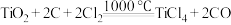 。
。②
 易挥发,沸点136.4℃,极易与水反应,与
易挥发,沸点136.4℃,极易与水反应,与 气体不反应。
气体不反应。③
 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收
,可吸收 生成黑色颗粒
生成黑色颗粒 。
。Ⅰ.制备


 时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)
时进行操作:(i)组装仪器,检验装置气密性;(ii)添加药品;(iii)(2)F中试剂为
(3)该实验设计存在的缺陷是
Ⅱ.制备

以
 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米
,再控制温度生成纳米 。
。Ⅲ.测定纳米
 的组成
的组成步骤i:取纳米
 样品4.54g,用足量稀硫酸溶解得到
样品4.54g,用足量稀硫酸溶解得到 溶液,再用Al将
溶液,再用Al将 全部还原为
全部还原为 ,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。
,过滤、洗涤,将滤液和洗涤液注入500mL容量瓶,定容得到待测液。步骤ii:取待测液25.00mL,用如图装置进行电位滴定。用
 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,指示电极的电位随
,指示电极的电位随 浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
浓度变化而变化,通过测量指示电极的电位变化确定滴定终点。
 表示指示电极的电位,
表示指示电极的电位, 表示标准溶液的体积,
表示标准溶液的体积, 表示指示电极的电位改变量,
表示指示电极的电位改变量,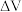 表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有
表示标准溶液体积的增量,下列所示滴定终点附近的图像正确的有

您最近一年使用:0次
2024-05-14更新
|
102次组卷
|
2卷引用:山东省滨州市2024届高三下学期二模化学试题
名校
解题方法
4 . 过硫酸铵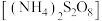 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为___________ 。
(2)仪器的连接顺序为
___________ (用小写字母连接)。
(3)盛放浓硫酸的仪器名称为___________ 。装置A中 的作用是
的作用是___________ 。过硫酸铵保存在棕色试剂瓶中的原因是___________ 。
(4)A中制取过硫酸铵的反应的化学方程式为___________ 。充分反应后,将A中混合液经一系列操作得到晶体,然后用无水乙醇洗涤。选择用无水乙醇洗涤的目的是___________ 。
(5)过硫酸铵可用于测定锰钢中 元素的含量:取
元素的含量:取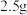 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
___________ (保留两位小数)。
(6)根据本实验可得出, 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为___________ 。
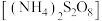 也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至
也称过二硫酸铵,常用作食品保存剂、氧化剂以及高分子聚合物的引发剂,见光易分解,易溶于水,微溶于乙醇。用30%双氧水、浓硫酸和氨气加热至 制备过硫酸铵的装置如图所示。
制备过硫酸铵的装置如图所示。
(1)每个过硫酸铵(S元素的化合价为+6价)中含有过氧键个数为
(2)仪器的连接顺序为

(3)盛放浓硫酸的仪器名称为
 的作用是
的作用是(4)A中制取过硫酸铵的反应的化学方程式为
(5)过硫酸铵可用于测定锰钢中
 元素的含量:取
元素的含量:取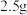 锰钢样品,加入过量浓硝酸,在加热条件下将
锰钢样品,加入过量浓硝酸,在加热条件下将 溶出形成
溶出形成 ,再用
,再用 过硫酸铵溶液恰好将溶出的
过硫酸铵溶液恰好将溶出的 全部转化为
全部转化为 ,通过检测
,通过检测 的浓度得出样品中
的浓度得出样品中 元素的质量分数为54%,则
元素的质量分数为54%,则
(6)根据本实验可得出,
 的氧化性从大到小的顺序为
的氧化性从大到小的顺序为
您最近一年使用:0次
解题方法
5 . 近年来,随着新能源汽车行业高速发展,市场对磷酸铁锂( )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
请回答下列问题:
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:___________ 。
(2)“焙烧”生成 的化学方程式为
的化学方程式为___________ 。
(3)“还原”选用足量FeS的优点是___________ ;“除铝”时,溶液的pH应控制的范围是___________ 。
(4)“氧化”加入 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以___________ 。
(5)“沉铁”后的滤液中阴离子除了 外,还检验出
外,还检验出 和
和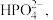 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:___________ 。
(6)“高温煅烧”条件下,由 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
___________ 。
(7) 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成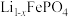 ,结构如图b所示,则
,结构如图b所示,则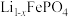 中
中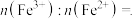
___________ (填最简整数比)。
 )的需求量也随之增加。以硫铁矿(主要成分是
)的需求量也随之增加。以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 为原料制备)
为原料制备) 的流程如图所示:
的流程如图所示:
| 金属氢氧化物 |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 |
(1)写出磷酸铁锂中相应价态基态铁离子的电子排布式:
(2)“焙烧”生成
 的化学方程式为
的化学方程式为(3)“还原”选用足量FeS的优点是
(4)“氧化”加入
 的目的除了可以增强H2O2的氧化性外,还可以
的目的除了可以增强H2O2的氧化性外,还可以(5)“沉铁”后的滤液中阴离子除了
 外,还检验出
外,还检验出 和
和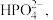 写出“沉铁”反应的离子方程式:
写出“沉铁”反应的离子方程式:(6)“高温煅烧”条件下,由
 制备
制备 ,理论上
,理论上 和
和 的投料比为
的投料比为
(7)
 的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时
的晶胞结构如图a所示,Li⁺分别处于顶点、部分的棱心和面心。电池充电时 脱出部分Li⁺形成
脱出部分Li⁺形成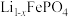 ,结构如图b所示,则
,结构如图b所示,则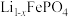 中
中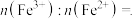

您最近一年使用:0次
6 . 钌(Ru)是地球上丰度最小的元素,钌的产品广泛应用于电子、航空航天、化工等领域。从某种失效的钌催化剂(主要成分为Ru、ZnO、 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: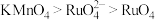
(1)“煅烧”的目的是___________ 。
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为 的化学方程式为
的化学方程式为___________ 。
② 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是___________ 。
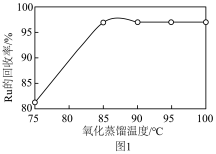
(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是___________ 。___________ 。
(5)钌多活性位点催化剂(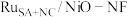 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。___________ 。
②催化剂的活性位点在催化过程中的主要作用是___________ 。
③分析图2-a推测 的“吸附解离”主要发生在
的“吸附解离”主要发生在___________ (填“钌原子”、“钌团簇”或“NiO”)位点上,若有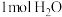 参与该过程,则变化的能量为
参与该过程,则变化的能量为___________ kJ(保留1位小数:已知: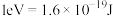 )。
)。
④分析图2-b并说明 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因___________ 。
 、有机物等)中回收钌的工艺流程如下:
、有机物等)中回收钌的工艺流程如下: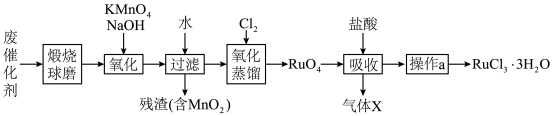
 的沸点为40℃,温度高于108℃分解。②氧化性:
的沸点为40℃,温度高于108℃分解。②氧化性: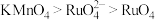
(1)“煅烧”的目的是
(2)“氧化”过程需在650℃下熔融反应5小时。
①单质Ru被氧化为
 的化学方程式为
的化学方程式为②
 固体过量会导致钌的回收率降低,原因是
固体过量会导致钌的回收率降低,原因是(3)“氧化蒸馏”时,测得钌的回收率随温度变化曲线如图1所示。工业上保证钌回收率较高的情况下,选择在95℃进行氧化蒸馏的原因是
(5)钌多活性位点催化剂(
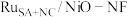 )可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
)可用于催化水的多步碱性析氢反应。该催化剂存在钌单原子、钌团簇、NiO三种活性位点,不同位点的催化特点不同。图2为反应历程中微粒在不同位点的自由能的变化,其中吸附在催化剂表面的微粒用*标注。
②催化剂的活性位点在催化过程中的主要作用是
③分析图2-a推测
 的“吸附解离”主要发生在
的“吸附解离”主要发生在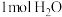 参与该过程,则变化的能量为
参与该过程,则变化的能量为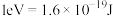 )。
)。④分析图2-b并说明
 的脱附主要发生在NiO表面的原因
的脱附主要发生在NiO表面的原因
您最近一年使用:0次
7 . 工业废气、汽车尾气排放的氮氧化物、二氧化硫等是形成雾霾的主要物质,需要进行综合治理。
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目___________ 。
处理汽车尾气的反应为: △H
△H
2.已知:CO的燃烧热△H1=-283.0kJ·mol-1
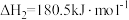
则△H=___________ 。该反应的△S___________ 0(填“>”或“<”)。
3.上述反应自发进行的条件是
工业上对二氧化硫的处理有多种方法。I:用NaOH溶液或氨水吸收废气中少量SO2气体,以防污染环境。4.若用0.1mol·L-1的NaOH溶液或同浓度的氨水处理相同量的废气,两种方法所需吸收液的体积关系是___________
5.用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化如下表所示。
根据以上信息推断NaHSO3溶液的酸碱性,结合方程式解释其原因:___________ 。
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO ]的值将
]的值将___________ 。
A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:___________ 。
己知: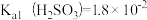 ,
,
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目
处理汽车尾气的反应为:
 △H
△H2.已知:CO的燃烧热△H1=-283.0kJ·mol-1

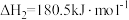
则△H=
3.上述反应自发进行的条件是
| A.任何温度 | B.任何温度都不能 | C.高温 | D.低温 |
| A.NaOH溶液的体积大于氨水 | B.NaOH溶液的体积等于氨水 |
| C.NaOH溶液的体积小于氨水 | D.无法判断 |
n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,溶液中c(HSO )增大 )增大 |
B.加入少量Na2SO3固体,则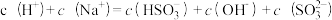 |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
D.加入氨水至中性,则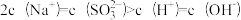 |
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO
 ]的值将
]的值将A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO
 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:己知:
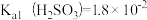 ,
,
您最近一年使用:0次
名校
解题方法
8 . 宏观辨识与微观探析是化学学科核心素养之一、下列反应方程式书写正确的是
A.将少量 通入 通入 溶液中: 溶液中: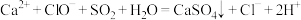 |
B.向甲醛溶液中加入足量的银氨溶液并加热: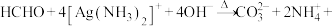  |
C.向摩尔盐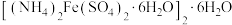 溶液中加入NaOH溶液至 溶液中加入NaOH溶液至 刚好反应完全: 刚好反应完全: |
D.往酸性 溶液中加入难溶于水的 溶液中加入难溶于水的 固体,溶液出现紫红色: 固体,溶液出现紫红色: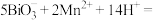 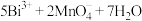 |
您最近一年使用:0次
2024-05-09更新
|
386次组卷
|
4卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷湖北省十堰市2023-2024学年高三下学期4月调研考试化学试题2024届南昌市第十九中学高三下学期模拟预测化学试题(已下线)第02讲 离子反应、离子方程式(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
9 . 锰是生产各种合金的重要元素。工业上以含锰矿石(主要成分为 ,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
表一
表二
回答下列问题:
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有_______ (写两种)。
(2)“氧化”步骤发生反应的离子方程式为_______ 。
(3)滤渣1的主要成分是_______ ,实验室中为了加快固液混合物的分离,常采用的操作是_______ 。
(4)有同学提出,加入(NH4)2S除钴、除镍的步骤可以放在“除杂1”之前,你是否赞同?请说明理由:_______ 。
(5)由 晶体制备CuCl2的方法是
晶体制备CuCl2的方法是_______ 。
(6)25℃时,分离出滤渣3所得的滤液中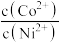 =
=_______ ,欲使沉钴后的溶液中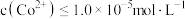 ,需要控制溶液的pH至少为
,需要控制溶液的pH至少为_______ 。(已知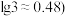
(7)电解废液中还含有少量Mn2+,向其中加入饱和N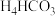 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为_______ 。
 ,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
,还含有铁、钴、镍、铜等的碳酸盐杂质)为原料生产金属锰的工艺流程如下:
表一
| 物质 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 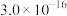 | 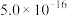 |  | 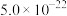 | 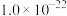 |
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)用硫酸浸取含锰矿石时,提高浸取速率的方法有
(2)“氧化”步骤发生反应的离子方程式为
(3)滤渣1的主要成分是
(4)有同学提出,加入(NH4)2S除钴、除镍的步骤可以放在“除杂1”之前,你是否赞同?请说明理由:
(5)由
 晶体制备CuCl2的方法是
晶体制备CuCl2的方法是(6)25℃时,分离出滤渣3所得的滤液中
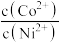 =
=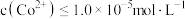 ,需要控制溶液的pH至少为
,需要控制溶液的pH至少为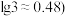
(7)电解废液中还含有少量Mn2+,向其中加入饱和N
 溶液,有沉淀和气体生成,该反应的离子方程式为
溶液,有沉淀和气体生成,该反应的离子方程式为
您最近一年使用:0次
2024-05-07更新
|
69次组卷
|
2卷引用:湖北省普通高中2024届高三下学期高考押题预测卷化学试题
名校
解题方法
10 .  俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
(1)亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用___________ 润湿后加入 溶液中,水浴加热后再经重结晶精制。
溶液中,水浴加热后再经重结晶精制。
②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为___________ ,证明含有该杂质的方法是___________ 。
(2)硫化钠法:选用以下必要的装置,利用 与
与 、
、 的混合溶液反应制备
的混合溶液反应制备 。
。___________ 。
②丁装置中 与
与 、
、 混合液反应生成
混合液反应生成 的化学方程式:
的化学方程式:___________ 。
③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的 ,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入
,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 ,用离子方程式解释立刻停止通入
,用离子方程式解释立刻停止通入 的原因:
的原因:___________ 。
④简述检验丁装置中导出气体中含有 的方法:
的方法:___________ 。
(3) 的用途:做冶金工业络合剂。
的用途:做冶金工业络合剂。
黄金(Au)浸取工艺:将金矿石浸泡在 、
、 的混合溶液中,并通入
的混合溶液中,并通入 。其中
。其中 作为催化剂参与反应,方程式为:
作为催化剂参与反应,方程式为: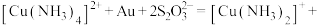
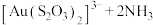 ,则浸金总反应的离子方程式为:
,则浸金总反应的离子方程式为:___________ 。
 俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:(1)亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用
 溶液中,水浴加热后再经重结晶精制。
溶液中,水浴加热后再经重结晶精制。②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为
(2)硫化钠法:选用以下必要的装置,利用
 与
与 、
、 的混合溶液反应制备
的混合溶液反应制备 。
。
②丁装置中
 与
与 、
、 混合液反应生成
混合液反应生成 的化学方程式:
的化学方程式:③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的
 ,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入
,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 ,用离子方程式解释立刻停止通入
,用离子方程式解释立刻停止通入 的原因:
的原因:④简述检验丁装置中导出气体中含有
 的方法:
的方法:(3)
 的用途:做冶金工业络合剂。
的用途:做冶金工业络合剂。黄金(Au)浸取工艺:将金矿石浸泡在
 、
、 的混合溶液中,并通入
的混合溶液中,并通入 。其中
。其中 作为催化剂参与反应,方程式为:
作为催化剂参与反应,方程式为: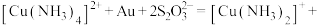
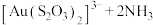 ,则浸金总反应的离子方程式为:
,则浸金总反应的离子方程式为:
您最近一年使用:0次



