真题
解题方法
1 . 丙烯腈( )是一种重要的化工原料。工业上以
)是一种重要的化工原料。工业上以 为载气,用
为载气,用 作催化剂生产
作催化剂生产 的流程如下:
的流程如下:
②反应釜Ⅰ中发生的反应:
ⅰ: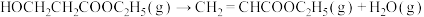

③反应釜Ⅱ中发生的反应:
ⅱ:

ⅲ: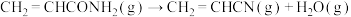

④在此生产条件下,酯类物质可能发生水解。
回答下列问题:
(1)总反应

_______ (用含 、
、 、和
、和 的代数式表示);
的代数式表示);
(2)进料混合气中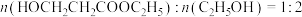 ,出料中四种物质(
,出料中四种物质( 、
、 、
、 、
、 )的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图:
)的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图: 的曲线是
的曲线是_______ (填“a”“b”或“c”);
②反应釜Ⅰ中加入 的作用是
的作用是_______ 。
③出料中没有检测到 的原因是
的原因是_______ 。
④反应 后,a、b、c曲线对应物质的流量逐渐降低的原因是
后,a、b、c曲线对应物质的流量逐渐降低的原因是_______ 。
(3)催化剂 再生时会释放
再生时会释放 ,可用氨水吸收获得
,可用氨水吸收获得 。现将一定量的
。现将一定量的 固体(含
固体(含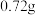 水)置于密闭真空容器中,充入
水)置于密闭真空容器中,充入 和
和 ,其中
,其中 的分压为
的分压为 ,在
,在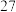 ℃下进行干燥。为保证
℃下进行干燥。为保证 不分解,
不分解, 的分压应不低于
的分压应不低于_______  (已知
(已知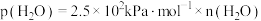
 分解的平衡常数
分解的平衡常数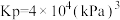 );
);
(4)以 为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得
为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得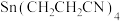 ,其阴极反应式
,其阴极反应式_______ 。
 )是一种重要的化工原料。工业上以
)是一种重要的化工原料。工业上以 为载气,用
为载气,用 作催化剂生产
作催化剂生产 的流程如下:
的流程如下:
②反应釜Ⅰ中发生的反应:
ⅰ:
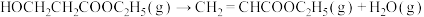

③反应釜Ⅱ中发生的反应:
ⅱ:


ⅲ:
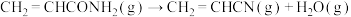

④在此生产条件下,酯类物质可能发生水解。
回答下列问题:
(1)总反应


 、
、 、和
、和 的代数式表示);
的代数式表示);(2)进料混合气中
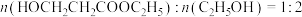 ,出料中四种物质(
,出料中四种物质( 、
、 、
、 、
、 )的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图:
)的流量,(单位时间内出料口流出的物质的量)随时间变化关系如图:
 的曲线是
的曲线是②反应釜Ⅰ中加入
 的作用是
的作用是③出料中没有检测到
 的原因是
的原因是④反应
 后,a、b、c曲线对应物质的流量逐渐降低的原因是
后,a、b、c曲线对应物质的流量逐渐降低的原因是(3)催化剂
 再生时会释放
再生时会释放 ,可用氨水吸收获得
,可用氨水吸收获得 。现将一定量的
。现将一定量的 固体(含
固体(含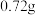 水)置于密闭真空容器中,充入
水)置于密闭真空容器中,充入 和
和 ,其中
,其中 的分压为
的分压为 ,在
,在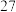 ℃下进行干燥。为保证
℃下进行干燥。为保证 不分解,
不分解, 的分压应不低于
的分压应不低于 (已知
(已知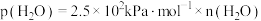
 分解的平衡常数
分解的平衡常数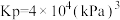 );
);(4)以
 为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得
为原料,稀硫酸为电解液,Sn作阴极,用电解的方法可制得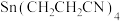 ,其阴极反应式
,其阴极反应式
您最近一年使用:0次
名校
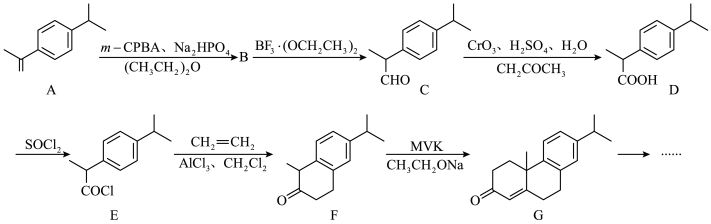
2 . 利用环化反应合成天然产物callitrisic acid的部分合成路线如下。___________ ,G的分子式为___________ 。
(2)C→D的反应类型为___________ ,不能用酸性 溶液替换
溶液替换 的原因是
的原因是___________ 。
(3)D→E为取代反应,同时生成HCl和 ,其化学方程式为
,其化学方程式为___________ 。
(4)E→F发生了傅克酰基化反应,其反应机理如下(―R为烃基)。___________ 。
(2)C→D的反应类型为
 溶液替换
溶液替换 的原因是
的原因是(3)D→E为取代反应,同时生成HCl和
 ,其化学方程式为
,其化学方程式为(4)E→F发生了傅克酰基化反应,其反应机理如下(―R为烃基)。
 傅克酰基化反应较难生成多元取代产物的原因是
傅克酰基化反应较难生成多元取代产物的原因是

已知:
 + ROH
+ ROH
②设计以乙醇、HOOC(CH2)4COOH、MVK为原料合成 的路线。
的路线。
您最近一年使用:0次
3 . 以磷石膏(主要成分 ,杂质
,杂质 、
、 等)和氨水为原料可实现
等)和氨水为原料可实现 矿物封存同时制备轻质
矿物封存同时制备轻质 ,转化部分流程如图。
,转化部分流程如图。 ,
,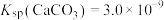 ,
,
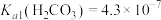 ,
,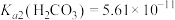 。
。
下列说法正确的是
 ,杂质
,杂质 、
、 等)和氨水为原料可实现
等)和氨水为原料可实现 矿物封存同时制备轻质
矿物封存同时制备轻质 ,转化部分流程如图。
,转化部分流程如图。
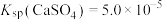 ,
,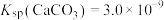 ,
,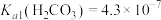 ,
,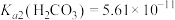 。
。下列说法正确的是
A.氨水中存在: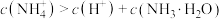 |
B.“转化”步骤,通入 后清液中始终存在 后清液中始终存在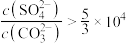 |
C.“转化”步骤,若通入 至溶液 至溶液 为6.5,此时溶液中 为6.5,此时溶液中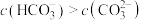 |
D.“滤液”中存在: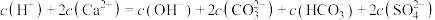 |
您最近一年使用:0次
真题
4 . 铜阳极泥(含有Au、 、
、 、
、 等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下: 时,可忽略该离子的存在;
时,可忽略该离子的存在;
②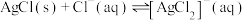
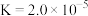 ;
;
③ 易从溶液中结晶析出;
易从溶液中结晶析出;
④不同温度下 的溶解度如下:
的溶解度如下:
回答下列问题:
(1)Cu属于_______ 区元素,其基态原子的价电子排布式为_______ ;
(2)“滤液1”中含有 和
和 ,“氧化酸浸”时
,“氧化酸浸”时 反应的离子方程式为
反应的离子方程式为_______ ;
(3)“氧化酸浸”和“除金”工序抣需加入一定量的 :
:
①在“氧化酸浸”工序中,加入适量 的原因是
的原因是_______ 。
②在“除金”工序溶液中, 浓度不能超过
浓度不能超过_______  。
。
(4)在“银转化”体系中, 和
和 浓度之和为
浓度之和为 ,两种离子分布分数
,两种离子分布分数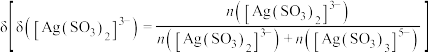 随
随 浓度的变化关系如图所示,若
浓度的变化关系如图所示,若 浓度为
浓度为 ,则
,则 的浓度为
的浓度为_______  。
。_______ (填化学式);在连续生产的模式下,“银转化”和“银还原”工序需在 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是
℃左右进行,若反应温度过高,将难以实现连续生产,原因是_______ 。
 、
、 、
、 等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
等)是一种含贵金属的可再生资源,回收贵金属的化工流程如下:
 时,可忽略该离子的存在;
时,可忽略该离子的存在;②
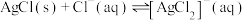
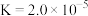 ;
;③
 易从溶液中结晶析出;
易从溶液中结晶析出;④不同温度下
 的溶解度如下:
的溶解度如下:温度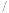 ℃ ℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 14.4 | 26.1 | 37.4 | 33.2 | 29.0 |
(1)Cu属于
(2)“滤液1”中含有
 和
和 ,“氧化酸浸”时
,“氧化酸浸”时 反应的离子方程式为
反应的离子方程式为(3)“氧化酸浸”和“除金”工序抣需加入一定量的
 :
:①在“氧化酸浸”工序中,加入适量
 的原因是
的原因是②在“除金”工序溶液中,
 浓度不能超过
浓度不能超过 。
。(4)在“银转化”体系中,
 和
和 浓度之和为
浓度之和为 ,两种离子分布分数
,两种离子分布分数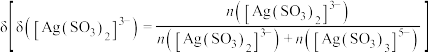 随
随 浓度的变化关系如图所示,若
浓度的变化关系如图所示,若 浓度为
浓度为 ,则
,则 的浓度为
的浓度为 。
。
 ℃左右进行,若反应温度过高,将难以实现连续生产,原因是
℃左右进行,若反应温度过高,将难以实现连续生产,原因是
您最近一年使用:0次
真题
5 . 氢是清洁能源,硼氢化钠( )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)

请回答:
(1)该反应能自发进行的条件是_______。
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
(3)为加速 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比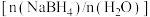 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因_______ 。_______ 。该电池以 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为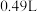 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为_______ 。[已知:该条件下 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间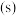 ;
;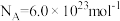 ;
;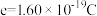 。]
。] )再生为
)再生为 。(已知:
。(已知: 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当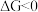 时,反应能自发进行。)
时,反应能自发进行。)
I.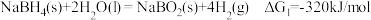
II.
III.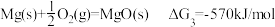
请书写一个方程式表示 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明
_______ 。(要求:反应物不超过三种物质;氢原子利用率为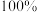 。)
。)
 )是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为
)是一种环境友好的固体储氢材料,其水解生氢反应方程式如下:(除非特别说明,本题中反应条件均为 ,
, )
)
请回答:
(1)该反应能自发进行的条件是_______。
| A.高温 | B.低温 | C.任意温度 | D.无法判断 |
| A.升高溶液温度 | B.加入少量异丙胺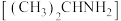 |
C.加入少量固体硼酸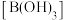 | D.增大体系压强 |
 水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比
水解,某研究小组开发了一种水溶性催化剂,当该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速率v与投料比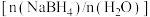 之间的关系,结果如图1所示。请解释ab段变化的原因
之间的关系,结果如图1所示。请解释ab段变化的原因
 恒定电流工作14分钟,消耗
恒定电流工作14分钟,消耗 体积为
体积为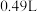 ,故可测得该电池将化学能转化为电能的转化率为
,故可测得该电池将化学能转化为电能的转化率为 的摩尔体积为
的摩尔体积为 ;电荷量
;电荷量 电流
电流 时间
时间 ;
;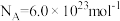 ;
;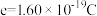 。]
。]
 )再生为
)再生为 。(已知:
。(已知: 是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比
是反应的自由能变化量,其计算方法也遵循盖斯定律,可类比 计算方法;当
计算方法;当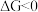 时,反应能自发进行。)
时,反应能自发进行。)I.
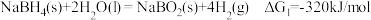
II.

III.
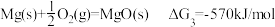
请书写一个方程式表示
 再生为
再生为 的一种制备方法,并注明
的一种制备方法,并注明
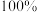 。)
。)
您最近一年使用:0次
真题
6 . 研究人员制备了一种具有锂离子通道的导电氧化物(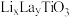 ),其立方晶胞和导电时
),其立方晶胞和导电时 迁移过程如下图所示。已知该氧化物中
迁移过程如下图所示。已知该氧化物中 为
为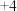 价,
价, 为
为 价。下列说法错误的是
价。下列说法错误的是
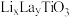 ),其立方晶胞和导电时
),其立方晶胞和导电时 迁移过程如下图所示。已知该氧化物中
迁移过程如下图所示。已知该氧化物中 为
为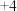 价,
价, 为
为 价。下列说法错误的是
价。下列说法错误的是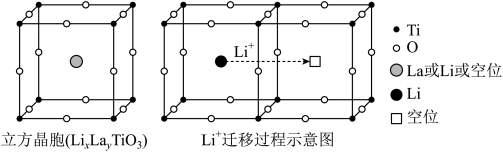
A.导电时, 和 和 的价态不变 的价态不变 | B.若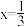 , , 与空位的数目相等 与空位的数目相等 |
| C.与体心最邻近的O原子数为12 | D.导电时、空位移动方向与电流方向相反 |
您最近一年使用:0次
真题
解题方法
7 . 氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图1, 的配位数(紧邻的阳离子数)为
的配位数(紧邻的阳离子数)为_______ ;写出该化合物的化学式_______ ,写出该化合物与足量 溶液反应的化学方程式
溶液反应的化学方程式_______ 。
(3)化合物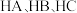 和
和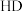 的结构如图2。
的结构如图2。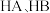 和
和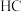 中羟基与水均可形成氢键(
中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序
),按照氢键由强到弱对三种酸排序_______ ,请说明理由_______ 。
②已知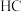 、
、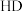 钠盐的碱性
钠盐的碱性 ,请从结构角度说明理由
,请从结构角度说明理由_______ 。
(1)某化合物的晶胞如图1,
 的配位数(紧邻的阳离子数)为
的配位数(紧邻的阳离子数)为 溶液反应的化学方程式
溶液反应的化学方程式
A. 的基态原子电子排布方式只有一种 的基态原子电子排布方式只有一种 |
B. 的第二电离能 的第二电离能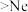 的第一电离能 的第一电离能 |
C. 的基态原子简化电子排布式为 的基态原子简化电子排布式为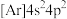 |
D. 原子变成 原子变成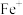 ,优先失去 ,优先失去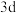 轨道上的电子 轨道上的电子 |
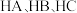 和
和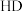 的结构如图2。
的结构如图2。
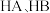 和
和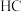 中羟基与水均可形成氢键(
中羟基与水均可形成氢键( ),按照氢键由强到弱对三种酸排序
),按照氢键由强到弱对三种酸排序②已知
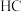 、
、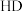 钠盐的碱性
钠盐的碱性 ,请从结构角度说明理由
,请从结构角度说明理由
您最近一年使用:0次
名校
8 . 丙烯可发生如下转化,下列说法不正确的是

| A.丙烯分子中最少有6个原子共平面 |
| B.X具有顺反异构 |
| C.Y与足量NaOH溶液共热可生成1,2-丙二醇 |
D.聚合物Z的链节结构简式为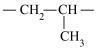 |
您最近一年使用:0次
7日内更新
|
641次组卷
|
2卷引用:2024届辽宁省实验中学高三下学期考前模拟训练(五模)化学试卷
名校
解题方法
9 . 乙醇-水催化重整可获得 。主要发生以下反应:
。主要发生以下反应:
反应Ⅰ: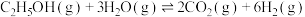
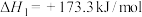
反应Ⅱ:
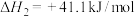
(1)反应Ⅰ自发进行的条件是_______。
(2)500℃时,向体积为VL的恒容密闭容器中充入1mol (g)和3mol
(g)和3mol  (g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%,
(g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%, 的转化率为80%。(CO的选择性=
的转化率为80%。(CO的选择性= )
)
①反应Ⅰ的
_______ (列出计算式即可)。反应Ⅰ的标准平衡常数 ,其中
,其中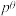 为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。
为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。
②在下图中画出500℃时,乙醇平衡转化率随[ ]变化而变化的情况
]变化而变化的情况_______ 。 的平衡产率与温度、起始时
的平衡产率与温度、起始时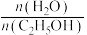 关系如图所示,每条曲线表示
关系如图所示,每条曲线表示 相同的平衡产率。
相同的平衡产率。 的平衡产率:Q点
的平衡产率:Q点_______ N点(填“>”、“=”或“<”);
②M、N两点 的平衡产率相等的原因是
的平衡产率相等的原因是_______ 。
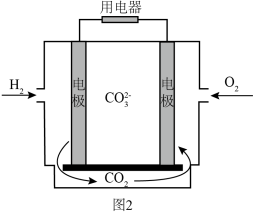
(4)氢气的应用:氢气熔融碳酸盐燃料电池工作原理如图所示。 和
和 经催化重整生成CO和
经催化重整生成CO和 ,CO和
,CO和 全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)
全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)_______ 。
②理论上负极生成的 与正极消耗的
与正极消耗的 的物质的量之比是
的物质的量之比是_______ 。
 。主要发生以下反应:
。主要发生以下反应:反应Ⅰ:
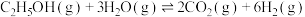
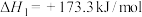
反应Ⅱ:

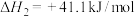
(1)反应Ⅰ自发进行的条件是_______。
| A.低温 | B.高温 | C.低压 | D.高压 |
(2)500℃时,向体积为VL的恒容密闭容器中充入1mol
 (g)和3mol
(g)和3mol  (g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%,
(g)发生上述反应。初始时体系压强为100kPa,平衡时,CO的选择性为50%, 的转化率为80%。(CO的选择性=
的转化率为80%。(CO的选择性= )
)①反应Ⅰ的

 ,其中
,其中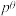 为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。
为标准压强100kPa,p(X)为气体X的平衡分压,分压=总压×该气体的物质的量分数。②在下图中画出500℃时,乙醇平衡转化率随[
 ]变化而变化的情况
]变化而变化的情况
 的平衡产率与温度、起始时
的平衡产率与温度、起始时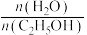 关系如图所示,每条曲线表示
关系如图所示,每条曲线表示 相同的平衡产率。
相同的平衡产率。
 的平衡产率:Q点
的平衡产率:Q点②M、N两点
 的平衡产率相等的原因是
的平衡产率相等的原因是(4)氢气的应用:氢气熔融碳酸盐燃料电池工作原理如图所示。

 和
和 经催化重整生成CO和
经催化重整生成CO和 ,CO和
,CO和 全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)
全部进入电极A发生反应,写出负极的电极反应式(用一个总方程式表示)②理论上负极生成的
 与正极消耗的
与正极消耗的 的物质的量之比是
的物质的量之比是
您最近一年使用:0次
名校
10 . 水合肼 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
(1) 分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示
分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示 分子交互式的是
分子交互式的是_______ (填序号)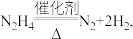 肼的理论储氢密度
肼的理论储氢密度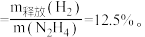 测得肼实际分解时产生的气体中含
测得肼实际分解时产生的气体中含 肼实际储氢密度小于理论值的原因是
肼实际储氢密度小于理论值的原因是_______ (用化学方程式表示)。
(3)水合肼制氢过程中涉及肼在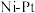 催化剂表面分解,如图所示。
催化剂表面分解,如图所示。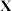 的结构简式为
的结构简式为_______ 。
②催化剂表面存在 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于_______ (填“ ”或“
”或“ ”)活性位点。已知:
”)活性位点。已知: 键、
键、 键的键能分别是
键的键能分别是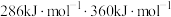 。肼在该催化剂表面反应断裂的化学键不是
。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是_______ 。
③催化剂存在下,不同浓度的 分解时,测得
分解时,测得 随时间的变化如下图所示。当
随时间的变化如下图所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变。其原因是
时,反应速率几乎不变。其原因是_______ 。
 在储氢领域有广阔的应用前景,其水溶液呈弱碱性。
在储氢领域有广阔的应用前景,其水溶液呈弱碱性。(1)
 分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示
分子有顺式、反式和交互式三种比较稳定的空间构型。下列结构能表示 分子交互式的是
分子交互式的是
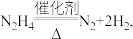 肼的理论储氢密度
肼的理论储氢密度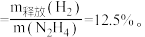 测得肼实际分解时产生的气体中含
测得肼实际分解时产生的气体中含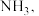 肼实际储氢密度小于理论值的原因是
肼实际储氢密度小于理论值的原因是(3)水合肼制氢过程中涉及肼在
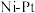 催化剂表面分解,如图所示。
催化剂表面分解,如图所示。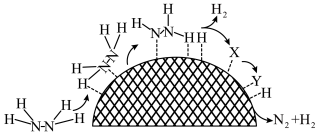
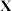 的结构简式为
的结构简式为②催化剂表面存在
 和
和 两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于
两种活性位点,两种活性位点分别带不同电性的电荷。肼中的氢原子吸附于 ”或“
”或“ ”)活性位点。已知:
”)活性位点。已知: 键、
键、 键的键能分别是
键的键能分别是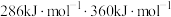 。肼在该催化剂表面反应断裂的化学键不是
。肼在该催化剂表面反应断裂的化学键不是 键,而是
键,而是 键,原因是
键,原因是③催化剂存在下,不同浓度的
 分解时,测得
分解时,测得 随时间的变化如下图所示。当
随时间的变化如下图所示。当 浓度从
浓度从 增加到
增加到 时,反应速率加快;从
时,反应速率加快;从 增加到
增加到 时,反应速率几乎不变。其原因是
时,反应速率几乎不变。其原因是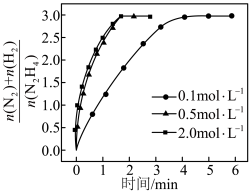
您最近一年使用:0次
7日内更新
|
61次组卷
|
2卷引用:江苏省无锡市锡东高级中学2023-2024学年高三下学期5月月考化学试题



