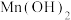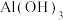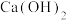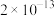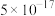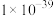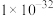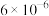1 . 工业废气、汽车尾气排放的氮氧化物、二氧化硫等是形成雾霾的主要物质,需要进行综合治理。
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目___________ 。
处理汽车尾气的反应为: △H
△H
2.已知:CO的燃烧热△H1=-283.0kJ·mol-1
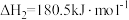
则△H=___________ 。该反应的△S___________ 0(填“>”或“<”)。
3.上述反应自发进行的条件是
工业上对二氧化硫的处理有多种方法。I:用NaOH溶液或氨水吸收废气中少量SO2气体,以防污染环境。4.若用0.1mol·L-1的NaOH溶液或同浓度的氨水处理相同量的废气,两种方法所需吸收液的体积关系是___________
5.用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化如下表所示。
根据以上信息推断NaHSO3溶液的酸碱性,结合方程式解释其原因:___________ 。
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO ]的值将
]的值将___________ 。
A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:___________ 。
己知: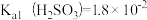 ,
,
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目
处理汽车尾气的反应为:
 △H
△H2.已知:CO的燃烧热△H1=-283.0kJ·mol-1

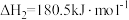
则△H=
3.上述反应自发进行的条件是
| A.任何温度 | B.任何温度都不能 | C.高温 | D.低温 |
| A.NaOH溶液的体积大于氨水 | B.NaOH溶液的体积等于氨水 |
| C.NaOH溶液的体积小于氨水 | D.无法判断 |
n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,溶液中c(HSO )增大 )增大 |
B.加入少量Na2SO3固体,则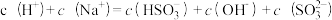 |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
D.加入氨水至中性,则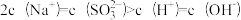 |
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO
 ]的值将
]的值将A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO
 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:己知:
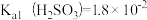 ,
,
您最近一年使用:0次
2 . Ⅰ.高铁酸钾(K2FeO4) 是一种高效、无毒的强氧化剂,常温下为紫色固体,微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体。稳定性随pH的下降而减弱,酸性条件下易分解。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
Ⅱ.K2FeO4的净水原理如图所示:
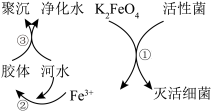
(2)下列说法错误的是___________
(3)写出K2FeO4与水反应的化学方程式___________ 。
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:
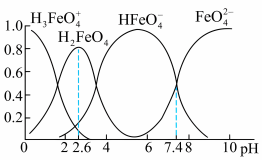
(4)①为获得尽可能纯净的高铁酸盐,pH应控制在___________ 。
②写出在此条件下,反应的离子方程式:___________ ;每生成39.6g K2FeO4,转移的电子数目为___________ ;
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
注:上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而___________ (填“增强”、“减弱”或“不变”);
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:___________ ;
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:___________ 。
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:___________ (写出计算过程)。
(1)下列有关铁及其化合物的性质与用途具有对应关系的是___________
| A.铁粉具有还原性,可防止食物氧化变质 | B.高铁酸钾能溶于水,可作氧化剂 |
| C.氢氧化铁胶体具有碱性,可用于净水 | D.纯铁无杂质,可用作建筑材料 |
Ⅱ.K2FeO4的净水原理如图所示:

(2)下列说法错误的是___________
| A.K2FeO4中铁元素显+6价 |
| B.过程①中K2FeO4被细菌还原 |
| C.过程②中的Fe(OH)3胶体粒子带正电荷 |
| D.过程③中聚沉是由于胶体发生了渗析 |
(3)写出K2FeO4与水反应的化学方程式
Ⅲ.已知可用Cl2与Fe(NO3)3制备K2FeO4(含副产品KCl、KNO3),查阅资料得知高铁酸盐在水溶液中有四种含铁形体。25℃时,它们的物质的量分数随pH的变化如图所示:

(4)①为获得尽可能纯净的高铁酸盐,pH应控制在
②写出在此条件下,反应的离子方程式:
(5)已知溶液的酸碱性及离子浓度会对反应试剂的氧化性、还原性产生影响。
某实验小组研究不同反应试剂对K2FeO4产率的影响,对比实验如下:
| 实验编号 | 反应试剂 | 实验现象 |
| Ⅰ | Cl2、FeCl3和少量KOH | 无明显现象 |
| Ⅱ | Cl2、FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Cl2、Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①由实验I、II的现象可知,Fe3+的还原性随溶液碱性的增强而
②实验II中K2FeO4的产率比实验III低,试解释其可能的原因:
③向实验II所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅,试解释其可能的原因:
(6)实验室测定含少量杂质的K2FeO4样品的纯度:称取0.1500g K2FeO4样品溶于碱性KI溶液中,调节pH至弱酸性使混合液充分反应。用0.1000 mol·L−1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液25.00 mL。滴定时,发生反应的离子方程式:FeO
 + 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O
+ 4I−+ 8H+= Fe2+ + 2I2+ 4H2O;I2 + 2S2O = S4O
= S4O + 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
+ 2I−。已知:M(K2FeO4) =198g·mol−1,试计算K2FeO4样品的纯度:
您最近一年使用:0次
名校
3 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室沿用舍勒的方法制取 时选用图中装置
时选用图中装置_______ (填“A”或“B”),反应的离子方程式为_______ ,装置B中管f的作用是_______ 。
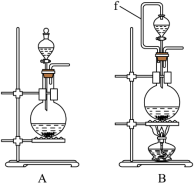
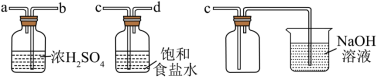
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→_______ (填字母)。
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
【提出猜想】
猜想1: 降低,氧化剂
降低,氧化剂_______ (填化学式)氧化性减弱。
猜想2:_______ 减弱。
猜想3: 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式:_______ 。
(1)实验室沿用舍勒的方法制取
 时选用图中装置
时选用图中装置
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→
(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸。小组同学探究不继续产生
和盐酸。小组同学探究不继续产生 的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。
的原因。查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱。【提出猜想】
猜想1:
 降低,氧化剂
降低,氧化剂猜想2:
猜想3:
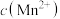 增大,氧化剂氧化性减弱。
增大,氧化剂氧化性减弱。【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,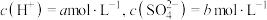 | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使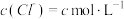 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使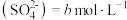 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 。请配平该反应的方程式:
。请配平该反应的方程式: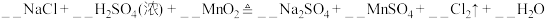
您最近一年使用:0次
2024-01-07更新
|
654次组卷
|
4卷引用:江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题
江西省上饶市清源学校2023-2024学年高三上学期12月考试化学试题(已下线)期末测试卷01-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)河南省新乡市原阳县第一高级中学2023-2024学年高一上学期1月月考化学试题
名校
解题方法
4 . 镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工艺流程如下:
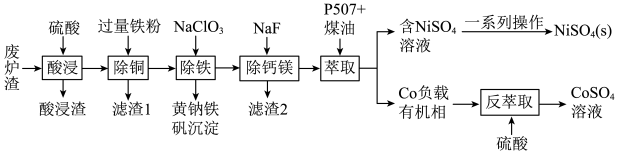
已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是___________ 。(写化学式)
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为___________ 。
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是___________ (结合平衡理论解释)。Ca2+和Mg2+沉淀完全时,溶液中F-的浓度c(F-)最小为___________ mol·L-1。[已知离子浓度≤10-5mol/L时,认为该离子沉淀完全,Ksp(CaF2)=1.0×10-10(mol/L)3,Ksp(MgF2)=7.5×10-11(mol/L)3]
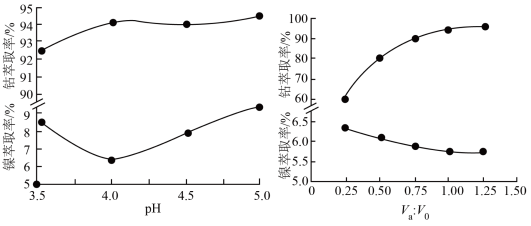
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为___________ 、___________ 。
(5)获得NiSO4(s)的“一系列操作”是___________ 。
(6)该工艺流程中,可循环利用的物质是___________ 。

已知:i.酸浸液中的金属阳离子有Ni2+、Co2+、Cu2+、Mg2+、Ca2+等
ii.NiSO4在水中的溶解度随温度升高而增大
回答下列问题:
(1)“滤渣1”的主要成分是
(2)黄钠铁矾的化学式为Na2Fe6(SO4)4(OH)12,“除铁”的离子方程式为
(3)“除钙镁”时,随pH降低,NaF用量急剧增加,原因是
(4)镍、钴萃取率与料液pH、萃取剂体积与料液体积比Va:V0的关系曲线如下图所示,则“萃取”时应选择的pH和Va:V0分别为

(5)获得NiSO4(s)的“一系列操作”是
(6)该工艺流程中,可循环利用的物质是
您最近一年使用:0次
2023-12-27更新
|
593次组卷
|
4卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
山东省实验中学2023-2024学年高三上学期11月二诊化学试题山东省淄博市部分学校2023-2024学年高三上学期联考化学试卷(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)广东省深圳市实验学校高中部2023-2024学年高二上学期第三阶段考试化学试题
2022·北京·高考真题
5 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
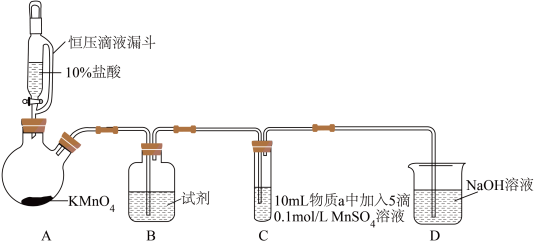
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
708次组卷
|
29卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题
23-24高一上·湖北武汉·阶段练习
6 . 含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______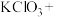 _______
_______ ______
______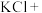 _______
_______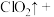 _______
_______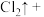 ______(________)
______(________) ___________
若反应生成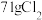 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: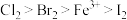 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: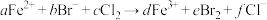 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①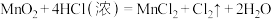
②
③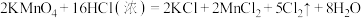
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
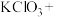 _______
_______ ______
______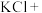 _______
_______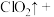 _______
_______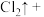 ______(________)
______(________) 若反应生成
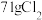 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
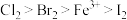 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: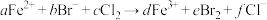 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
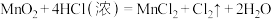
②

③
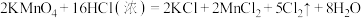
④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
2023-10-11更新
|
796次组卷
|
3卷引用:结构与性质
名校
解题方法
7 . 向仅含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法错误的是
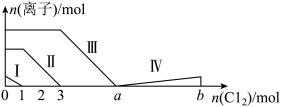

| A.线段Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表I-、Fe2+、Br-、HIO3的变化情况 |
| B.Fe2+、I-和Br-的物质的量之比为1∶2∶3 |
| C.根据图像可计算b=11 |
| D.线段Ⅳ对应的反应中氧化剂和还原剂的物质的量之比是5∶1 |
您最近一年使用:0次
2023-08-14更新
|
485次组卷
|
3卷引用:河北省迁安市第一中学2022-2023学年高三上学期期中考试化学试题
2023高三·全国·专题练习
解题方法
8 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为_______ 。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_______ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是_______ mg·L-1。
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。
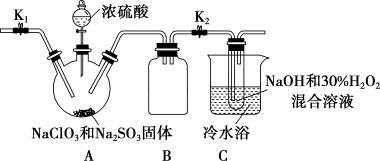
①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:_______ 。
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是_______ 。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原NaClO3,可较安全地生成ClO2,反应的离子方程式为
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法做如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50 L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4 mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00 mL。该水样中ClO2的浓度是
(3)某学习小组设计如下装置制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式:
②将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。装置B的作用是
您最近一年使用:0次
解题方法
9 . 电解金属锰阳极渣(主要成分MnO2,杂质为PbCO3、Fe2O3、CuO)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
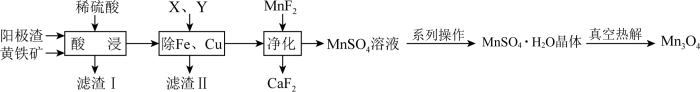
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、______ (填化学式)。
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。
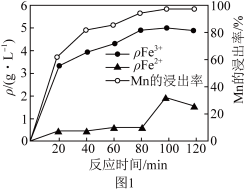
20~80min,浸出Mn元素的主要离子方程式为______ 。80~100min时,Fe2+浓度上升的原因可能是______ 。
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为______ (填序号)。
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
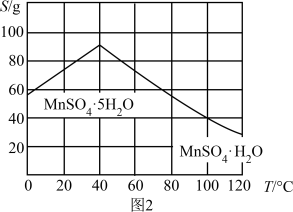
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为______ 、洗涤、干燥。
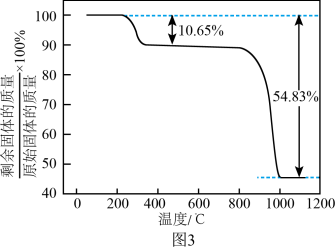
(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为______ 。
(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是______ 。

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:Fe3+ 3.7,Fe2+ 9.7,Cu2+ 7.4,Mn2+ 9.8
回答下列问题:
(1)“酸浸”过程中,滤渣Ⅰ的主要成分为S、
(2)“酸浸”过程中Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图1所示。

20~80min,浸出Mn元素的主要离子方程式为
(3)“除Fe、Cu”过程中依次加入的试剂X、Y为
A.NH3•H2O、H2O2 B.H2O2、CaCO3 C.SO2、MnCO3
(4)硫酸锰晶体的溶解度曲线如图2,由MnSO4溶液获得MnSO4•H2O晶体的系列操作为

(5)“真空热解”过程中,测得固体的质量随温度变化如图3所示。需控制的温度为

(6)由MnSO4溶液制取Mn3O4的另一种方案是:向MnSO4溶液中加入氨水,产生Mn(OH)2沉淀和少量Mn2(OH)2SO4,滤出,洗净,加水打成浆,浆液边加热边持续通空气,制得Mn3O4。沉淀加热通空气过程中,7小时之前,溶液的pH=6,7小时之后迅速下降,原因是
您最近一年使用:0次
2023-04-27更新
|
856次组卷
|
2卷引用:山东省泰安市2023届高三下学期二模考试化学试题
解题方法
10 . 锰酸锂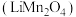 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的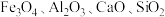 )为原料制备锰酸锂的流程如下:
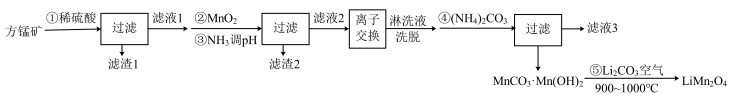
)为原料制备锰酸锂的流程如下:
已知:I. 时,相关物质的
时,相关物质的 如下表:
如下表:
II. 时,
时, 电离常数
电离常数
III.离子浓度低于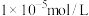 时即为沉淀完全
时即为沉淀完全
回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质 反应的离子方程式
反应的离子方程式___________ 。
(2)滤渣1的成分是_____ (填化学式);步骤②加入 的目的是
的目的是____ 。
(3)步骤③加入 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为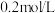 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为_______ 。反应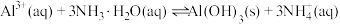 的平衡常数
的平衡常数
________ 。
(4)“离子交换”步骤和“洗脱”过程是利用反应: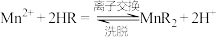 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用_____ 。
(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有___________ (填化学式)。
(6)步骤⑤反应的化学方程式为___________ 。
 是一种锂电池的正极材料。工业上以方锰矿(主要成分为
是一种锂电池的正极材料。工业上以方锰矿(主要成分为 ,还含有少量的
,还含有少量的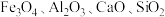 )为原料制备锰酸锂的流程如下:
)为原料制备锰酸锂的流程如下:
已知:I.
 时,相关物质的
时,相关物质的 如下表:
如下表:物质 |
|
|
|
|
|
|
|
|
|
|
|
 时,
时, 电离常数
电离常数
III.离子浓度低于
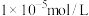 时即为沉淀完全
时即为沉淀完全回答下列问题:
(1)写出步骤①溶于稀硫酸时杂质
 反应的离子方程式
反应的离子方程式(2)滤渣1的成分是
 的目的是
的目的是(3)步骤③加入
 目的是除去杂质离子,若溶液中
目的是除去杂质离子,若溶液中 浓度为
浓度为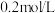 ,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控
,要确保杂质离子沉淀完全,同时不降低产品产率,步骤③调控 的范围应该为
的范围应该为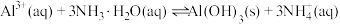 的平衡常数
的平衡常数
(4)“离子交换”步骤和“洗脱”过程是利用反应:
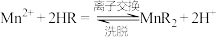 (
( 是氢型交换树脂)的平衡移动将
是氢型交换树脂)的平衡移动将 进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用
进一步提纯,为了提高洗脱效率,又不引入其他杂质,淋洗液应选用(5)步骤④反应未见气体生成,则该反应留存在滤液3中的产物有
(6)步骤⑤反应的化学方程式为
您最近一年使用:0次
2023-01-13更新
|
1133次组卷
|
2卷引用:四川省绵阳市2023届高三第二次诊断性考试理科综合化学试题