工业废气、汽车尾气排放的氮氧化物、二氧化硫等是形成雾霾的主要物质,需要进行综合治理。
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目___________ 。
处理汽车尾气的反应为: △H
△H
2.已知:CO的燃烧热△H1=-283.0kJ·mol-1
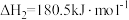
则△H=___________ 。该反应的△S___________ 0(填“>”或“<”)。
3.上述反应自发进行的条件是
工业上对二氧化硫的处理有多种方法。I:用NaOH溶液或氨水吸收废气中少量SO2气体,以防污染环境。4.若用0.1mol·L-1的NaOH溶液或同浓度的氨水处理相同量的废气,两种方法所需吸收液的体积关系是___________
5.用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化如下表所示。
根据以上信息推断NaHSO3溶液的酸碱性,结合方程式解释其原因:___________ 。
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO ]的值将
]的值将___________ 。
A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:___________ 。
己知: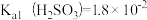 ,
,
烟气中的NO2可以用Na2SO3溶液吸收:

1.配平上述方程式,标出电子转移的方向和数目
处理汽车尾气的反应为:
 △H
△H2.已知:CO的燃烧热△H1=-283.0kJ·mol-1

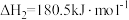
则△H=
3.上述反应自发进行的条件是
| A.任何温度 | B.任何温度都不能 | C.高温 | D.低温 |
| A.NaOH溶液的体积大于氨水 | B.NaOH溶液的体积等于氨水 |
| C.NaOH溶液的体积小于氨水 | D.无法判断 |
n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
6.向0.1mol。L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,溶液中c(HSO )增大 )增大 |
B.加入少量Na2SO3固体,则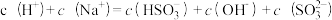 |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
D.加入氨水至中性,则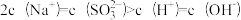 |
Ⅱ:采用低温臭氧氧化脱硫脱硝技术,可以同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
7.向(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,[NH4]+/[SO
 ]的值将
]的值将A.变大 B.变小 C.不变
III:SO2还可以用石灰水来吸收,生成亚硫酸钙浊液。
8.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO
 的第二步水解,计算求出Ksp(CaSO3)的数值:
的第二步水解,计算求出Ksp(CaSO3)的数值:己知:
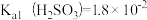 ,
,
更新时间:2024-05-09 16:59:20
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】绿色植物标本用醋酸铜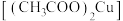 处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
I.醋酸铜晶体的制备
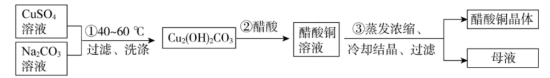
(1)①中控制温度为40-60度的原因是_______ 。
(2)②中化学方程式是_______ 。
(3)③中采用的实验方法依据醋酸铜的性质是_______ 。
Ⅱ.测定产品中铜的含量
i.取 醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量
醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量 溶液,产生
溶液,产生 沉淀,溶液呈棕黄色;
沉淀,溶液呈棕黄色;
ii.用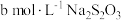 标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用
标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用 标准溶液滴定至蓝色近于消失:
标准溶液滴定至蓝色近于消失:
iii.向所得浊液中加入 溶液,充分摇动,溶液蓝色加深:
溶液,充分摇动,溶液蓝色加深:
iv.继续用 标准溶液滴定iii中浊液至终点,消耗标准溶液
标准溶液滴定iii中浊液至终点,消耗标准溶液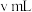 。
。
已知:① ,
, 溶液和
溶液和 溶液颜色均为无色;
溶液颜色均为无色;
②常温下,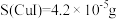
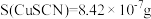
③ 易吸附
易吸附 ,
, 不吸附
不吸附 。被吸附的
。被吸附的 不与淀粉显色。
不与淀粉显色。
(4) i中发生反应的离子方程式是_______ 。
(5)结合平衡原理解释i中加入 的目的
的目的_______ 。
(6)醋酸铜产品中铜元素的质量分数是_______ 。
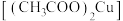 处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。I.醋酸铜晶体的制备

(1)①中控制温度为40-60度的原因是
(2)②中化学方程式是
(3)③中采用的实验方法依据醋酸铜的性质是
Ⅱ.测定产品中铜的含量
i.取
 醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量
醋酸铜产品于具塞锥形瓶中,用稀醋酸溶解,加入过量 溶液,产生
溶液,产生 沉淀,溶液呈棕黄色;
沉淀,溶液呈棕黄色;ii.用
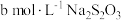 标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用
标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用 标准溶液滴定至蓝色近于消失:
标准溶液滴定至蓝色近于消失:iii.向所得浊液中加入
 溶液,充分摇动,溶液蓝色加深:
溶液,充分摇动,溶液蓝色加深:iv.继续用
 标准溶液滴定iii中浊液至终点,消耗标准溶液
标准溶液滴定iii中浊液至终点,消耗标准溶液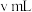 。
。已知:①
 ,
, 溶液和
溶液和 溶液颜色均为无色;
溶液颜色均为无色;②常温下,
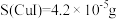
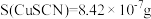
③
 易吸附
易吸附 ,
, 不吸附
不吸附 。被吸附的
。被吸附的 不与淀粉显色。
不与淀粉显色。(4) i中发生反应的离子方程式是
(5)结合平衡原理解释i中加入
 的目的
的目的(6)醋酸铜产品中铜元素的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】NaClO溶液具有漂白能力,已知25℃时, ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。
(1)NaClO的电子式是_____ ,次氯酸钠溶液中离子浓度大小顺序是:_____ 。
(2)下列关于NaClO溶液说法正确的是_____(双选)。
(3)25℃, 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]_____ 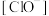 (填<,>或=)。
(填<,>或=)。
(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
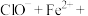


 。
。
①_____ 。
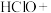


 +
+ 。
。
②_____ 。
(5)已知
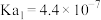 ,
,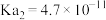 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:_____ 。
 ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。| 变化曲线 | 实验现象 |
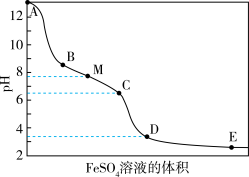 | ⅰ.A→B产生红褐色沉淀 ⅱ.B→C红褐色沉淀的量增多 ⅲ.C→D红褐色沉淀的量增多 ⅳ.D点附近产生有刺激性气味的气体 ⅴ.D→E红褐色沉淀的量略有增多 |
(2)下列关于NaClO溶液说法正确的是_____(双选)。
A.0.01mol/L溶液中, |
B.长期露置在空气中,释放 ,漂白能力减弱 ,漂白能力减弱 |
C.通入过量 ,反应的离子方程式为 ,反应的离子方程式为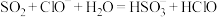 |
D.25℃, 的NaClO和HClO的混合溶液中, 的NaClO和HClO的混合溶液中, |
 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]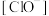 (填<,>或=)。
(填<,>或=)。(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
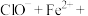


 。
。①
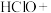


 +
+ 。
。②
(5)已知

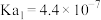 ,
,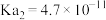 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原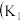 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: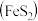 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原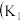 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
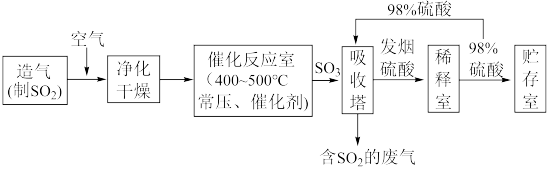
 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(1)Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234KJ/mol
CO2(g)+2Fe(s) ΔH=+234KJ/mol
C(s)+O2(g)=CO2(g)ΔH=-393.5KJ/mol
则2Fe(s)+ O2(g)=Fe2O3(s)的ΔH是
O2(g)=Fe2O3(s)的ΔH是____________________
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为_____________ ;
②达平衡后,若温度升高,CO的含量增大,则Q____ 0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为________(填序号)。

(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)=__________ :_________ :_________ 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是_______(填序号)。

(1)Fe2O3(s)+
 C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234KJ/mol
CO2(g)+2Fe(s) ΔH=+234KJ/molC(s)+O2(g)=CO2(g)ΔH=-393.5KJ/mol
则2Fe(s)+
 O2(g)=Fe2O3(s)的ΔH是
O2(g)=Fe2O3(s)的ΔH是(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:

①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为
②达平衡后,若温度升高,CO的含量增大,则Q
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为________(填序号)。

| A.小于l | B.4左右 | C.大于6 | D.大于9 |
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是_______(填序号)。

| A.电极X的材料是Fe |
| B.电解质溶液Y是AgNO3溶液 |
| C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
| D.原电池工作时,X电极反应为:O2+2H2O+4e-→4OH- |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】二甲醚具有巨大的潜在市场,目前采用的二氧化碳有效转化法,既是生成二甲醚的简便方法,又是实现“碳中和”的重要途径。
I.CO2催化加氢合成二甲醚是一种CO2的转化方法,其过程中发生的反应如下:
反应①: △H1=+41.2kJ·mol-1 K1
△H1=+41.2kJ·mol-1 K1
反应②: △H2=-204.9kJ·mol-1 K2
△H2=-204.9kJ·mol-1 K2
(1)CO2催化加氢合成二甲醚的热化学方程式为_______________ ,该反应的平衡常数为_______________ (用K1、K2表示)。
(2)在恒压、CO2和H2的起始量一定的条件下,发生反应①和(1)中反应,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。当温度低于300℃时,CO2的平衡转化率随温度的上升而下降的原因是_______________ 。
反应③: △H3<0
△H3<0
反应④: △H4>0
△H4>0
(3)在不同的压强下,按照投料比n(CO2):n(H2)=1:3只进行反应③,CH3OH的平衡产率随温度的变化关系如图甲所示,pH压强下,CO2的转化率随温度变化如图乙所示。
_______________ ,图乙中处于平衡状态的点有_______________ (填字母),CO2的转化率呈图乙所示变化的原因是_______________ 。
(4)更换高效的催化剂,体系中CH3OCH3平衡时的物质的量将_______________ (填“增加”“不变”或“减少”)。
(5)在280℃、3.4MPa条件下,通入1molCO2和3molH2的混合气体,用该方法制备二甲醚。充分反应后,测得CO2的平衡转化率为30%,体系中CH3OCH3的物质的量为0.1mol,则反应③的压强平衡常数Kp=_______________ MPa-2(列出计算式即可)。
I.CO2催化加氢合成二甲醚是一种CO2的转化方法,其过程中发生的反应如下:
反应①:
 △H1=+41.2kJ·mol-1 K1
△H1=+41.2kJ·mol-1 K1反应②:
 △H2=-204.9kJ·mol-1 K2
△H2=-204.9kJ·mol-1 K2(1)CO2催化加氢合成二甲醚的热化学方程式为
(2)在恒压、CO2和H2的起始量一定的条件下,发生反应①和(1)中反应,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。当温度低于300℃时,CO2的平衡转化率随温度的上升而下降的原因是

反应③:
 △H3<0
△H3<0反应④:
 △H4>0
△H4>0(3)在不同的压强下,按照投料比n(CO2):n(H2)=1:3只进行反应③,CH3OH的平衡产率随温度的变化关系如图甲所示,pH压强下,CO2的转化率随温度变化如图乙所示。
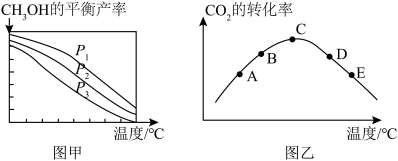
(4)更换高效的催化剂,体系中CH3OCH3平衡时的物质的量将
(5)在280℃、3.4MPa条件下,通入1molCO2和3molH2的混合气体,用该方法制备二甲醚。充分反应后,测得CO2的平衡转化率为30%,体系中CH3OCH3的物质的量为0.1mol,则反应③的压强平衡常数Kp=
您最近一年使用:0次
【推荐3】丙烯是重要的化工原料,可以用于生产丙醇,卤代烃和塑料。因此生产丙烯具有重要的经济效益和社会价值。用二氧化碳氧化丙烷可以制丙烯,丙烷经催化脱氢也可制备丙烯:C3H8 C3H6+H2。
C3H6+H2。
(1)用二氧化碳氧化丙烷制丙烯主要反应如下:
I.C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/mol
C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/mol
II.CO2(g)+H2(g) CO(g)+H2O(g) ∆H2=-76 kJ/mol
CO(g)+H2O(g) ∆H2=-76 kJ/mol
III.丙烷经催化脱氢制丙烯的热化学方程式为:___________ 。
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,在600℃时经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。
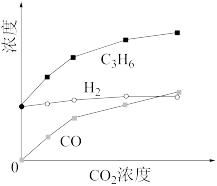
根据上图分析,如果只根据反应III C3H8(g) C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:
C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:___________ ;其他条件不变,投料比c(C3H8)/c(CO2)越大,C3H8转化率___________ (填“越大”,“越小”,“无影响”),该反应的平衡常数___________ (填“增大”,“减小”,“不变”)。
(3)C3H8(g) C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
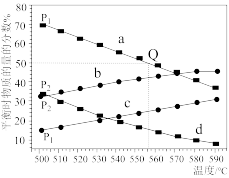
图中a,b,c,d代表丙烷或丙烯,则a,d代表___________ ,P1___________ P2(填“大于”“小于”“等于”);若P1=0.2MPa,起始时充入一定量的丙烷在恒压条件下发生反应,计算Q点对应温度下丙烷的转化率为___________ (保留一位小数),该反应的平衡常数KP=___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
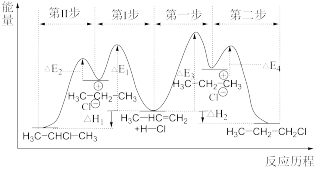
(4)丙烯与HCl发生加成反应,生成CH3CHClCH3和CH3CH2CH2Cl两种产物,其能量与反应历程如图所示。其中正确的说法是___________。
 C3H6+H2。
C3H6+H2。(1)用二氧化碳氧化丙烷制丙烯主要反应如下:
I.C3H8(g)+CO2(g)
 C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/mol
C3H6(g)+CO(g)+H2O(g) ∆H1=+47 kJ/molII.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2=-76 kJ/mol
CO(g)+H2O(g) ∆H2=-76 kJ/molIII.丙烷经催化脱氢制丙烯的热化学方程式为:
(2)将一定浓度的CO2与固定浓度的C3H8通过含催化剂的恒容反应器,在600℃时经相同时间,流出的C3H6、CO和H2浓度随初始CO2浓度的变化关系如图。

根据上图分析,如果只根据反应III C3H8(g)
 C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:
C3H6(g)+H2(g),生成的C3H6、H2的浓度随CO2浓度变化趋势应该是一致的,但是氢气的变化不明显,反而是CO与C3H6的变化趋势是一致的,推测可能的原因:(3)C3H8(g)
 C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
C3H6(g)+H2(g)在不同温度下达到平衡,在总压强分别为P1和P2时,测得丙烷及丙烯的物质的量分数如图所示:
图中a,b,c,d代表丙烷或丙烯,则a,d代表
(4)丙烯与HCl发生加成反应,生成CH3CHClCH3和CH3CH2CH2Cl两种产物,其能量与反应历程如图所示。其中正确的说法是___________。

| A.丙烯与HCl发生的反应是放热反应,所以能自发进行 |
| B.合成CH3CHClCH3的反应中,第I步反应为整个反应的决速步骤 |
| C.从能量角度看,较稳定的产物是CH3CHClCH3 |
| D.总反应CH2=CH-CH3(g)+HCl(g)=CH3CH2CH2Cl(g)的∆H=∆E3-∆E4 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】铁、氯、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2________ HClO(填“>”“=”或“<”);在pH=5的上述处理过的饮用水中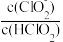 =
=___________ ;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________ 。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为____________ (当溶液中金属离子浓度≤10-5mol·L-1时,可认为沉淀完全)。
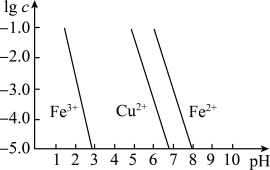
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=______________________ 。
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________________ ;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时的S2-浓度为___________________________ 。已知:Ksp(FeS)=6.3×10-18;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-18。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2
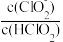 =
=(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为

②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
回答下列问题:
(1)A装置仪器b的名称是___________ ,E装置中的试剂是_________________ 。
(2)装置A中发生反应的离子方程式为________ 。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是______________________________ 。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为:___ 。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是______ 。
(6)利用如图装置测定所得TiCl4的纯度:

取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色, TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl
①滴定终点的判断方法是______________________ 。
②产品的纯度为___________ (用含w、c和V的代数式表示)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)A装置仪器b的名称是
(2)装置A中发生反应的离子方程式为
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为:
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是
(6)利用如图装置测定所得TiCl4的纯度:

取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色, TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl
①滴定终点的判断方法是
②产品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
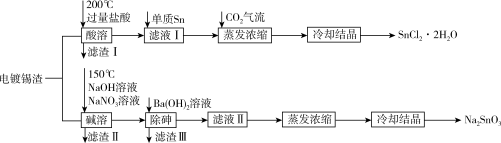
【推荐3】锡是大名鼎鼎的“五金”之一,早在远古时代人们便发现并加以利用。现从电镀锡渣(主要成分为Sn、SnO,含有砷和难溶于酸碱的杂质)中制取二水合氯化亚锡和锡酸钠,工艺流程如图所示:
已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是____ 。
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为_______ 。
(3)“酸溶”时SnO发生反应的离子方程式为____ 。在CO2气流中蒸发浓缩的目的是_____ 。
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式_______ 。
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有_______ 。
(6)“除砷”时,若溶液中c( )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为_______ 。
(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是_______ 。

已知:①Sn(Ⅱ)具有还原性,可与Cl-形成[SnCl3]-;②As在碱溶时转化为Na3AsO4溶液;③20℃时,Ksp[Ba3(AsO4)2]=2.7×10-10
回答下列问题:
(1)在自然界中,锡很少以游离态存在但是远古时期人们已经会冶炼Sn,采用的方法是
(2)SnCl2溶液可用作电镀锡的电解液,阴极的电极反应式为
(3)“酸溶”时SnO发生反应的离子方程式为
(4)“碱溶”时的还原产物是空气的主要成分之一,写出Sn在该步骤中发生反应的化学方程式
(5)“滤液I”中,需加入少量单质Sn,原因除了防止Sn(Ⅱ)被氧化,还有
(6)“除砷”时,若溶液中c(
 )=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为
)=4mol/L,加入等体积的Ba(OH)2溶液后,“滤液II”中c(Ba2+)=3×l0-3mol/L,则沉淀中的As元素占原As元素总量的百分数为(7)蒸发浓缩“滤液Ⅱ”前,可往体系中加入适量的NaOH溶液,目的是
您最近一年使用:0次



