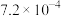NaClO溶液具有漂白能力,已知25℃时, ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。
(1)NaClO的电子式是_____ ,次氯酸钠溶液中离子浓度大小顺序是:_____ 。
(2)下列关于NaClO溶液说法正确的是_____(双选)。
(3)25℃, 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]_____ 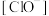 (填<,>或=)。
(填<,>或=)。
(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
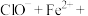


 。
。
①_____ 。
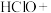


 +
+ 。
。
②_____ 。
(5)已知
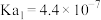 ,
,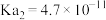 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:_____ 。
 ,向含有NaOH的NaClO溶液中逐滴滴入
,向含有NaOH的NaClO溶液中逐滴滴入 溶液,滴加过程中溶液的pH随
溶液,滴加过程中溶液的pH随 溶液的体积的变化曲线及实验现象见下表。
溶液的体积的变化曲线及实验现象见下表。| 变化曲线 | 实验现象 |
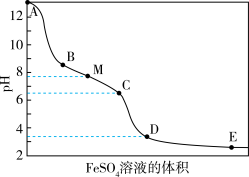 | ⅰ.A→B产生红褐色沉淀 ⅱ.B→C红褐色沉淀的量增多 ⅲ.C→D红褐色沉淀的量增多 ⅳ.D点附近产生有刺激性气味的气体 ⅴ.D→E红褐色沉淀的量略有增多 |
(2)下列关于NaClO溶液说法正确的是_____(双选)。
A.0.01mol/L溶液中, |
B.长期露置在空气中,释放 ,漂白能力减弱 ,漂白能力减弱 |
C.通入过量 ,反应的离子方程式为 ,反应的离子方程式为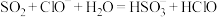 |
D.25℃, 的NaClO和HClO的混合溶液中, 的NaClO和HClO的混合溶液中, |
 的NaClO和HClO的混合溶液中,[HClO]
的NaClO和HClO的混合溶液中,[HClO]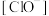 (填<,>或=)。
(填<,>或=)。(4)A→B,C→D过程溶液的pH值下降的原因可用下面的方程式来解释,请推测方框里的物质并在横线上写出完整的方程式并配平:
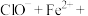


 。
。①
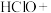


 +
+ 。
。②
(5)已知

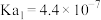 ,
,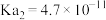 ,少量
,少量 通入NaClO溶液中发生的离子反应方程式为:
通入NaClO溶液中发生的离子反应方程式为:
更新时间:2023-06-27 09:30:42
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。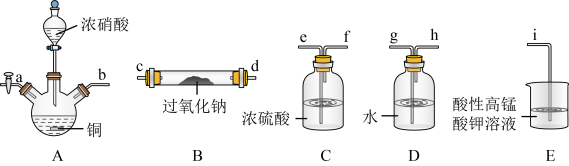
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图:
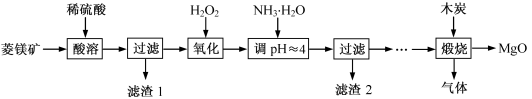
(1)MgCO3与稀硫酸反应的离子方程式为____ 。
(2)加入H2O2氧化时,发生反应的化学方程式为____ 。
(3)滤渣2的成分是____ (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;
MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是____ (填化学式)。
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:____ 。

(1)MgCO3与稀硫酸反应的离子方程式为
(2)加入H2O2氧化时,发生反应的化学方程式为
(3)滤渣2的成分是
(4)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑;
2MgO+2SO2↑+CO2↑;MgSO4+C
 MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;MgSO4+3C
 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。利用如图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体是
②A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】锡烟尘(主要含ZnO、 、SnO、
、SnO、 、
、 、
、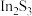 )氧压浸出分离回收金属的工艺流程如下:
)氧压浸出分离回收金属的工艺流程如下: 。请回答下列问题:
。请回答下列问题:
(1)“氧压浸出”过程中,生成单质S的离子方程式为_____ 。
(2)实验测得氧分压对Sn、In、Zn的浸出率影响如图所示:_____ ;最佳氧分压为_____ 。
(3)“萃取”过程中,发生反应 。
。
①“萃取”实验中,使用的硅酸盐仪器有_____ 。
②“萃余液Ⅰ”中含有的金属离子为_____ 。
(4)“反萃取”过程中将有机层 转移到水层,为使
转移到水层,为使 尽可能多地发生上述转移,可采取的措施为
尽可能多地发生上述转移,可采取的措施为_____ 。
(5)“反萃取”后,可先中和,再加入Zn粉置换,中和的目的是_____ ;已知常温下,“反萃取”后溶液中 的浓度为
的浓度为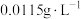 ,则中和时可调节pH的最大值为
,则中和时可调节pH的最大值为_____ 。
 、SnO、
、SnO、 、
、 、
、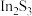 )氧压浸出分离回收金属的工艺流程如下:
)氧压浸出分离回收金属的工艺流程如下:
 。请回答下列问题:
。请回答下列问题:(1)“氧压浸出”过程中,生成单质S的离子方程式为
(2)实验测得氧分压对Sn、In、Zn的浸出率影响如图所示:

(3)“萃取”过程中,发生反应
 。
。①“萃取”实验中,使用的硅酸盐仪器有
②“萃余液Ⅰ”中含有的金属离子为
(4)“反萃取”过程中将有机层
 转移到水层,为使
转移到水层,为使 尽可能多地发生上述转移,可采取的措施为
尽可能多地发生上述转移,可采取的措施为(5)“反萃取”后,可先中和,再加入Zn粉置换,中和的目的是
 的浓度为
的浓度为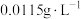 ,则中和时可调节pH的最大值为
,则中和时可调节pH的最大值为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:
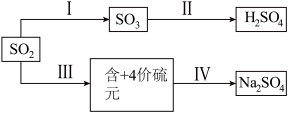
(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____ 。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____ 。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____ 。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、 和
和 )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____ (填字母)。
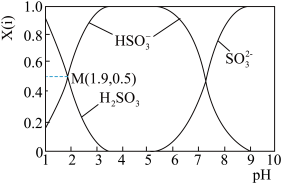
A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c( )>c(H2SO3)> c(
)>c(H2SO3)> c( )
)
C.由 M 点坐标,可以计算H2SO3⇌H++ 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c( )+2c(
)+2c( )+c(OH-)
)+c(OH-)
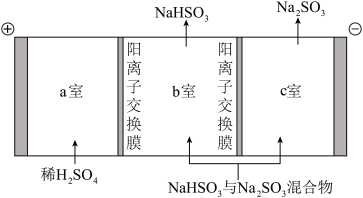
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____ 。
(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____ ,_____ (任意写两种)。

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程
 和
和 )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是
A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(
 )>c(H2SO3)> c(
)>c(H2SO3)> c( )
)C.由 M 点坐标,可以计算H2SO3⇌H++
 的电离常数
的电离常数D.pH=9 时,溶液中存在c(H+)=c(
 )+2c(
)+2c( )+c(OH-)
)+c(OH-)(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________ 。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______ 。已知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____ 。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________ ,当反应转移nmole-时,产生标准状况下的气体体积为__________________ 。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g) H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g) CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
计算表中x=____________ 。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________ 。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______ ,反应②的平衡常数为______ (保留两位有效数字)。
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)
 H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol②CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】Ⅰ.25℃,两种酸的电离平衡常数如右表。
(1)0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为________________
Ⅱ.某化学小组设计下列实验测定硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的标定浓度:
步骤1:取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加入2滴R溶液作指示剂,继续滴定至终点,消耗的体积为10.10mL.
步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL。
已知:①6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,其中Cr3+为绿色
②R溶液的变色原理:R(氧化型,紫红色) Q(还原性,无色)
Q(还原性,无色)
(3)该实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、___________ 、______________
(4)如何判断滴定达到终点:_______________________________
(5)步骤2的主要作用是________________
(6)硫酸亚铁铵溶液的标定浓度是___________ mol/L(保留三位有效数字)
(7)若滴定前锥形瓶中有水,对测定结果的影响是______ (填“偏大”、“偏小”或“无影响”)
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
Ⅱ.某化学小组设计下列实验测定硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的标定浓度:
步骤1:取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加入2滴R溶液作指示剂,继续滴定至终点,消耗的体积为10.10mL.
步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL。
已知:①6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,其中Cr3+为绿色
②R溶液的变色原理:R(氧化型,紫红色)
 Q(还原性,无色)
Q(还原性,无色)(3)该实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、
(4)如何判断滴定达到终点:
(5)步骤2的主要作用是
(6)硫酸亚铁铵溶液的标定浓度是
(7)若滴定前锥形瓶中有水,对测定结果的影响是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】CO2资源化利用能有效减小CO2排放,对碳循环经济技术的发展具有重要意义。
I.一种捕集烟气中CO2的过程如图所示。室温下以0.1mol·L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度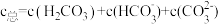 。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。
。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。

(1)KOH吸收CO2所得到的溶液中:c(H2CO3)_______ c( )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
(2)KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+_______
(3)KOH溶液吸收CO2,溶液中c总=0.1mol·L-1时,判断溶液的酸碱性并说明理由_______ 。
II.利用CO2和甲烷制备合成气(CO和H2),反应分以下两步进行(已知ΔH1>ΔH2>0):
反应①CH4(g)C(ads)+2H2(g) ΔH1
反应②C(ads)+CO2(g)2CO(g) ΔH2[附注:c(ads)为吸附性活性炭]
(4)总反应CH4(g)+CO2(g) 2CO(g)+2H2(g)能自发进行的条件是
2CO(g)+2H2(g)能自发进行的条件是_______ 。
(5)已知反应①的活化能Ea1大于反应②的活化能Ea2,在图中画出有关物质的相对能量与反应历程的变化图_______ 。

III.我国科学家研究Li-CO2电池,取得重大突破。该电池发生的原电池反应为:4Li+3CO2=2Li2CO3+C。
(6)在Li-CO2电池中,Li为单质锂片,是该原电池的________ (填“正”或“负”)极。
(7)CO2电还原过程依次按以下四个步骤进行,写出步骤I的电极反应式
i._______
ii. =
=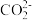 +CO2
+CO2
iii.CO2+2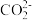 =2
=2 +C
+C
iv. +2Li+=Li2CO3
+2Li+=Li2CO3
I.一种捕集烟气中CO2的过程如图所示。室温下以0.1mol·L-1KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度
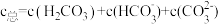 。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。
。H2CO3电离常数分别为Ka1=4.4×10-7、Ka2=4.4×10-11。
(1)KOH吸收CO2所得到的溶液中:c(H2CO3)
 )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(2)KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+
(3)KOH溶液吸收CO2,溶液中c总=0.1mol·L-1时,判断溶液的酸碱性并说明理由
II.利用CO2和甲烷制备合成气(CO和H2),反应分以下两步进行(已知ΔH1>ΔH2>0):
反应①CH4(g)C(ads)+2H2(g) ΔH1
反应②C(ads)+CO2(g)2CO(g) ΔH2[附注:c(ads)为吸附性活性炭]
(4)总反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)能自发进行的条件是
2CO(g)+2H2(g)能自发进行的条件是(5)已知反应①的活化能Ea1大于反应②的活化能Ea2,在图中画出有关物质的相对能量与反应历程的变化图

III.我国科学家研究Li-CO2电池,取得重大突破。该电池发生的原电池反应为:4Li+3CO2=2Li2CO3+C。
(6)在Li-CO2电池中,Li为单质锂片,是该原电池的
(7)CO2电还原过程依次按以下四个步骤进行,写出步骤I的电极反应式
i.
ii.
 =
=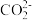 +CO2
+CO2iii.CO2+2
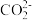 =2
=2 +C
+Civ.
 +2Li+=Li2CO3
+2Li+=Li2CO3
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】氰化氢( )分子被认为是生命起源中重要的中间体之一,主要应用于电镀业、采矿业等,可制造各种树脂单体。迄今为止,它所产生的与生物相关联的化合物种类最多。
)分子被认为是生命起源中重要的中间体之一,主要应用于电镀业、采矿业等,可制造各种树脂单体。迄今为止,它所产生的与生物相关联的化合物种类最多。
(1) 的合成
的合成
氰化氢可用甲烷氨氧化法合成,其热化学反应方程式为:
相关化学键的键能数据如下表:
上述反应的 为
为_________ ;
(2) 的性质
的性质
已知 时有关弱电解质的电离平衡常数如下表:
时有关弱电解质的电离平衡常数如下表:
① 具有酸性,能与氨水发生反应:
具有酸性,能与氨水发生反应: ,此反应在常温下的平衡常数K约为
,此反应在常温下的平衡常数K约为_________ ;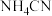 溶液呈
溶液呈_________ 性。
②已知可发生如下反应: ,
, ,
, ,则
,则 的电离平衡常数的范围为:
的电离平衡常数的范围为:_________ 。
③在 溶液中通入少量的二氧化碳,其离子反应方程式为:
溶液中通入少量的二氧化碳,其离子反应方程式为:_________ 。
④浓度均为 的
的 与
与 的混合溶液中,以下推断正确的是
的混合溶液中,以下推断正确的是_________ 。
A.混合溶液 约为9.3
约为9.3
B.
C.
(3) 和
和 的处理
的处理
① 是一种无色、有毒、易溶于水的气体,易在空气中均匀弥散,并易产生爆炸。国家重点实验室对密闭空间内的
是一种无色、有毒、易溶于水的气体,易在空气中均匀弥散,并易产生爆炸。国家重点实验室对密闭空间内的 气体进行了消毒研究,研究中采用
气体进行了消毒研究,研究中采用 气雾、
气雾、 气雾和水雾分别单独对
气雾和水雾分别单独对 进行消毒。由图可知
进行消毒。由图可知_________ 为最佳消毒试剂。

②工业生产中含氰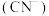 废水主要来源于选矿、有色金属冶炼等工业,对于含氰废水都应高度重视并妥善处理,国家关于废水中总氰浓度排放标准为
废水主要来源于选矿、有色金属冶炼等工业,对于含氰废水都应高度重视并妥善处理,国家关于废水中总氰浓度排放标准为 。某工厂实验室针对不同浓度焦亚硫酸钠
。某工厂实验室针对不同浓度焦亚硫酸钠 处理含氰废水情况展开研究。反应如下:
处理含氰废水情况展开研究。反应如下:

如图为氧化后 的浓度变化,如果你是工厂研究人员,你认为应选择多大浓度的
的浓度变化,如果你是工厂研究人员,你认为应选择多大浓度的 溶液最合理,请回答并说明理由
溶液最合理,请回答并说明理由___________________________ 。

 )分子被认为是生命起源中重要的中间体之一,主要应用于电镀业、采矿业等,可制造各种树脂单体。迄今为止,它所产生的与生物相关联的化合物种类最多。
)分子被认为是生命起源中重要的中间体之一,主要应用于电镀业、采矿业等,可制造各种树脂单体。迄今为止,它所产生的与生物相关联的化合物种类最多。(1)
 的合成
的合成氰化氢可用甲烷氨氧化法合成,其热化学反应方程式为:

相关化学键的键能数据如下表:
化学键 |
|
|
|
|
| 414 | 393 | 891 | 436.4 |
 为
为(2)
 的性质
的性质已知
 时有关弱电解质的电离平衡常数如下表:
时有关弱电解质的电离平衡常数如下表:弱电解质化学式 |
|
|
|
|
|
电离平衡常数 |
|
|
|
|
|
 具有酸性,能与氨水发生反应:
具有酸性,能与氨水发生反应: ,此反应在常温下的平衡常数K约为
,此反应在常温下的平衡常数K约为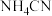 溶液呈
溶液呈②已知可发生如下反应:
 ,
, ,
, ,则
,则 的电离平衡常数的范围为:
的电离平衡常数的范围为:③在
 溶液中通入少量的二氧化碳,其离子反应方程式为:
溶液中通入少量的二氧化碳,其离子反应方程式为:④浓度均为
 的
的 与
与 的混合溶液中,以下推断正确的是
的混合溶液中,以下推断正确的是A.混合溶液
 约为9.3
约为9.3B.

C.

(3)
 和
和 的处理
的处理①
 是一种无色、有毒、易溶于水的气体,易在空气中均匀弥散,并易产生爆炸。国家重点实验室对密闭空间内的
是一种无色、有毒、易溶于水的气体,易在空气中均匀弥散,并易产生爆炸。国家重点实验室对密闭空间内的 气体进行了消毒研究,研究中采用
气体进行了消毒研究,研究中采用 气雾、
气雾、 气雾和水雾分别单独对
气雾和水雾分别单独对 进行消毒。由图可知
进行消毒。由图可知
②工业生产中含氰
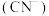 废水主要来源于选矿、有色金属冶炼等工业,对于含氰废水都应高度重视并妥善处理,国家关于废水中总氰浓度排放标准为
废水主要来源于选矿、有色金属冶炼等工业,对于含氰废水都应高度重视并妥善处理,国家关于废水中总氰浓度排放标准为 。某工厂实验室针对不同浓度焦亚硫酸钠
。某工厂实验室针对不同浓度焦亚硫酸钠 处理含氰废水情况展开研究。反应如下:
处理含氰废水情况展开研究。反应如下:
如图为氧化后
 的浓度变化,如果你是工厂研究人员,你认为应选择多大浓度的
的浓度变化,如果你是工厂研究人员,你认为应选择多大浓度的 溶液最合理,请回答并说明理由
溶液最合理,请回答并说明理由
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】肼(N2H4)是我国导弹和运载火箭中广泛使用的液体燃料之一,具有较强的还原性。某实验小组拟用NH3和NaClO溶液反应制备肼,装置如图所示,并探究肼的性质。

回答下列问题:
(1)装置A中的化学方程式为___________ 。装置C中滴入浓盐酸时使用恒压滴液漏斗的优点是___________ 。
(2)装置B中制备肼的化学方程式为___________ 。
(3)图示装置存在的两处缺陷是___________ 。
(4)探究性质:已知N2H4为二元弱碱,在水中的电离与NH3相似。请写出N2H4在水溶液中的第二步电离方程式:___________ ,肼与硫酸反应生成酸式盐的化学式为___________ ,反应后的水溶液中含有多种阳离子,其中阳离子N2H 的电子式为
的电子式为___________ 。
(5)常温下,向N2H4的水溶液中滴加盐酸,溶液的pH与离子浓度的变化关系如图所示,下列说法正确的是___________(填标号)。


回答下列问题:
(1)装置A中的化学方程式为
(2)装置B中制备肼的化学方程式为
(3)图示装置存在的两处缺陷是
(4)探究性质:已知N2H4为二元弱碱,在水中的电离与NH3相似。请写出N2H4在水溶液中的第二步电离方程式:
 的电子式为
的电子式为(5)常温下,向N2H4的水溶液中滴加盐酸,溶液的pH与离子浓度的变化关系如图所示,下列说法正确的是___________(填标号)。

| A.N2H4在水溶液中的第一步电离平衡常数为1.0×10-8 |
| B.N2H5Cl溶液显酸性 |
C.N2H +N2H4 +N2H4 2N2H5+的平衡常数为1.0×109 2N2H5+的平衡常数为1.0×109 |
D.N2H6Cl2溶液中:c(Cl-)=2c(N2H )+2c(N2H )+2c(N2H ) ) |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图所示。
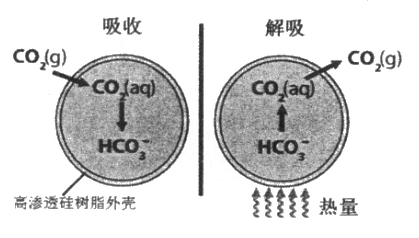
(1)这种微胶囊吸收CO2的原理是_____________ (用离子方程式解释),此过程是_______ (填“吸收”或“放出”)能量的过程。
(2)在吸收过程中关于胶囊内溶液下列说法正确的是_____________ 。
a. 吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b. 吸收过程中,体系中所有的含碳微粒是CO32-、HCO3-、H2CO3
c. 当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d. 溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将吸收的CO2催化加氢可制得乙烯。
已知:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H =-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。
C2H4(g)+4H2O(g) △H =-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。

①根据曲线a计算250℃时该反应的化学平衡常数K=_____________ (带入数值列出计算式即可)
②b条件下投料比n(H2)/n(CO2)______ 3(填“>”、“<”或“=”),判断依据是____________________________
③下列说法正确的是_____________ 。
a. 平衡常数大小:M=M1> N
b. 其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
c. 当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
d. 工业生产中采取较高温度(250 ℃左右)是为了提高催化剂活性加快反应速率。

(1)这种微胶囊吸收CO2的原理是
(2)在吸收过程中关于胶囊内溶液下列说法正确的是
a. 吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b. 吸收过程中,体系中所有的含碳微粒是CO32-、HCO3-、H2CO3
c. 当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d. 溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将吸收的CO2催化加氢可制得乙烯。
已知:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) △H =-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。
C2H4(g)+4H2O(g) △H =-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。
①根据曲线a计算250℃时该反应的化学平衡常数K=
②b条件下投料比n(H2)/n(CO2)
③下列说法正确的是
a. 平衡常数大小:M=M1> N
b. 其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
c. 当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
d. 工业生产中采取较高温度(250 ℃左右)是为了提高催化剂活性加快反应速率。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】将铜锌合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
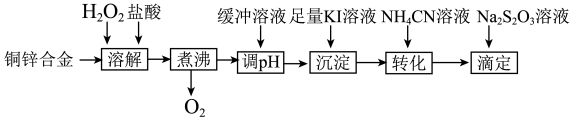
回答下列问题:
(1)H2O2的电子式为_________ ;“溶解”后铜元素的主要存在形式是______ (填离子符号)。
(2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______________ 。
(3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应:S2O32-+2H+=S↓+SO2↑+H2O
① 该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________ 。
[已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,则v(Na2S2O3)=_____ mol/(L·s)(忽略溶液体积变化的影响)。
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_____________ 。
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN -):c(I-)≥_______________ 。[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情况可能造成测得的铜含量偏高的是______(填标号)。

回答下列问题:
(1)H2O2的电子式为
(2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为
(3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应:S2O32-+2H+=S↓+SO2↑+H2O
① 该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为
[已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,则v(Na2S2O3)=
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN -):c(I-)≥
(6)下列情况可能造成测得的铜含量偏高的是______(填标号)。
| A.铜锌合金中含少量铁 |
| B.“沉淀”时,I2与I-结合生成I3- :I2+I-=I3- |
| C.“转化”后的溶液在空气中放置太久,没有及时滴定 |
| D.“滴定”过程中,往锥形瓶内加入少量蒸馏水 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】含氯化合物的应用越来越广泛,请完成下列有关问题:
(1)亚氯酸钠(NaClO2)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为_______ ,其水溶液显碱性的原因为_______ ,其水溶液中离子浓度由大到小的顺序为_______ 。
(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成ClO2和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式_______ 。
(3)ClO2是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为SO2通入NaClO3中可得ClO2,其氧化剂与还原剂的物质的量之比为_______ 。
(4)一定条件下,KClO3与硫酸酸化的草酸(H2C2O4)溶液反应可制备ClO2,该反应的离子方程式为_______ 。
(5)AgNO3溶液可以用来检验水溶液中的Cl-或Br-。若向AgCl悬浊液中加入NaBr溶液,可把AgCl转化为AgBr,已知AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=
AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=_______ 。(不写单位)
(1)亚氯酸钠(NaClO2)是一种漂白织物的漂白剂,具有较强的氧化性。亚氯酸钠中氯元素的化合价为
(2)亚氯酸钠在碱性溶液中稳定,在酸性溶液中生成ClO2和氯元素的另一种稳定离子,写出亚氯酸钠在酸性条件下反应的离子方程式
(3)ClO2是一种新型安全多功能型杀菌剂,其制备方法有多种,其中一种为SO2通入NaClO3中可得ClO2,其氧化剂与还原剂的物质的量之比为
(4)一定条件下,KClO3与硫酸酸化的草酸(H2C2O4)溶液反应可制备ClO2,该反应的离子方程式为
(5)AgNO3溶液可以用来检验水溶液中的Cl-或Br-。若向AgCl悬浊液中加入NaBr溶液,可把AgCl转化为AgBr,已知AgCl(s)+Br-(aq)
 AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=
AgBr(s)+Cl-(aq)达到平衡时,c(Cl-)︰c(Br-)=23.4∶1,已知Ksp(AgCl)=1.8×10-10,则Ksp(AgBr)=
您最近一年使用:0次