解题方法
1 . 亚硝酸钠(NaNO2)有毒、有咸味,外形与食盐相似,人若误食会引起中毒。某兴趣小组欲研究亚硝酸钠,查阅资料得到如表信息。试根据信息回答下列问题:
(1)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,则该反应中氧化剂是 _______ ;若有0.75mol电子发生转移,则被氧化的还原剂的粒子数为 _______ (用NA表示阿伏加德罗常数的值)。
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
(3)下列方法中,可用来区分NaNO2和NaCl的是 _______ (填序号)。
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_______ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+。 |
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
| A.NaNO2被还原 |
| B.维生素C具有还原性 |
| C.还原性:维生素C>Fe2+ |
| D.NaNO2是还原剂 |
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近一年使用:0次
2 . 用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
(1)溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_______ 中溶解,完全溶解后,全部转移至100 mL的_______ 中,加蒸馏水至_______ 。
(2)滴定:取0.00950 mol•L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:
Cr2O + I-+ H+=I2+ Cr3++ H2O(请配平该反应的方程式)
+ I-+ H+=I2+ Cr3++ H2O(请配平该反应的方程式)_____ 。
用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O =S4O
=S4O +2I-。加入
+2I-。加入_______ 作为指示剂,继续滴定,当溶液_______ ,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为_______ %(保留1位小数)。
(1)溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
(2)滴定:取0.00950 mol•L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:
Cr2O
 + I-+ H+=I2+ Cr3++ H2O(请配平该反应的方程式)
+ I-+ H+=I2+ Cr3++ H2O(请配平该反应的方程式)用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O
 =S4O
=S4O +2I-。加入
+2I-。加入
您最近一年使用:0次
解题方法
3 . 配平氧化还原反应方程式:
(1)_____Cu+_____HNO3(稀)=_____Cu(NO3)2+_____NO↑+_____H2O:_____ 。
(2) MnO
MnO +
+ H2O2+
H2O2+ _____=
_____= Mn2++
Mn2++ _____+
_____+ H2O:
H2O:_____ 。
(1)_____Cu+_____HNO3(稀)=_____Cu(NO3)2+_____NO↑+_____H2O:
(2)
 MnO
MnO +
+ H2O2+
H2O2+ _____=
_____= Mn2++
Mn2++ _____+
_____+ H2O:
H2O:
您最近一年使用:0次
名校
4 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)可用于制作计算机芯片和太阳能电池板的是_________ (填化学式)。
(2)工艺师常用氢氟酸雕刻玻璃,该反应的化学方程式为_________ 。
(3)兵马俑中所用颜料成分之一为蓝紫色的硅酸铜钡(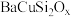 铜为
铜为 价),下列有关硅酸铜钡的说法不正确的是_________(填字母)。
价),下列有关硅酸铜钡的说法不正确的是_________(填字母)。
(4)工业上提纯硅有多种路线,其中一种工艺流程如图:

①电弧炉中发生反应的化学方程式为_________ 。
②在流化床反应的产物中, 大约占85%,还有
大约占85%,还有 等,有关物质的沸点数据如表,则提纯
等,有关物质的沸点数据如表,则提纯 的主要工艺操作依次是沉降、冷凝和
的主要工艺操作依次是沉降、冷凝和_________ 。
③整个制作过程必须严格控制无水、无氧, 遇水剧烈反应生成
遇水剧烈反应生成 、
、 气体和另一种物质,该反应的化学方程式为
气体和另一种物质,该反应的化学方程式为_________ 。
(1)可用于制作计算机芯片和太阳能电池板的是
(2)工艺师常用氢氟酸雕刻玻璃,该反应的化学方程式为
(3)兵马俑中所用颜料成分之一为蓝紫色的硅酸铜钡(
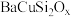 铜为
铜为 价),下列有关硅酸铜钡的说法不正确的是_________(填字母)。
价),下列有关硅酸铜钡的说法不正确的是_________(填字母)。A.可用氧化物形式表示为 | B.性质稳定,不易脱色 |
| C.x等于6 | D.易溶解于强酸和强碱 |

①电弧炉中发生反应的化学方程式为
②在流化床反应的产物中,
 大约占85%,还有
大约占85%,还有 等,有关物质的沸点数据如表,则提纯
等,有关物质的沸点数据如表,则提纯 的主要工艺操作依次是沉降、冷凝和
的主要工艺操作依次是沉降、冷凝和| 物质 |  |  |  | 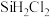 | 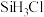 |  |  |
沸点/ | 2355 | 57.6 | 31.8 | 8.2 |  | 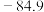 |  |
③整个制作过程必须严格控制无水、无氧,
 遇水剧烈反应生成
遇水剧烈反应生成 、
、 气体和另一种物质,该反应的化学方程式为
气体和另一种物质,该反应的化学方程式为
您最近一年使用:0次
名校
5 . 下表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号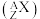 表示该核素为
表示该核素为_______ 。
(2)由元素②和④形成的三核分子的结构式为_______ 。
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_______ 。
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为_______ (填“离子键”、“极性键”或“非极性键”),④和⑦的氢化物沸点较高的是_______ (填化学式)。
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是_______ (用离子符号表示);元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(6)元素⑧的对应元素符号为Y,若在一定条件下,Y单质能够与硫反应生成一种用途广泛的硫化剂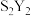 。该硫化剂
。该硫化剂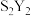 与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是
与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是_______ (元素Y请用具体元素符号表示)。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(1)已知元素⑩的一种核素,其中子数为45,用原子符号
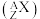 表示该核素为
表示该核素为(2)由元素②和④形成的三核分子的结构式为
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是
(6)元素⑧的对应元素符号为Y,若在一定条件下,Y单质能够与硫反应生成一种用途广泛的硫化剂
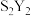 。该硫化剂
。该硫化剂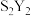 与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是
与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液提色的无色气体,则该反应的化学方程式是
您最近一年使用:0次
名校
6 . 雾霾与汽车尾气有关,为了减少污染,可使用尾气净化装置,其原理如图所示:

(1)净化过程中的中间产物是_______ (用化学式表示)。
(2)净化过程的总化学方程式是_______ 。

(1)净化过程中的中间产物是
(2)净化过程的总化学方程式是
您最近一年使用:0次
解题方法
7 . 某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质探究等实验(图中夹持装置已省略)。
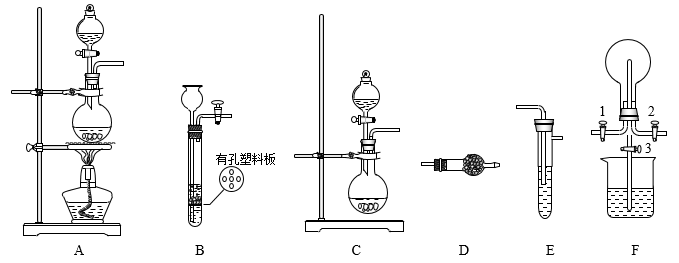
I.制备气体
(1)利用装置B可制取的气体有___________ (选填字母序号)。
a.CO2b.H2 c.SO2
II.探究Cl2与NH3的反应
(2)装置C与装置D连接可制取干燥的氨气,D装置内的药品是_______ ;装置A、E、D连接可制取纯净、干燥的Cl2,E装置的作用是___________ 。
(3)装置F可用于探究Cl2与NH3的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入______ ,然后关闭3,打开2,向烧瓶中慢慢通入一定量的另一种气体。实验开始一段时间后,烧瓶内出现浓厚的白烟并在容器内壁凝结,该反应的化学方程式为___________ 。
III.探究某些物质的性质
(4)利用装置C、E可设计实验比较碳元素和硅元素的非金属性强弱,实验方案是___________ 。
(5)将装置B、C分别与装置F相连后,进行H2S与SO2反应的实验。烧瓶中发生反应的化学方程式为___________ 。

I.制备气体
(1)利用装置B可制取的气体有
a.CO2b.H2 c.SO2
II.探究Cl2与NH3的反应
(2)装置C与装置D连接可制取干燥的氨气,D装置内的药品是
(3)装置F可用于探究Cl2与NH3的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入
III.探究某些物质的性质
(4)利用装置C、E可设计实验比较碳元素和硅元素的非金属性强弱,实验方案是
(5)将装置B、C分别与装置F相连后,进行H2S与SO2反应的实验。烧瓶中发生反应的化学方程式为
您最近一年使用:0次
名校
8 . 填空。
(1)请将下列4种物质:N2O、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平___________ 。24FeSO4+_______=_______+_____+_______+_____H2O
(2)用单线桥表示电子转移过程___________ 。
(1)请将下列4种物质:N2O、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平
(2)用单线桥表示电子转移过程
您最近一年使用:0次
9 . 氧化还原反应的本质是电子的转移,请回答下列有关氧化还原反应的问题。
(1)配平下列氧化还原反应方程式,并标出单线桥:
①_____________  H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O +  S↓+
S↓+  NO↑
NO↑
②_____________  NH3 +
NH3 +  O2 =
O2 =  NO +
NO +  H2O
H2O
③_____________  KClO3 +
KClO3 +  HCl(浓)=
HCl(浓)=  KCl+
KCl+  Cl2↑+
Cl2↑+  H2O
H2O
④_____________  Cu +
Cu +  HNO3 (稀) =
HNO3 (稀) =  Cu(NO3)2 +
Cu(NO3)2 +  NO↑+
NO↑+  H2O
H2O
(2)已知:①Cl2+2Fe2+=2Cl-+2Fe3+;②Cl2+2I-=2Cl-+I2,并且I-还原性比Fe2+强,往100 mL 0.2 mol·L-1的FeI2溶液中通入一定体积的Cl2。充分反应后,若溶液中有50%的Fe2+被氧化,则通入的氯气的体积(标准状况)是__________ 。若通入的是足量氯气,总反应的离子方程式为_______________ 。
(3)火药是中国的四大发明之一,永远值得华夏儿女骄傲。黑火药在发生爆炸时,发生如下反应: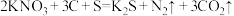 。其中作氧化剂的是
。其中作氧化剂的是___________ (填化学式)。每生成2mol气体,转移_______________ mol电子。
(4)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其中毒原因是
而中毒的事件,其中毒原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ 性。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有______ 性。
(1)配平下列氧化还原反应方程式,并标出单线桥:
①
 H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O +  S↓+
S↓+  NO↑
NO↑②
 NH3 +
NH3 +  O2 =
O2 =  NO +
NO +  H2O
H2O③
 KClO3 +
KClO3 +  HCl(浓)=
HCl(浓)=  KCl+
KCl+  Cl2↑+
Cl2↑+  H2O
H2O④
 Cu +
Cu +  HNO3 (稀) =
HNO3 (稀) =  Cu(NO3)2 +
Cu(NO3)2 +  NO↑+
NO↑+  H2O
H2O(2)已知:①Cl2+2Fe2+=2Cl-+2Fe3+;②Cl2+2I-=2Cl-+I2,并且I-还原性比Fe2+强,往100 mL 0.2 mol·L-1的FeI2溶液中通入一定体积的Cl2。充分反应后,若溶液中有50%的Fe2+被氧化,则通入的氯气的体积(标准状况)是
(3)火药是中国的四大发明之一,永远值得华夏儿女骄傲。黑火药在发生爆炸时,发生如下反应:
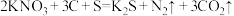 。其中作氧化剂的是
。其中作氧化剂的是(4)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其中毒原因是
而中毒的事件,其中毒原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有
您最近一年使用:0次
10 . 疫情期间,某项目化学学习小组开展了对84消毒液使用安全性的研究。查找资料可知:
①84消毒液有效成分为NaClO。含氯消毒剂中HClO的消毒效果远高于ClO-,而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7,K2=5.6×10-11。
请回答下列问题:
(1)在84消毒液中滴加几滴酚酞试液,可观察到的现象是_______ 。
(2)通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因_______ 。
(3)84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:_______ 。
(4)为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。
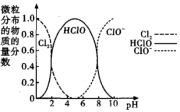
根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因_______ 。
(5)84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中 完全转化为N2,请写出相应的离子反应方程式:
完全转化为N2,请写出相应的离子反应方程式:_______ 。若处理废水产生了0.448LN2(标准状况),则需消耗有效氯为5%的84消毒液的质量为_______ g。(“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,常以百分数表示)
①84消毒液有效成分为NaClO。含氯消毒剂中HClO的消毒效果远高于ClO-,而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7,K2=5.6×10-11。
请回答下列问题:
(1)在84消毒液中滴加几滴酚酞试液,可观察到的现象是
(2)通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因
(3)84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:
(4)为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。

根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因
(5)84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中
 完全转化为N2,请写出相应的离子反应方程式:
完全转化为N2,请写出相应的离子反应方程式:
您最近一年使用:0次



