解题方法
1 .  广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。
② 下,
下, 的
的 的
的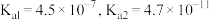 ,
, 的
的 。
。
③当离子浓度 时,可视为沉淀完全。
时,可视为沉淀完全。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为_______ ,“滤渣1”的主要成分是 、
、_______ (填化学式)。
(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
(3)等浓度的① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为_______ (用标号表示)。
(4)室温时,“沉铝”过程发生反应的离子方程式为_______ 。用 调节溶液的
调节溶液的
_______ (保留一位小数),“沉铝”完全。
(5)“沉锌”工序中生成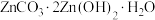 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式:_______ ;“滤液”的主要成分为 ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:_______ 。
 广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。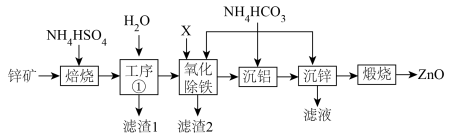
②
 下,
下, 的
的 的
的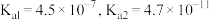 ,
, 的
的 。
。③当离子浓度
 时,可视为沉淀完全。
时,可视为沉淀完全。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为
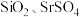 、
、(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
A. | B. | C. | D. |
(3)等浓度的①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为(4)室温时,“沉铝”过程发生反应的离子方程式为
 调节溶液的
调节溶液的
(5)“沉锌”工序中生成
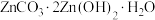 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式: ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . FeO(OH)在高档涂料、油墨等领域有着广泛的应用。以铁泥(主要含Fe2O3,以及少量的 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。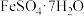 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:
(1)滤液①的溶质为H2SO4和_______ 、_______ (填化学式)。
(2)“提纯”步骤中所有可能的反应的离子方程式为_______ 、__________ 。
(3)加入乙醇的目的是_______ 。
(4)“氧化”步骤中主要反应的化学方程式为_______ 。
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为_______ 。
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。 放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式_______ 。
 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。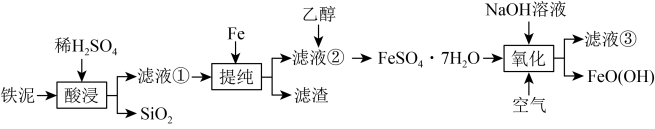
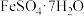 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:(1)滤液①的溶质为H2SO4和
(2)“提纯”步骤中所有可能的反应的离子方程式为
(3)加入乙醇的目的是
(4)“氧化”步骤中主要反应的化学方程式为
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。
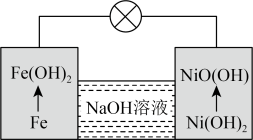
 放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成Fe(OH)2后,继续放电时,电极上的Fe(OH)2可转化为FeO(OH),写出该过程的电极反应式
您最近一年使用:0次
名校
解题方法
3 . 2020年10月,洛阳师范学院先进功能材料团队,在过渡金属硫族化合物(TMD)材料领域研究取得新进展, 是一种典型的TMD材料,
是一种典型的TMD材料, 与石墨相似具有层状结构。其工艺制备流程如下图所示:
与石墨相似具有层状结构。其工艺制备流程如下图所示: 结构类似于
结构类似于 ,与酸反应时先生成
,与酸反应时先生成 类似于
类似于 ,易分解。
,易分解。
② 不溶于盐酸和氢氟酸。
不溶于盐酸和氢氟酸。
③辉钼矿(主要成分为 ,还含有
,还含有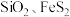 及不溶于酸碱且难以氧化的杂质)。
及不溶于酸碱且难以氧化的杂质)。
(1) 可用于制纳米颗粒润滑油,是由于
可用于制纳米颗粒润滑油,是由于___________ 。
(2)由题目已知条件分析 属于
属于___________ 晶体(填“分子”“离子”“共价”或“混合型”),该晶体内含有___________ 作用力。
A.范德华力 B.氢键 C.极性共价键 D.离子键 E.非极性共价键
(3)“酸浸”时,辉钼矿中的___________ (写化学式)溶解,该溶解过程是否发生了氧化还原反应: ___________ (填“是”或“否”)。
(4)不溶于酸碱且难以氧化的杂质在___________ 步骤中被除去。
(5)“沉淀”操作中,先加入 ,将
,将 转化为
转化为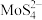 ,再加入盐酸,生成
,再加入盐酸,生成 沉淀和
沉淀和 气体,写出加入盐酸后所发生反应的离子方程式为
气体,写出加入盐酸后所发生反应的离子方程式为___________ 。
 是一种典型的TMD材料,
是一种典型的TMD材料, 与石墨相似具有层状结构。其工艺制备流程如下图所示:
与石墨相似具有层状结构。其工艺制备流程如下图所示: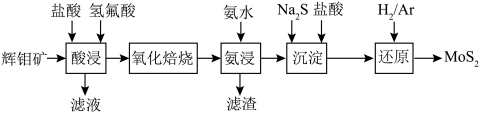
 结构类似于
结构类似于 ,与酸反应时先生成
,与酸反应时先生成 类似于
类似于 ,易分解。
,易分解。②
 不溶于盐酸和氢氟酸。
不溶于盐酸和氢氟酸。③辉钼矿(主要成分为
 ,还含有
,还含有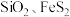 及不溶于酸碱且难以氧化的杂质)。
及不溶于酸碱且难以氧化的杂质)。(1)
 可用于制纳米颗粒润滑油,是由于
可用于制纳米颗粒润滑油,是由于(2)由题目已知条件分析
 属于
属于A.范德华力 B.氢键 C.极性共价键 D.离子键 E.非极性共价键
(3)“酸浸”时,辉钼矿中的
(4)不溶于酸碱且难以氧化的杂质在
(5)“沉淀”操作中,先加入
 ,将
,将 转化为
转化为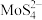 ,再加入盐酸,生成
,再加入盐酸,生成 沉淀和
沉淀和 气体,写出加入盐酸后所发生反应的离子方程式为
气体,写出加入盐酸后所发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 科学家开发的光催化剂BiVO4实现了高选择性制备氢气。某小组以辉铋矿粉(主要成分是Bi2S3,含少量Bi2O3、Bi、FeS2和SiO2等杂质)为原料制备钒酸铋(BiVO4)的流程如图所示。
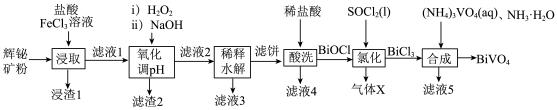
已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe3+、Fe2+和H+。
②常温下,几种离子生成氢氧化物沉淀的pH如表所示。
回答下列问题:
(1)浸取时可以适当加热,但温度不宜过高,其原因是___________ 。写出Bi2S3转化的离子方程式:___________ 。
(2)加H2O2氧化的目的是___________ 。调pH的最低值为___________ 。
(3)稀释水解时通入水蒸气的目的是___________ 。
(4)将气体X通入酸性KMnO4溶液中,实验现象可能是___________ 。
(5)将滤液5经蒸发浓缩、降温结晶、过滤,得到NH4Cl晶体,其晶胞结构如图所示。

①与氯离子最近且等距离的氯离子有___________ 个。
②晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。其中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则 的坐标参数为
的坐标参数为___________ 。

已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe3+、Fe2+和H+。
②常温下,几种离子生成氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Bi(OH)3 |
| 开始沉淀的pH | 7.6 | 1.6 | 4.0 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.5 |
(1)浸取时可以适当加热,但温度不宜过高,其原因是
(2)加H2O2氧化的目的是
(3)稀释水解时通入水蒸气的目的是
(4)将气体X通入酸性KMnO4溶液中,实验现象可能是
(5)将滤液5经蒸发浓缩、降温结晶、过滤,得到NH4Cl晶体,其晶胞结构如图所示。

①与氯离子最近且等距离的氯离子有
②晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。其中A的坐标参数为(0,0,0),B的坐标参数为(1,1,1),则
 的坐标参数为
的坐标参数为
您最近一年使用:0次
名校
解题方法
5 . 以含钴废料(主要成分为Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如图所示:

已知:
I.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+。
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
回答下列问题:
(1)“滤渣1”的化学式为_______ 。
(2)副产品的化学式为________ 。
(3)“沉钴”时发生反应的离子方程式为_________ 。
(4)“酸浸”时温度不能过高主要原因可能是_______ 。
(5)高温煅烧时发生反应的化学方程式是________ 。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为: 。该电池充电时阳极的电极反应式为
。该电池充电时阳极的电极反应式为________ 。

已知:
I.“酸浸”后的浸出液中含的阳离子有H+、Co2+、Fe3+、Ni2+。
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
| 完全沉淀时的pH | 3.7 | 9.0 | 9.2 |
(1)“滤渣1”的化学式为
(2)副产品的化学式为
(3)“沉钴”时发生反应的离子方程式为
(4)“酸浸”时温度不能过高主要原因可能是
(5)高温煅烧时发生反应的化学方程式是
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,碱性镍氢电池是国产比亚迪汽车车载电池之一,其电池反应为:
 。该电池充电时阳极的电极反应式为
。该电池充电时阳极的电极反应式为
您最近一年使用:0次
解题方法
6 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
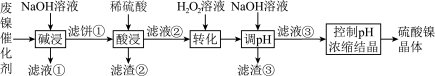
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是___________ (写一个化学方程式就可以)。为回收金属,通常用稀硫酸将“滤液①”调为中性,生成沉淀,该沉淀的化学式为___________ 。
(2)“滤液②”中含有的金属离子除了“ ”,还有
”,还有___________ 。
(3)“转化”中加入 的主要作用是
的主要作用是___________ (用离子方程式表示)。
(4)利用上述表格数据,计算 的
的
___________ (列出计算式即可,不用化简)。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:___________ (填数值)。
 ):
):
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是(2)“滤液②”中含有的金属离子除了“
 ”,还有
”,还有(3)“转化”中加入
 的主要作用是
的主要作用是(4)利用上述表格数据,计算
 的
的
 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:
您最近一年使用:0次
名校
解题方法
7 . 硒被誉为“生命元素”。亚硒酸钙(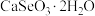 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
①含硒废料的主要成分是 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为 、
、 和
和 。
。
② 易溶于水,
易溶于水, 难溶于水。
难溶于水。
(1)“焙烧”时,含硒废料需要粉碎,目的是___________ 。
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是___________ (用离子方程式表示)。
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在50℃),其主要原因是___________ 。
(4)硒酸分解制备 的副产物有
的副产物有___________ (填化学式)。
(5)已知 、
、 的熔点分别为315℃、733℃,其熔点差异的主要原因是
的熔点分别为315℃、733℃,其熔点差异的主要原因是___________ 。
(6)测定 产品纯度。称取
产品纯度。称取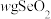 产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量
产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用 溶液滴定至终点时消耗VmL滴定液。发生有关反应:
溶液滴定至终点时消耗VmL滴定液。发生有关反应:
①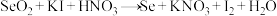 (未配平)
(未配平)
②
该 产品中硒元素的质量分数为
产品中硒元素的质量分数为___________ %。如果大量空气进入锥形瓶,可能导致测得的结果___________ (填“偏高”“偏低”或“无影响”)。
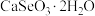 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题: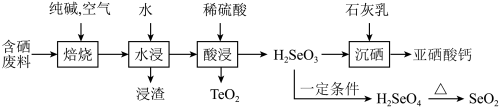
①含硒废料的主要成分是
 和
和 ;“焙烧”时固体产物为
;“焙烧”时固体产物为 、
、 和
和 。
。②
 易溶于水,
易溶于水, 难溶于水。
难溶于水。(1)“焙烧”时,含硒废料需要粉碎,目的是
(2)利用“浸渣”可以制备胆矾,其操作步骤是加入足量稀硫酸溶解,再通入热空气。通入热空气的目的是
(3)上述参加反应的双氧水远小于实际消耗的双氧水(反应温度在50℃),其主要原因是
(4)硒酸分解制备
 的副产物有
的副产物有(5)已知
 、
、 的熔点分别为315℃、733℃,其熔点差异的主要原因是
的熔点分别为315℃、733℃,其熔点差异的主要原因是(6)测定
 产品纯度。称取
产品纯度。称取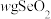 产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量
产品溶于水配制成250mL溶液,取25.00mL于锥形瓶中,加入足量 溶液和适量稀硝酸,充分反应后,滴加3滴
溶液和适量稀硝酸,充分反应后,滴加3滴 淀粉溶液,用
淀粉溶液,用 溶液滴定至终点时消耗VmL滴定液。发生有关反应:
溶液滴定至终点时消耗VmL滴定液。发生有关反应:①
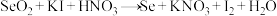 (未配平)
(未配平)②

该
 产品中硒元素的质量分数为
产品中硒元素的质量分数为
您最近一年使用:0次
2024-02-25更新
|
582次组卷
|
5卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)
江西省宜春市宜丰中学2023-2024学年高二下学期开学考试化学试题(创新部)2024届陕西省安康市高三下学期一模考试理科综合试题-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)T27-工业流程题2024届陕西省西安博爱国际学校高三下学期第一次模拟考试理科综合试卷-高中化学
8 . 硫氰化钾主要用于合成树脂、杀虫杀菌剂等,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
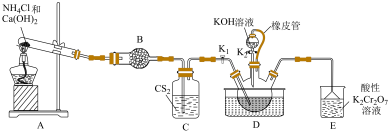
已知:① 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;
②三颈烧瓶内盛放: 、水和催化剂;
、水和催化剂;
③ ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。
回答下列问题:
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的仪器名称为___________ ;装置C的作用是___________ 。
(3)装置E可吸收还原性气体,防止污染环境,写出吸收 时发生反应的离子方程式
时发生反应的离子方程式___________ 。
(4)先通过过滤除去三颈烧瓶中的固体催化剂,再通过减压蒸发浓缩、___________ 、___________ 、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液后量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用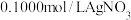 标准溶液滴定,达到滴定终点时平均消耗
标准溶液滴定,达到滴定终点时平均消耗 标准溶液20.00mL。[注:①滴定时发生的反应:
标准溶液20.00mL。[注:①滴定时发生的反应: (白色);②实验过程中不考虑SCN被硝酸氧化。]
(白色);②实验过程中不考虑SCN被硝酸氧化。]
①晶体中KSCN的质量分数为___________ (计算结果保留3位有效数字)。
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数___________ 。(填“偏大”、“偏小”或“无影响”)

已知:①
 不溶于
不溶于 ,
, 密度比水大且不溶于水;
密度比水大且不溶于水;②三颈烧瓶内盛放:
 、水和催化剂;
、水和催化剂;③
 ,该反应比较缓慢且
,该反应比较缓慢且 在高于170℃易分解。
在高于170℃易分解。回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)装置B的仪器名称为
(3)装置E可吸收还原性气体,防止污染环境,写出吸收
 时发生反应的离子方程式
时发生反应的离子方程式(4)先通过过滤除去三颈烧瓶中的固体催化剂,再通过减压蒸发浓缩、
(5)测定晶体中KSCN的含量:称取10.0g样品。配成1000mL溶液后量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
 溶液作指示剂,用
溶液作指示剂,用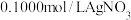 标准溶液滴定,达到滴定终点时平均消耗
标准溶液滴定,达到滴定终点时平均消耗 标准溶液20.00mL。[注:①滴定时发生的反应:
标准溶液20.00mL。[注:①滴定时发生的反应: (白色);②实验过程中不考虑SCN被硝酸氧化。]
(白色);②实验过程中不考虑SCN被硝酸氧化。]①晶体中KSCN的质量分数为
②滴定前滴定管尖嘴部分有气泡,达到终点后气泡消失,则KSCN的质量分数
您最近一年使用:0次
9 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质,采用如下工艺流程回收其中的镍制备硫酸镍晶体( )。
)。

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是___________________________ ;为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀,写出该反应的离子方程式____________________ 。
(2)“滤液②”中含有的金属离子是______________________ 。
(3)“转化”中可替代 的物质是
的物质是___________ 。
(4)利用上述表格数据,计算 的
的
___________ (列出计算式);如果“转化”后的溶液中 浓度为1.0
浓度为1.0 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________ 。
(6)硫酸镍可转化为NiOOH用作镍镉电池,镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: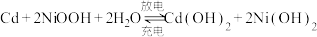 ,放电时NiOOH参与的电极反应式为
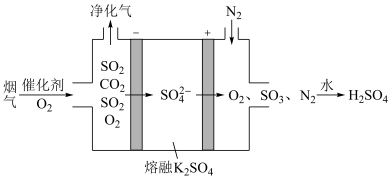
,放电时NiOOH参与的电极反应式为___________________ ;某种电化学脱硫法装置如图所示,不仅可脱除烟气中 ,还可以制得,请写出在阳极脱除
,还可以制得,请写出在阳极脱除 生成
生成 的电极反应式是
的电极反应式是________________ 。
 )。
)。
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 |
|
|
|
|
开始沉淀时( | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时( | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代
 的物质是
的物质是(4)利用上述表格数据,计算
 的
的
 浓度为1.0
浓度为1.0 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
(6)硫酸镍可转化为NiOOH用作镍镉电池,镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
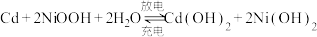 ,放电时NiOOH参与的电极反应式为
,放电时NiOOH参与的电极反应式为 ,还可以制得,请写出在阳极脱除
,还可以制得,请写出在阳极脱除 生成
生成 的电极反应式是
的电极反应式是
您最近一年使用:0次
10 . 钯( )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
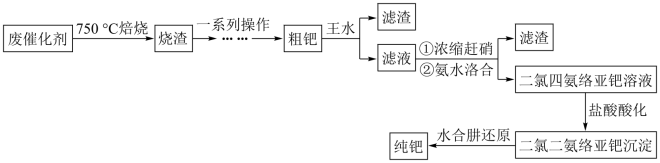
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是_______ 。
(2)“一系列操作”包括向烧渣中加入 ,目的是将
,目的是将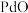 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:___________ 。
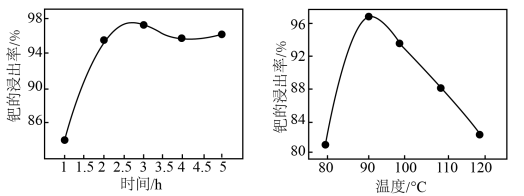
(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸( )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为_______ 。
(4)“氨水络合”时需要控制好溶液的 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为______ (保留三位有效数字)。(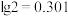 )
)
(5)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
______ 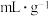 ,氢气的浓度
,氢气的浓度
______ (保留小数点后两位)。(吸附容量 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为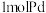 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
 )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量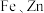 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是
(2)“一系列操作”包括向烧渣中加入
 ,目的是将
,目的是将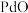 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(
 )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为
(4)“氨水络合”时需要控制好溶液的
 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为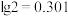 )
)(5)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
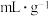 ,氢气的浓度
,氢气的浓度
 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为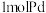 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
您最近一年使用:0次

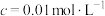 )的pH
)的pH )的pH
)的pH

