名校
解题方法
1 . 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成。医疗消毒等领域。回答下列问题:
(1)已知: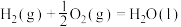
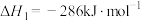
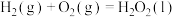
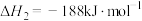
过氧化氢分解反应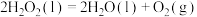 的
的
___________  。
。
(2)早期制备方法: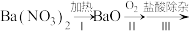 滤液
滤液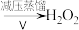
①I为分解反应,产物除BaO、 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是___________ 。
②Ⅱ为可逆反应,写出一条促进该反应正向进行的措施是___________ 。
③Ⅲ中生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
④减压能够降低蒸馏温度,从 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:________ 。
(1)已知:
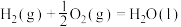
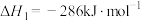
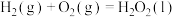
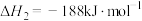
过氧化氢分解反应
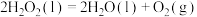 的
的
 。
。(2)早期制备方法:
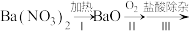 滤液
滤液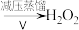
①I为分解反应,产物除BaO、
 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是②Ⅱ为可逆反应,写出一条促进该反应正向进行的措施是
③Ⅲ中生成
 ,反应的化学方程式是
,反应的化学方程式是④减压能够降低蒸馏温度,从
 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:
您最近一年使用:0次
名校
解题方法
2 . 氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(1)N2和H2合成氨的化学方程式:________ ,该反应的
_______ 0(填“大于”、“小于”或“等于”)。
(2)氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如下图所示的氮循环,请回答相关问题:
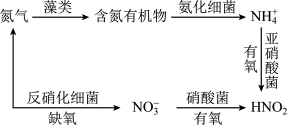
① 在亚硝酸菌作用下的硝化过程的离子方程式是
在亚硝酸菌作用下的硝化过程的离子方程式是___________ 。
②恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是___________ (填标号)。
A.溶液的pH不再改变
B. 的消耗速率和
的消耗速率和 的生成速率相等
的生成速率相等
C.溶液中 、
、 、
、 、
、 的总物质的量保持不变
的总物质的量保持不变
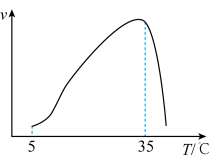
③实验测得在其它条件一定时, 硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时反应速率迅速下降的原因可能是
硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时反应速率迅速下降的原因可能是___________ 。
(3)硝酸工业的尾气成分主要是 ,通常利用
,通常利用 处理,将其转化为无毒物质后排放,该反应的化学方程式为
处理,将其转化为无毒物质后排放,该反应的化学方程式为___________ 。
(1)N2和H2合成氨的化学方程式:

(2)氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如下图所示的氮循环,请回答相关问题:

①
 在亚硝酸菌作用下的硝化过程的离子方程式是
在亚硝酸菌作用下的硝化过程的离子方程式是②恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是
A.溶液的pH不再改变
B.
 的消耗速率和
的消耗速率和 的生成速率相等
的生成速率相等C.溶液中
 、
、 、
、 、
、 的总物质的量保持不变
的总物质的量保持不变③实验测得在其它条件一定时,
 硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时反应速率迅速下降的原因可能是
硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时反应速率迅速下降的原因可能是
(3)硝酸工业的尾气成分主要是
 ,通常利用
,通常利用 处理,将其转化为无毒物质后排放,该反应的化学方程式为
处理,将其转化为无毒物质后排放,该反应的化学方程式为
您最近一年使用:0次
2023-12-15更新
|
29次组卷
|
2卷引用:海南省海口市第四中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
3 . CuCl是一种重要化工原料,常用作催化剂、杀菌剂。化学小组利用下图装置(部分夹持装置略去)制备CuCl。

已知:①CuCl为白色固体,微溶于水,不溶于酒精,在空气中能被迅速氧化。
②CuCl能溶于氨水, 为无色。
为无色。
实验步骤:
Ⅰ.连接好仪器,检查装置气密性后加入药品。
Ⅱ.打开活塞K,通入一段时间 后,关闭活塞K。
后,关闭活塞K。
Ⅲ.打开仪器a的活塞,向三颈瓶中加盐酸调pH至2~3。
Ⅳ.打开活塞K,通入 ,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
Ⅴ.将A中混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)步骤Ⅱ中反应前通入 的目的是
的目的是_______ 。
(2)仪器a的名称是_______ ,装置C的作用是_______ 。
(3)步骤Ⅳ中通入 发生反应的离子方程式
发生反应的离子方程式_______ 。
(4)步骤Ⅴ中用95%的乙醇代替蒸馏水洗涤的优点是_______ 。
(5)CuCl溶于氨水后的溶液遇到空气被氧化为深蓝色,深蓝色溶液中阳离子为_______ 。

已知:①CuCl为白色固体,微溶于水,不溶于酒精,在空气中能被迅速氧化。
②CuCl能溶于氨水,
 为无色。
为无色。实验步骤:
Ⅰ.连接好仪器,检查装置气密性后加入药品。
Ⅱ.打开活塞K,通入一段时间
 后,关闭活塞K。
后,关闭活塞K。Ⅲ.打开仪器a的活塞,向三颈瓶中加盐酸调pH至2~3。
Ⅳ.打开活塞K,通入
 ,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。
,溶液中产生白色沉淀,待反应完全后,再通一段时间的气体。Ⅴ.将A中混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)步骤Ⅱ中反应前通入
 的目的是
的目的是(2)仪器a的名称是
(3)步骤Ⅳ中通入
 发生反应的离子方程式
发生反应的离子方程式(4)步骤Ⅴ中用95%的乙醇代替蒸馏水洗涤的优点是
(5)CuCl溶于氨水后的溶液遇到空气被氧化为深蓝色,深蓝色溶液中阳离子为
您最近一年使用:0次
2023-12-14更新
|
45次组卷
|
2卷引用:海南省海口市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
4 . SiCl4是生产多品硅的副产物。利用SiC14对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属,工艺路线如下:
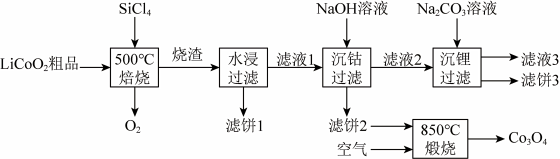
回答下列问题:
(1)Co位于元素周期表第__________ 周期第_________ 族。
(2)烧渣是LiC1、CoC12和SiO2的混合物,“500°C焙烧”后剩余的SiC14应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因___________ 。
(3)鉴别洗净的“滤饼3”和固体Na2CO3常用方法的名称是___________ 。
(4)已知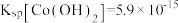 ,若“沉钻过滤”的pH控制为10.0,则溶液中Co2+浓度为
,若“沉钻过滤”的pH控制为10.0,则溶液中Co2+浓度为___________ mol·L-1。“850℃煅烧”时的化学方程式为___________ 。

回答下列问题:
(1)Co位于元素周期表第
(2)烧渣是LiC1、CoC12和SiO2的混合物,“500°C焙烧”后剩余的SiC14应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
(3)鉴别洗净的“滤饼3”和固体Na2CO3常用方法的名称是
(4)已知
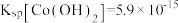 ,若“沉钻过滤”的pH控制为10.0,则溶液中Co2+浓度为
,若“沉钻过滤”的pH控制为10.0,则溶液中Co2+浓度为
您最近一年使用:0次
解题方法
5 . 用主要成分为 的矿石(杂质为
的矿石(杂质为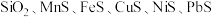 等)制取锰的流程如图所示。
等)制取锰的流程如图所示。

已知:流程中相关金属离子开始沉淀和完全沉淀的 如下:
如下:
(1)焙烧中 参与反应的化学方程式为
参与反应的化学方程式为___________ 。
(2)氧化过程中反应的离子方程式为___________ 。
(3)调 的目的是除去
的目的是除去 ,则
,则 的调控范围是
的调控范围是___________ ;加入 的目的是除去
的目的是除去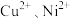 ,则除
,则除 转化的离子方程式为
转化的离子方程式为___________ 。
(4)电解中生成 的电极反应式为
的电极反应式为___________ 。
 的矿石(杂质为
的矿石(杂质为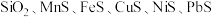 等)制取锰的流程如图所示。
等)制取锰的流程如图所示。
已知:流程中相关金属离子开始沉淀和完全沉淀的
 如下:
如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 2.2 | 7.5 | 7.9 | 7.8 | 4.4 |
完全沉淀的 | 3.5 | 9.5 | 9.0 | 10.4 | 5.8 |
 参与反应的化学方程式为
参与反应的化学方程式为(2)氧化过程中反应的离子方程式为
(3)调
 的目的是除去
的目的是除去 ,则
,则 的调控范围是
的调控范围是 的目的是除去
的目的是除去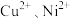 ,则除
,则除 转化的离子方程式为
转化的离子方程式为(4)电解中生成
 的电极反应式为
的电极反应式为
您最近一年使用:0次
名校
解题方法
6 . 氯化钡广泛应用于化工领域,其某种生产流程如图所示:

请回答下列问题:
(1)复杂矿物的主要成分为 ,还含有少量
,还含有少量 、
、 ,若采用稀硫酸进行浸出提纯,其中发生反应的离子方程式是
,若采用稀硫酸进行浸出提纯,其中发生反应的离子方程式是_______ ,提纯后的矿料进一步研磨的目的是_______ 。
(2)步骤①中 与焦炭反应的化学方程式为
与焦炭反应的化学方程式为_______ ;实际生产中必须加入过量的焦炭,其主要目的是_______ 。
(3)“系列操作”是指蒸发浓缩、_______ 、_______ 、洗涤、干燥;其中在实验室中进行蒸发浓缩,除用到酒精灯、三脚架外,还需用到的仪器有_______ 。

请回答下列问题:
(1)复杂矿物的主要成分为
 ,还含有少量
,还含有少量 、
、 ,若采用稀硫酸进行浸出提纯,其中发生反应的离子方程式是
,若采用稀硫酸进行浸出提纯,其中发生反应的离子方程式是(2)步骤①中
 与焦炭反应的化学方程式为
与焦炭反应的化学方程式为(3)“系列操作”是指蒸发浓缩、
您最近一年使用:0次
2022-07-07更新
|
113次组卷
|
2卷引用:海南省2021-2022学年高二下学期学业水平诊断化学试题
名校
解题方法
7 . 李克强总理在十二届全国人大五次会议上作政府工作报告时强调:坚决打好蓝天保卫战。今年二氧化硫、氮氧化物排放量要分别下降3%,重点地区细颗粒物(PM2.5)浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为___________
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。现向2 L恒容密闭容器中加入2 mol CO2、6 mol H2,在恒温下发生反应。10 s后反应达到平衡,此时容器内CH3OH的浓度为0.5 mol·L-1,请回答以下问题:
(1)前10 s内的平均反应速率v(H2O)=___________ ;平衡时CO2的转化率为___________ 。
(2)下列叙述能说明原反应达到平衡状态的是___________ 。
a.单位时间内消耗n mol CH3OH的同时生成n mol CO2
b.1 mol CO2生成的同时有3 mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2溶解在水中,形成一种稀酸溶液,然后与Ca(OH)2浊液等发生中和反应。
(1)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是___________
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(2)请写出脱硫过程发生的主要化学方程式:___________ 。
Ⅰ.脱硝:催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。现向2 L恒容密闭容器中加入2 mol CO2、6 mol H2,在恒温下发生反应。10 s后反应达到平衡,此时容器内CH3OH的浓度为0.5 mol·L-1,请回答以下问题:
(1)前10 s内的平均反应速率v(H2O)=
(2)下列叙述能说明原反应达到平衡状态的是
a.单位时间内消耗n mol CH3OH的同时生成n mol CO2
b.1 mol CO2生成的同时有3 mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2溶解在水中,形成一种稀酸溶液,然后与Ca(OH)2浊液等发生中和反应。
(1)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(2)请写出脱硫过程发生的主要化学方程式:
您最近一年使用:0次
2021-05-19更新
|
970次组卷
|
8卷引用:海南省儋州川绵中学2021-2022学年高二上学期第二次月考化学试题
海南省儋州川绵中学2021-2022学年高二上学期第二次月考化学试题河北省辛集中学2020-2021学年高二下学期期中考试化学试题江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷B卷化学试题(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.1 化学平衡状态(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)河南省南乐县第一高级中学2021-2022学年高二上学期9月半月考化学试题河南省商丘市宁陵县高级中学2023-2024学年高二上学期第一次考试化学试题河北省辛集中学2020-2021学年高一下学期期中考试化学试题
解题方法
8 . 高铁酸钾(K2FeO4)是一种新型、高效的多功能绿色消毒剂,下列为制备K2FeO4的几种方案。按要求回答下列问题:
方案一:以绿矾(FeSO4·7H2O)为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4)可降低生产成本且产品质量优,工艺流程如图:
FeSO4溶液 铁黄(FeOOH)
铁黄(FeOOH) Na2FeO4
Na2FeO4 K2FeO4晶体
K2FeO4晶体
(1)写出由高铁酸钠制得高铁酸钾的化学方程式:___________ 。
方案二:以硫酸铁为原料加入过量NaOH溶液,同时加入NaClO溶液。充分反应后,加入过量饱和KOH溶液,使高铁酸钾析出。
(2)此方案中生成高铁酸钠的离子方程式为___________ 。
(3)碱性条件下,氧化性:NaClO___________ (填“>”或“<”)Na2FeO4。
方案三:若将FeSO4固体和Na2O2固体混合,一定条件下可以先制得高铁酸钠;其主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,再转化为高铁酸钾。
(4)该反应中的氧化剂为___________ (填化学式),每生成标准状况下112 mL气体,转移电子的物质的量为___________ mol。
方案一:以绿矾(FeSO4·7H2O)为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4)可降低生产成本且产品质量优,工艺流程如图:
FeSO4溶液
 铁黄(FeOOH)
铁黄(FeOOH) Na2FeO4
Na2FeO4 K2FeO4晶体
K2FeO4晶体(1)写出由高铁酸钠制得高铁酸钾的化学方程式:
方案二:以硫酸铁为原料加入过量NaOH溶液,同时加入NaClO溶液。充分反应后,加入过量饱和KOH溶液,使高铁酸钾析出。
(2)此方案中生成高铁酸钠的离子方程式为
(3)碱性条件下,氧化性:NaClO
方案三:若将FeSO4固体和Na2O2固体混合,一定条件下可以先制得高铁酸钠;其主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,再转化为高铁酸钾。
(4)该反应中的氧化剂为
您最近一年使用:0次



