名校
1 . 二氧化氯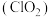 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下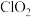 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备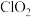 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和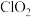 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
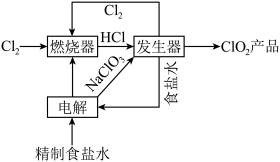
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是___________ ,属于电解质的是___________ 。
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有___________ 。
(3)“发生器”中发生反应的离子方程式为___________ ,若整个过程制得 ,则理论上分别向装置中补充
,则理论上分别向装置中补充___________ (填质量和物质名称)恢复至起始状态。
(4)粗盐中常常含有泥沙、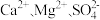 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的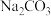 的目的是
的目的是___________ ,经一系列操作可得制食盐水,电解精制食盐水制得 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为___________ 。
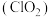 是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下
是一种新型的消毒杀剂,常用于饮用水的消毒,其消市效果优于传统的液氯消毒,除此之外,二氧化氯还具有漂白性,常用干纸浆和纸、纤维、小麦面粉、淀粉的漂白。常温常压下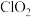 是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备
是一种带有辛辣气味的黄绿色气体,易溶于水和四氯化碳。工业上常用综合法制备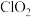 ,其工序包括制备氯酸钠,盐酸合成和
,其工序包括制备氯酸钠,盐酸合成和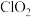 制取,主要工艺流程如图所示。
制取,主要工艺流程如图所示。
回答下列问题:
(1)工艺流程图涉及到的物质化学式或物质名称,其中能导电的是
(2)实验室模拟“燃烧器”中发生的反应,观察到的现象有
(3)“发生器”中发生反应的离子方程式为
 ,则理论上分别向装置中补充
,则理论上分别向装置中补充(4)粗盐中常常含有泥沙、
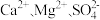 等杂质,粗盐提纯的步骤中加入稍过量的
等杂质,粗盐提纯的步骤中加入稍过量的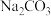 的目的是
的目的是 同时还会获取轻质燃料氢气,则离子方程式为
同时还会获取轻质燃料氢气,则离子方程式为
您最近一年使用:0次
2 . 氧钒碱式碳酸铵晶体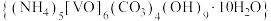 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的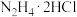 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用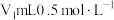 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗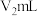 盐酸。
盐酸。
已知: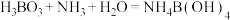 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
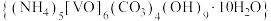 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的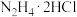 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
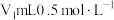 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗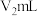 盐酸。
盐酸。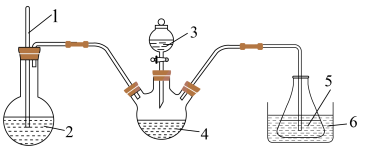
已知:
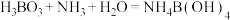 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近一年使用:0次
解题方法
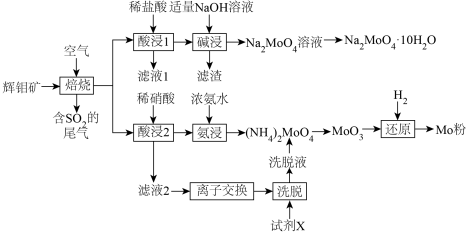
3 . 金属钼(Mo)及其化合物在合金工业中起着重要的作用,生产中常常以辉钼矿(主要成分为 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
已知:①Mo的常见价态有+4、+6价。
②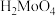 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。
③氧气不足时,焙烧产物中可能混有 与
与 反应生成的
反应生成的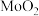 。
。
回答下列问题:
(1)焙烧的产物中Mo元素主要以 、
、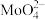 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式______________________ 。
(2)与酸浸1相比,酸浸2使用稀硝酸的优点是___________ ,但是缺点是造成 的污染。
的污染。
(3)滤渣的成分主要是___________ 。碱浸时应控制pH不宜过大,原因是______________ 。
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为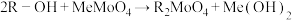 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为___________ 。
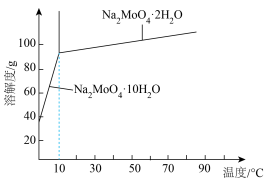
(5)钼酸钠某些晶体的溶解度曲线如图,获得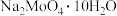 的操作为蒸发浓缩、
的操作为蒸发浓缩、___________ 、过滤、洗涤。
(6)工业上还有电氧化法 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
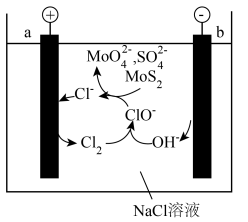
每生成0.1mol 时,外电路转移的电子数为
时,外电路转移的电子数为___________ (阿伏加德罗常数的值用 表示)
表示)
(7) 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为___________ 。滴定终点的现象为___________ 。
取m g 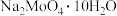 (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL,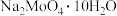 的百分含量为
的百分含量为___________ (写出表达式即可)。
 ,含有FeS、CuS、
,含有FeS、CuS、 等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
等杂质)为原料制备金属钼及其化合物。以下是生产的部分流程。
已知:①Mo的常见价态有+4、+6价。
②
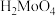 是微溶于水的无机酸,可溶于碱。
是微溶于水的无机酸,可溶于碱。③氧气不足时,焙烧产物中可能混有
 与
与 反应生成的
反应生成的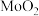 。
。回答下列问题:
(1)焙烧的产物中Mo元素主要以
 、
、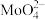 盐的形式存在。生成有
盐的形式存在。生成有 的化学方程式
的化学方程式(2)与酸浸1相比,酸浸2使用稀硝酸的优点是
 的污染。
的污染。(3)滤渣的成分主要是
(4)已知离子交换环节,阴离子交换树脂R-OH工作原理为
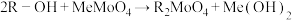 (Me代表金属阳离子),洗脱时使用的试剂X为
(Me代表金属阳离子),洗脱时使用的试剂X为(5)钼酸钠某些晶体的溶解度曲线如图,获得
 的操作为蒸发浓缩、
的操作为蒸发浓缩、
(6)工业上还有电氧化法
 制备
制备 的方法,装置如下图所示
的方法,装置如下图所示
每生成0.1mol
 时,外电路转移的电子数为
时,外电路转移的电子数为 表示)
表示)(7)
 中可能混有
中可能混有 ,以硝酸铅
,以硝酸铅 为标准液测量
为标准液测量 的纯度。根据下表信息,应选用的指示剂为
的纯度。根据下表信息,应选用的指示剂为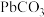 | 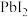 | PbS | 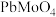 | |
 | 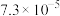 |  | 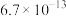 | 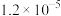 |
| 颜色 | 白色 | 亮黄色 | 黑色 | 白色 |
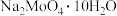 (式量为M)样品配成200mL溶液,取出20.00mL用c mol/L
(式量为M)样品配成200mL溶液,取出20.00mL用c mol/L 标准溶液进行滴定,消耗标准液V mL,
标准溶液进行滴定,消耗标准液V mL,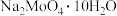 的百分含量为
的百分含量为
您最近一年使用:0次
名校
解题方法
4 . 氮元素对动植物有重要作用,研究氮的循环和转化对生产、生活有重要的价值。
(1)工业制硝酸的原理示意图可简略表示如下(D、E各代表一种物质,反应条件和部分生成物已略去):

①实验室用上图装置制备氨气的反应方程式是___________ 。
②由 是制硝酸的重要反应之一,其反应方程式为
是制硝酸的重要反应之一,其反应方程式为___________ 。
(2)某实验小组为验证E与水反应的产物,设计如下装置进行实验(夹持装置已略去,装置气密性已检验)。
实验步骤如下:

步骤Ⅰ:打开 、
、 、
、 ,关闭
,关闭 、
、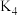 ,通入一段时间
,通入一段时间 ,关闭
,关闭 ;
;
步骤Ⅱ:打开 ,加入足量浓硝酸,同时打开pH传感器和
,加入足量浓硝酸,同时打开pH传感器和 传感器,记录数据如下:[pH越小表示
传感器,记录数据如下:[pH越小表示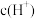 越大];
越大];

步骤Ⅲ:5min后,打开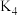 用注射器将少量空气注入三颈烧瓶,关闭
用注射器将少量空气注入三颈烧瓶,关闭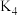 。
。
回答下列问题:
①“步骤Ⅰ”中“通入一段时间 ”的目的是
”的目的是___________ 。
②“步骤Ⅱ”中“打开 ,加入足量浓硝酸”时,可观察到:圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,同时烧瓶上方有
,加入足量浓硝酸”时,可观察到:圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,同时烧瓶上方有___________ 色气体产生;片刻后,三颈烧瓶内的导管口有气泡冒出。
③“步骤Ⅲ”中“用注射器将少量空气注入三颈烧瓶”的目的是检验___________ (填化学式)。
④根据“步骤Ⅱ”的数据采集和“步骤Ⅲ”的实验现象,得到E与水反应的离子方程式为___________ 。
⑤有同学认为该实验不严谨,传感器所记录的数据结果也可能是因为___________ 造成的。
(1)工业制硝酸的原理示意图可简略表示如下(D、E各代表一种物质,反应条件和部分生成物已略去):

①实验室用上图装置制备氨气的反应方程式是
②由
 是制硝酸的重要反应之一,其反应方程式为
是制硝酸的重要反应之一,其反应方程式为(2)某实验小组为验证E与水反应的产物,设计如下装置进行实验(夹持装置已略去,装置气密性已检验)。
实验步骤如下:

步骤Ⅰ:打开
 、
、 、
、 ,关闭
,关闭 、
、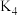 ,通入一段时间
,通入一段时间 ,关闭
,关闭 ;
;步骤Ⅱ:打开
 ,加入足量浓硝酸,同时打开pH传感器和
,加入足量浓硝酸,同时打开pH传感器和 传感器,记录数据如下:[pH越小表示
传感器,记录数据如下:[pH越小表示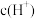 越大];
越大];
步骤Ⅲ:5min后,打开
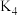 用注射器将少量空气注入三颈烧瓶,关闭
用注射器将少量空气注入三颈烧瓶,关闭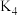 。
。回答下列问题:
①“步骤Ⅰ”中“通入一段时间
 ”的目的是
”的目的是②“步骤Ⅱ”中“打开
 ,加入足量浓硝酸”时,可观察到:圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,同时烧瓶上方有
,加入足量浓硝酸”时,可观察到:圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,同时烧瓶上方有③“步骤Ⅲ”中“用注射器将少量空气注入三颈烧瓶”的目的是检验
④根据“步骤Ⅱ”的数据采集和“步骤Ⅲ”的实验现象,得到E与水反应的离子方程式为
⑤有同学认为该实验不严谨,传感器所记录的数据结果也可能是因为
您最近一年使用:0次
名校
解题方法
5 . 某化学兴趣小组利用下图装置(部分夹持装置省略)制备氯气并探究其性质:
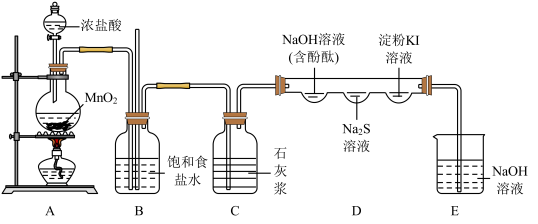
回答以下问题:
(1)装置A中发生反应的离子方程式为_______ ,0.4 mol HCl发生反应时,转移电子的物质的量为_______ 。
(2)利用装置C模拟工业制备漂白粉,写出该反应的化学方程式_______ 。若C中导管口堵塞,则B中观察到的现象是_______ 。
(3)实验进行一段时间后,装置D中含酚酞的NaOH溶液红色逐渐褪去,产生该现象的原因可能为:①氯气溶于水呈酸性,与氢氧化钠发生中和反应使溶液褪色;②_______ 。
(4)随着反应进行,装置D中 溶液处观察到的现象为
溶液处观察到的现象为_______ ;淀粉KI溶液处先变蓝后褪色,原因是氯气氧化碘单质生成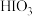 ,写出褪色过程的化学方程式
,写出褪色过程的化学方程式_______ 。
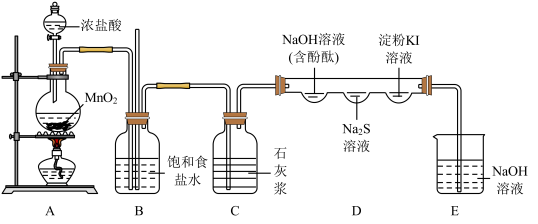
回答以下问题:
(1)装置A中发生反应的离子方程式为
(2)利用装置C模拟工业制备漂白粉,写出该反应的化学方程式
(3)实验进行一段时间后,装置D中含酚酞的NaOH溶液红色逐渐褪去,产生该现象的原因可能为:①氯气溶于水呈酸性,与氢氧化钠发生中和反应使溶液褪色;②
(4)随着反应进行,装置D中
 溶液处观察到的现象为
溶液处观察到的现象为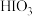 ,写出褪色过程的化学方程式
,写出褪色过程的化学方程式
您最近一年使用:0次
2023-02-10更新
|
358次组卷
|
2卷引用:山东省潍坊市2022-2023学年高一上学期期末考试化学试题
解题方法
6 . 氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[CVO)6(CO3)4(OH)9]•10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。
已知:①氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇;
②VO2+有较强还原性,易被氧化。
实验室以V2O5为原料制备该晶体的流程如图:
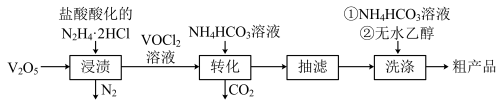
请回答下列问题:
(1)“浸渍”时反应的化学方程式为___________ 。
(2)“转化”时需要在CO2氛围中进行的原因是___________ 。
(3)“转化”可在下图装置中进行:
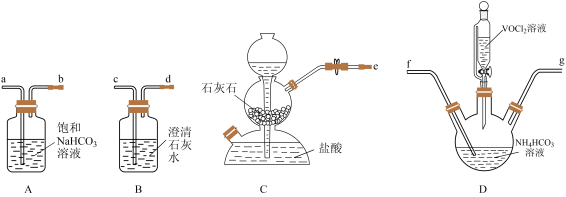
①上述装置连接的合理顺序为e→___________ (按气流方向,用小写字母表示)。
②写出装置D中生成氧钮(Ⅳ)碱式碳酸铵晶体的化学方程式___________ 。
(4)“抽滤”装置如图所示,抽滤原理是___________ 。

(5)“洗涤”时用饱和NH4HCO3溶液洗涤晶体,检验晶体已洗涤干净的操作是___________ 。
(6)为测定粗产品中钒元素的含量,称取l.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后加入0.01mol/LKMnO4溶液至稍过量,充分反应后继续滴加2%的NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,滴入几滴铁氰化钾K3[Fe(CN)6]溶液,最后用0.2mol/L(NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为20.00mL。(已知粗产品中杂质不含钒,也不参与反应;滴定反应为
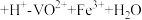 )
)
①滴定终点时的现象为___________ 。
②粗产品中钒元素的质量分数为___________ %。
已知:①氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇;
②VO2+有较强还原性,易被氧化。
实验室以V2O5为原料制备该晶体的流程如图:

请回答下列问题:
(1)“浸渍”时反应的化学方程式为
(2)“转化”时需要在CO2氛围中进行的原因是
(3)“转化”可在下图装置中进行:

①上述装置连接的合理顺序为e→
②写出装置D中生成氧钮(Ⅳ)碱式碳酸铵晶体的化学方程式
(4)“抽滤”装置如图所示,抽滤原理是

(5)“洗涤”时用饱和NH4HCO3溶液洗涤晶体,检验晶体已洗涤干净的操作是
(6)为测定粗产品中钒元素的含量,称取l.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后加入0.01mol/LKMnO4溶液至稍过量,充分反应后继续滴加2%的NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,滴入几滴铁氰化钾K3[Fe(CN)6]溶液,最后用0.2mol/L(NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为20.00mL。(已知粗产品中杂质不含钒,也不参与反应;滴定反应为

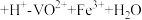 )
)①滴定终点时的现象为
②粗产品中钒元素的质量分数为
您最近一年使用:0次
7 . 三氯化六氨合钴 是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用
是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用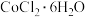 晶体制备
晶体制备 的实验步骤如下:
的实验步骤如下:
i.在锥形瓶中,将 溶于水中,加热至沸,加入研细的
溶于水中,加热至沸,加入研细的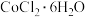 晶体,溶解得到混合溶液;
晶体,溶解得到混合溶液;
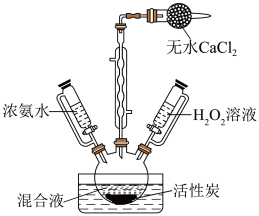
ii.将上述混合液倒入三颈烧瓶中,加入活性炭。冷却,利用如图装置先加入浓氨水,再逐滴加入5% 溶液,水浴加热至50~60℃,保持20min;
溶液,水浴加热至50~60℃,保持20min;
iii.然后用冰浴冷却至0℃左右,吸滤,把沉淀溶于50mL沸水中,经操作X后,慢慢加入浓盐酸于滤液中,即有大量橙黄色晶体( ,
,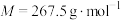 )析出;
)析出;
iv.用冰浴冷却后吸滤,晶体以冷的盐酸洗涤,再用少许乙醇洗涤,吸干。回答下列问题:
(1)步骤i中,研细晶体所用的仪器名称为________ ,无水 的作用是
的作用是________ 。
(2)写出制备三氯化六氨合钴的化学方程式___________ 。
(3)步骤i中操作X为___________ 。
(4)取0.2000g 样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴
样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴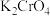 溶液做指示剂,用0.0600
溶液做指示剂,用0.0600 的
的 溶液滴定至终点时,消耗
溶液滴定至终点时,消耗 溶液的体积为10.00mL,样品的纯度为
溶液的体积为10.00mL,样品的纯度为___________ 。
(5)某兴趣小组为探究 的还原性,设计如下实验:
的还原性,设计如下实验:
实验I:粉红色的 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验II:向0.1
 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验III:按下图装置进行实验,观察到电压表指针偏转。

根据实验III得出结论: 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。
另一名同学设计了实验IV,否定了该结论,请说明实验IV的操作和现象___________ 。
 是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用
是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用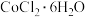 晶体制备
晶体制备 的实验步骤如下:
的实验步骤如下:i.在锥形瓶中,将
 溶于水中,加热至沸,加入研细的
溶于水中,加热至沸,加入研细的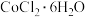 晶体,溶解得到混合溶液;
晶体,溶解得到混合溶液;ii.将上述混合液倒入三颈烧瓶中,加入活性炭。冷却,利用如图装置先加入浓氨水,再逐滴加入5%
 溶液,水浴加热至50~60℃,保持20min;
溶液,水浴加热至50~60℃,保持20min;
iii.然后用冰浴冷却至0℃左右,吸滤,把沉淀溶于50mL沸水中,经操作X后,慢慢加入浓盐酸于滤液中,即有大量橙黄色晶体(
 ,
,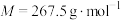 )析出;
)析出;iv.用冰浴冷却后吸滤,晶体以冷的盐酸洗涤,再用少许乙醇洗涤,吸干。回答下列问题:
(1)步骤i中,研细晶体所用的仪器名称为
 的作用是
的作用是(2)写出制备三氯化六氨合钴的化学方程式
(3)步骤i中操作X为
(4)取0.2000g
 样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴
样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴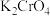 溶液做指示剂,用0.0600
溶液做指示剂,用0.0600 的
的 溶液滴定至终点时,消耗
溶液滴定至终点时,消耗 溶液的体积为10.00mL,样品的纯度为
溶液的体积为10.00mL,样品的纯度为(5)某兴趣小组为探究
 的还原性,设计如下实验:
的还原性,设计如下实验:实验I:粉红色的
 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验II:向0.1

 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验III:按下图装置进行实验,观察到电压表指针偏转。

根据实验III得出结论:
 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。另一名同学设计了实验IV,否定了该结论,请说明实验IV的操作和现象
您最近一年使用:0次
名校
8 . 二氯异氰尿酸钠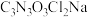 为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:

已知:实验原理为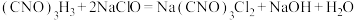
(1)仪器a的名称为_______ ,装置A中的药品可以是_______ (填一种化学式)。
(2)实验发现装置B中 溶液的利用率较低,改进方法是
溶液的利用率较低,改进方法是_______ 。
(3)①当装置B内出现_______ 现象时,打开装置B的活塞加入 溶液,在反应过程中仍不断通入
溶液,在反应过程中仍不断通入 的目的是
的目的是_______ 。
②实验过程中B的温度必须保持为7℃~12℃, 值控制在6.5~8.5的范围,则该实验的控温方式是
值控制在6.5~8.5的范围,则该实验的控温方式是_______ 。若温度过高, 过低,会生成
过低,会生成 和
和 等,写出该反应的化学方程式
等,写出该反应的化学方程式_______ 。
(4)二氯异氰尿酸钠缓慢水解产生 消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取
消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取 样品,用容量瓶配成
样品,用容量瓶配成 溶液;取
溶液;取 上述溶液于碘量瓶中,加入适量稀硫酸和过量
上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,密封在暗处静置
溶液,密封在暗处静置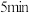 ;用
;用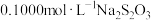 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液
溶液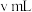 。
。
已知:实验检测原理为: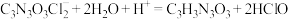

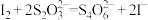
①该样品的氯元素含量_______ %(用含a、v的代数式表示)
②下列操作会导致样品的氯元素含量测定值偏高的是_______ (填标号)。
a.盛装 标准溶液的滴定管未润洗
标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸过量
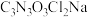 为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
已知:实验原理为
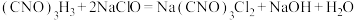
(1)仪器a的名称为
(2)实验发现装置B中
 溶液的利用率较低,改进方法是
溶液的利用率较低,改进方法是(3)①当装置B内出现
 溶液,在反应过程中仍不断通入
溶液,在反应过程中仍不断通入 的目的是
的目的是②实验过程中B的温度必须保持为7℃~12℃,
 值控制在6.5~8.5的范围,则该实验的控温方式是
值控制在6.5~8.5的范围,则该实验的控温方式是 过低,会生成
过低,会生成 和
和 等,写出该反应的化学方程式
等,写出该反应的化学方程式(4)二氯异氰尿酸钠缓慢水解产生
 消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取
消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取 样品,用容量瓶配成
样品,用容量瓶配成 溶液;取
溶液;取 上述溶液于碘量瓶中,加入适量稀硫酸和过量
上述溶液于碘量瓶中,加入适量稀硫酸和过量 溶液,密封在暗处静置
溶液,密封在暗处静置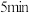 ;用
;用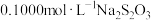 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液
溶液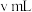 。
。已知:实验检测原理为:
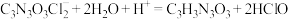

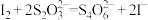
①该样品的氯元素含量
②下列操作会导致样品的氯元素含量测定值偏高的是
a.盛装
 标准溶液的滴定管未润洗
标准溶液的滴定管未润洗b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸过量
您最近一年使用:0次
9 . 硫酸氧钒(VOSO4)对高血糖、高血脂有治疗作用,也是钒电池不可或缺的电解质。制备 的实验流程如下:
的实验流程如下:
①向仪器a中加入 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的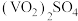 溶液;
溶液;
②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到 溶液(蓝黑色);
溶液(蓝黑色);
③ 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。
实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是_______ ,用仪器b滴加浓硫酸时,_______ (填“需要”或“不需要”)打开上端的玻璃塞。
(2)反应中最适宜的加热方式为_______ ,在a中反应生成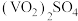
_______ (“是”或“不是”)氧化还原反应。
(3)反应液由橙红色变为蓝黑色的化学方程式为_______ 。
(4)纯度测定:准确称取 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为_______ %。
(5)性质探究:查阅资料后,有同学对 的热分解提出了两种猜想:
的热分解提出了两种猜想:
猜想ⅰ. ;
;
猜想ⅱ.
欲采用如下装置探究:
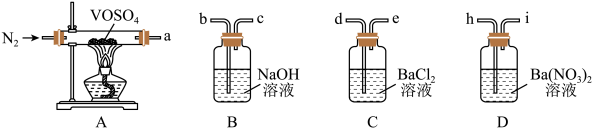
选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→_______ ;若气体流经的装置均有气泡产生,则上述所选必要装置中可观察的现象为_______ ,证明猜想ⅱ正确。
 的实验流程如下:
的实验流程如下:①向仪器a中加入
 ,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的
,打开仪器b滴入一定量的浓硫酸,在85℃搅拌下充分反应,得到橙红色的 溶液;
溶液;②冷却后,向所得溶液中加入草酸(H2C2O4)充分搅拌,得到
 溶液(蓝黑色);
溶液(蓝黑色);③
 溶液经结晶、过滤得到纯蓝色的
溶液经结晶、过滤得到纯蓝色的 晶体,
晶体, 晶体脱水、干燥,得到
晶体脱水、干燥,得到 产品。
产品。实验装置如图所示(夹持、加热装置及磁力搅拌器已省略)。回答下列问题:

(1)仪器c的名称是
(2)反应中最适宜的加热方式为
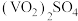
(3)反应液由橙红色变为蓝黑色的化学方程式为
(4)纯度测定:准确称取
 产品m g,配成100mL溶液,用
产品m g,配成100mL溶液,用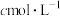 的酸性
的酸性 溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性
溶液滴定(滴定反应的产物中,V元素为+5价,Mn元素为+2价),滴定终点时,消耗酸性 溶液的体积为V mL,
溶液的体积为V mL, 的摩尔质量为
的摩尔质量为 ,则该产品的纯度为
,则该产品的纯度为(5)性质探究:查阅资料后,有同学对
 的热分解提出了两种猜想:
的热分解提出了两种猜想:猜想ⅰ.
 ;
;猜想ⅱ.

欲采用如下装置探究:

选择必要的仪器装置,按气流从左到右的流向,探究分解产物的导管接口顺序为a→
您最近一年使用:0次
2023-02-08更新
|
312次组卷
|
2卷引用:山东省泰安市2022-2023学年高三上学期1月期末考试化学试题
名校
解题方法
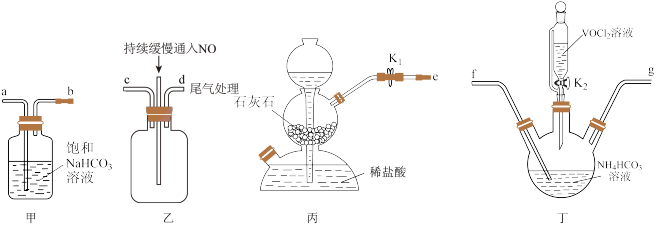
10 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO ;
;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是___________ 。
(2)上述实验装置中,依次连接的合理顺序为h→___________ 。
(3)装置D中酸性KMnO4溶液的作用是___________ (用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为___________ 。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol·L-1酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为___________ mg·L-1。若所取样品在空气中放置时间过长,则测定结果___________ (填“偏高”“偏低”或“无影响”)。有关反应如下:5NO +2MnO
+2MnO +6H+=5NO
+6H+=5NO +2Mn2++3H2O;5C2O
+2Mn2++3H2O;5C2O +2MnO
+2MnO +16H+=2Mn2++10CO2↑十8H2O。
+16H+=2Mn2++10CO2↑十8H2O。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO
 ;
;③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是
(2)上述实验装置中,依次连接的合理顺序为h→
(3)装置D中酸性KMnO4溶液的作用是
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol·L-1酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为
 +2MnO
+2MnO +6H+=5NO
+6H+=5NO +2Mn2++3H2O;5C2O
+2Mn2++3H2O;5C2O +2MnO
+2MnO +16H+=2Mn2++10CO2↑十8H2O。
+16H+=2Mn2++10CO2↑十8H2O。
您最近一年使用:0次



