1 . 利用含钴废料(主要成分为 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: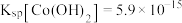 ;
;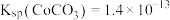 。
。
请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为 和
和___________ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为___________ 。
(2)“萃取”时 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层) ,若萃取剂的量一定时,
,若萃取剂的量一定时,___________ (填“一次萃取”或“少量多次萃取”)的萃取效率更高。若“酸浸”后浸出液的 ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为___________ (结果保留一位小数,溶液体积变化忽略不计)。
(3)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为___________ 。
(4)可以通过电解 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是___________ 。若Ⅱ室溶液中溶质的质量增加了 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为___________ 。
 、
、 、
、 、
、 以及
以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: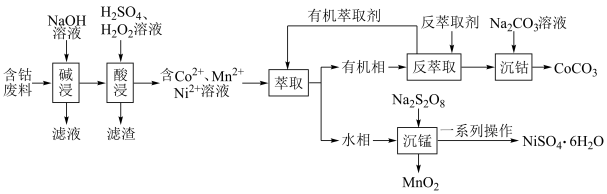
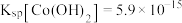 ;
;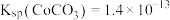 。
。请回答下列问题:
(1)“碱浸”时所得滤液中溶质的主要成分为
 和
和 发生反应的总离子方程式为
发生反应的总离子方程式为(2)“萃取”时
 萃取的反应原理如下:
萃取的反应原理如下: (有机层)
(有机层)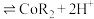 ,若萃取剂的量一定时,
,若萃取剂的量一定时, ,
, ,萃取完成后水相中
,萃取完成后水相中 为
为 ,则钴的萃取率为
,则钴的萃取率为(3)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为
,则“沉锰”时发生反应的离子方程式为(4)可以通过电解
 溶液获得单质
溶液获得单质 和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是
和较浓的盐酸,其工作原理如图所示,其中膜a和膜b中,属于阳离子交换膜的是 ,则理论上获得的单质
,则理论上获得的单质 的质量为
的质量为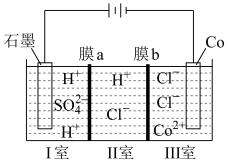
您最近一年使用:0次
解题方法
2 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、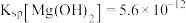 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、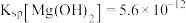 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
180次组卷
|
3卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
3 . 部分元素的单质及其化合物(或其溶液)的转化关系如图。已知A是生活中使用广泛的金属单质,常温下B是无色无味的液体,E是胃酸的主要成分。
(1)写出下列物质的化学式:E___________ ;G___________ 。
(2)反应①的化学方程式为___________ ;反应②的离子方程式为___________ 。
(3)F溶液常温下呈浅绿色,该溶液中金属阳离子为___________ (填离子符号),反应④中氧化剂和还原剂的物质的量之比为___________ 。
(4)Cl2通入到石灰乳中可以制成一种常用的消毒剂,其有效成分为___________ (填化学式)。
(1)写出下列物质的化学式:E
(2)反应①的化学方程式为
(3)F溶液常温下呈浅绿色,该溶液中金属阳离子为
(4)Cl2通入到石灰乳中可以制成一种常用的消毒剂,其有效成分为
您最近一年使用:0次
解题方法
4 . 以下是有关铝的实验探究,请回答相关问题:
(1)用铝粉和 做铝热反应实验,需要的试剂还有___________。
做铝热反应实验,需要的试剂还有___________。
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 反应的化学方程式
反应的化学方程式___________ 。
(3)向集满 的铝制易拉罐中加入过量
的铝制易拉罐中加入过量 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:___________ 。
(4)用打磨过的铝片进行如下实验,下列分析不合理的是___________
(5)某铝土矿的主要成分为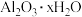 ,还含有
,还含有 和
和 杂质(已知
杂质(已知 难溶于水,且与稀硫酸及其它成分均不反应)。称取
难溶于水,且与稀硫酸及其它成分均不反应)。称取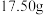 铝土矿样品,加入
铝土矿样品,加入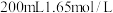 的稀硫酸,恰好完全反应,过滤得沉淀
的稀硫酸,恰好完全反应,过滤得沉淀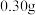 ,然后在滤液中加入足量的
,然后在滤液中加入足量的 溶液,得到沉淀
溶液,得到沉淀 。
。
①该试样中 的物质的量为
的物质的量为___________  。
。
②样品中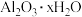 的
的
___________ 。
(1)用铝粉和
 做铝热反应实验,需要的试剂还有___________。
做铝热反应实验,需要的试剂还有___________。A. | B. | C. | D. |
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和
 反应的化学方程式
反应的化学方程式(3)向集满
 的铝制易拉罐中加入过量
的铝制易拉罐中加入过量 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:(4)用打磨过的铝片进行如下实验,下列分析不合理的是___________

| A.①中铝片发生了钝化 |
| B.②中产生的气泡是氮氧化合物,不是氢气 |
C.③中沉淀溶解的离子方程式是 |
| D.②中加水稀释过程中,仅发生了氧化还原反应 |
(5)某铝土矿的主要成分为
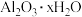 ,还含有
,还含有 和
和 杂质(已知
杂质(已知 难溶于水,且与稀硫酸及其它成分均不反应)。称取
难溶于水,且与稀硫酸及其它成分均不反应)。称取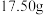 铝土矿样品,加入
铝土矿样品,加入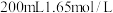 的稀硫酸,恰好完全反应,过滤得沉淀
的稀硫酸,恰好完全反应,过滤得沉淀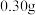 ,然后在滤液中加入足量的
,然后在滤液中加入足量的 溶液,得到沉淀
溶液,得到沉淀 。
。①该试样中
 的物质的量为
的物质的量为 。
。②样品中
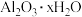 的
的
您最近一年使用:0次
解题方法
5 .  是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
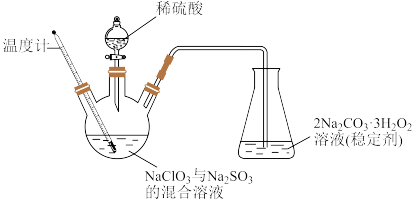
(1)盛装稀硫酸的仪器名称为___________ ;控制温度为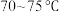 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为___________ ;写出生成 反应的化学方程式:
反应的化学方程式:___________ 。
(2)长导管的作用为___________ 。
(3)使用过碳酸钠( ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)稳定液中的 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。
①请分析盐酸活化效果最好的原因:___________ 。
②使用盐酸作活化剂时发生反应的离子方程式为___________ 。
 是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
(1)盛装稀硫酸的仪器名称为
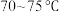 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为 反应的化学方程式:
反应的化学方程式:(2)长导管的作用为
(3)使用过碳酸钠(
 ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:(4)稳定液中的
 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。活化剂用量 活化率 活化剂 | 5mL | 10mL | 15mL | 20mL | 25mL |
盐酸 | 29.32% | 58.02% | 86.91% | 99.57% | 100.00% |
醋酸 | 26.75% | 55.52% | 79.01% | 97.22% | 97.53% |
柠檬酸 | 20.03% | 41.22% | 52.13% | 53.76% | 59.80% |
②使用盐酸作活化剂时发生反应的离子方程式为
您最近一年使用:0次
2024-03-31更新
|
112次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
6 . 以废旧催化剂(主要成分为 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
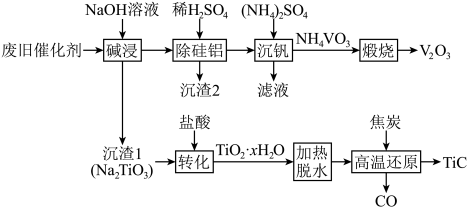
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是_______ (填化学式),实验室中将“沉渣1”从“碱浸”所得的悬浊液中分离出来所需玻璃仪器的名称为_______ 。
(2)“沉渣2”中含有两种成分,它们的化学式为_______ 。
(3)“转化”时发生反应的化学方程式为_______ 。
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为_______ 。
(5)“高温还原”时 发生反应的化学方程式为
发生反应的化学方程式为_______ ,若生成30g还原产物,则转移电子的物质的量为_______ 。
 、
、 ,还含有少量的
,还含有少量的 、
、 )为主要原料制备
)为主要原料制备 、
、 的工艺流程如图所示:
的工艺流程如图所示:
回答下列问题:
(1)“碱浸”后溶液中含钒元素的溶质是
(2)“沉渣2”中含有两种成分,它们的化学式为
(3)“转化”时发生反应的化学方程式为
(4)“煅烧”时生成一种刺激性气味的气体,检验该气体常使用的试纸为
(5)“高温还原”时
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
7 . 以某工厂矿渣(主要含有 、
、 、
、 、
、 及少量
及少量 、
、 )为原料制备金属银及
)为原料制备金属银及 的工艺流程如图所示{已知:
的工艺流程如图所示{已知: }。
}。
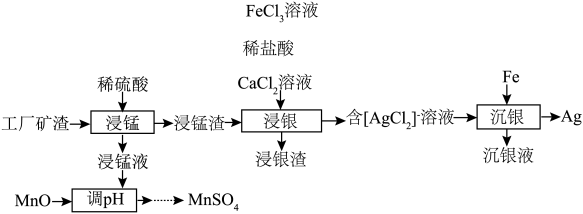
回答下列问题:
(1)“浸锰”时,发生反应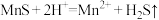 、
、 与
与 反应生成
反应生成 、
、 、
、 ,
, 残留于浸锰渣中。
残留于浸锰渣中。
①为了提高“浸锰”速率,可采取的措施为_______ (任写一种)。
② 发生反应时,消耗的
发生反应时,消耗的 与
与 物质的量之比为
物质的量之比为_______ 。
(2)“浸银”时,使用过量 、
、 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 的形式浸出。
的形式浸出。
①“浸银渣”的主要成分是_______ (填化学式)。
②配平“浸银”反应的离子方程式:_______ 。
_______ _______
_______ _______
_______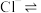 _______
_______ _______
_______ _______S。
_______S。
③结合平衡移动原理,解释浸出剂中 的作用:
的作用:_______ 。
(3)一定温度下,“沉银”时Ag的沉淀率随反应时间的变化如图所示。
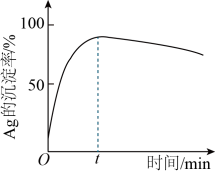
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②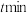 后Ag的沉淀率逐渐减小的原因可能是
后Ag的沉淀率逐渐减小的原因可能是_______ 。
 、
、 、
、 、
、 及少量
及少量 、
、 )为原料制备金属银及
)为原料制备金属银及 的工艺流程如图所示{已知:
的工艺流程如图所示{已知: }。
}。
回答下列问题:
(1)“浸锰”时,发生反应
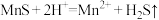 、
、 与
与 反应生成
反应生成 、
、 、
、 ,
, 残留于浸锰渣中。
残留于浸锰渣中。①为了提高“浸锰”速率,可采取的措施为
②
 发生反应时,消耗的
发生反应时,消耗的 与
与 物质的量之比为
物质的量之比为(2)“浸银”时,使用过量
 、
、 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 的形式浸出。
的形式浸出。①“浸银渣”的主要成分是
②配平“浸银”反应的离子方程式:
_______
 _______
_______ _______
_______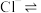 _______
_______ _______
_______ _______S。
_______S。③结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)一定温度下,“沉银”时Ag的沉淀率随反应时间的变化如图所示。

①
 参加反应的离子方程式为
参加反应的离子方程式为②
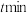 后Ag的沉淀率逐渐减小的原因可能是
后Ag的沉淀率逐渐减小的原因可能是
您最近一年使用:0次
8 . 铵铁蓝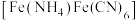 主要用于涂料和油墨工业等,工业上制备铵铁蓝的步骤如下:
主要用于涂料和油墨工业等,工业上制备铵铁蓝的步骤如下:
步骤1:在45℃左右条件下,将 、
、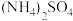 与
与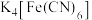 溶于水,用稀硫酸调节混合液的
溶于水,用稀硫酸调节混合液的 ,反应生成白色沉淀
,反应生成白色沉淀 ,用
,用 溶液检验
溶液检验 是否完全沉淀;
是否完全沉淀;
步骤2:过滤后加入稀硫酸和 ,加热条件下反应,经洗涤、干燥得
,加热条件下反应,经洗涤、干燥得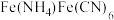 。回答下列问题:
。回答下列问题:
(1)“步骤1”的装置如图所示(加热装置已省略)。
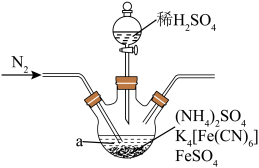
①仪器a的名称为_______ 。
②不断的通入 的目的为
的目的为_______ 。
③反应完成时溶液中,若 、
、 、
、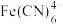 的浓度分别为
的浓度分别为 、
、 、
、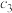 ,则
,则
_______ 。
(2)“步骤2”反应生成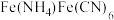 的化学方程式为
的化学方程式为_______ ;“洗涤”时,检验产品是否洗涤干净的试剂为_______ 。
(3)实验室制取并配制 溶液,用以检验
溶液,用以检验 是否完全沉淀:将
是否完全沉淀:将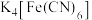 的饱和溶液在60℃以下进行电解,生成
的饱和溶液在60℃以下进行电解,生成 及副产品
及副产品 。待电解液中
。待电解液中 含量达
含量达 时开始冷却结晶、分离、干燥,制得
时开始冷却结晶、分离、干燥,制得 ,配制
,配制 的
的 溶液。
溶液。
① 中Fe元素的化合价为
中Fe元素的化合价为_______ 。
②电解时,阴极的电极反应为_______ ,“分离”时玻璃棒的作用为_______ 。
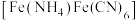 主要用于涂料和油墨工业等,工业上制备铵铁蓝的步骤如下:
主要用于涂料和油墨工业等,工业上制备铵铁蓝的步骤如下:步骤1:在45℃左右条件下,将
 、
、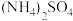 与
与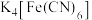 溶于水,用稀硫酸调节混合液的
溶于水,用稀硫酸调节混合液的 ,反应生成白色沉淀
,反应生成白色沉淀 ,用
,用 溶液检验
溶液检验 是否完全沉淀;
是否完全沉淀;步骤2:过滤后加入稀硫酸和
 ,加热条件下反应,经洗涤、干燥得
,加热条件下反应,经洗涤、干燥得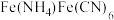 。回答下列问题:
。回答下列问题:(1)“步骤1”的装置如图所示(加热装置已省略)。

①仪器a的名称为
②不断的通入
 的目的为
的目的为③反应完成时溶液中,若
 、
、 、
、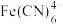 的浓度分别为
的浓度分别为 、
、 、
、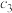 ,则
,则
(2)“步骤2”反应生成
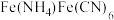 的化学方程式为
的化学方程式为(3)实验室制取并配制
 溶液,用以检验
溶液,用以检验 是否完全沉淀:将
是否完全沉淀:将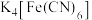 的饱和溶液在60℃以下进行电解,生成
的饱和溶液在60℃以下进行电解,生成 及副产品
及副产品 。待电解液中
。待电解液中 含量达
含量达 时开始冷却结晶、分离、干燥,制得
时开始冷却结晶、分离、干燥,制得 ,配制
,配制 的
的 溶液。
溶液。①
 中Fe元素的化合价为
中Fe元素的化合价为②电解时,阴极的电极反应为
您最近一年使用:0次
9 . 金属铅在工业生产、国防建设和医学诊疗等方面都有着重要的应用,废旧铅蓄电池随意丢弃会造成环境污染,可以按照如图工艺制备高纯 、芒硝
、芒硝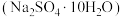 等。
等。
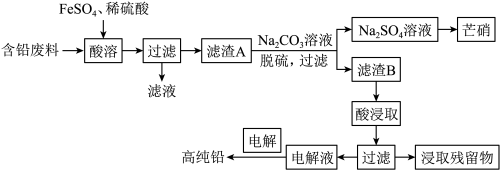
已知:①铅蓄电池的含铅废料主要成分为 、
、 、
、 、
、 。
。
② 是一种无机强酸。
是一种无机强酸。
回答下列问题:
(1)为了加快酸溶的速率,可采取的方法有___________ (写一种即可),酸溶过程中 被
被 还原时发生反应的离子方程式为
还原时发生反应的离子方程式为___________ ,检验酸溶后过滤的滤液中是否有 ,可以选择的试剂为
,可以选择的试剂为___________ (填标号)。
A.酸性高锰酸钾溶液 B.稀硝酸
C. 溶液 D.
溶液 D.
(2)向滤渣 中加入
中加入 溶液实现脱硫,滤渣
溶液实现脱硫,滤渣 为
为___________ (填化学式);滤渣B需要洗涤干净,检验滤渣B洗涤干净的一种方法是取最后一次洗涤液,滴加___________ (填标号),通过现象进行判断。
a.稀盐酸 b.稀硫酸
c.氯化钡溶液 d.氢氧化钠溶液
(3)一般采用 溶液与滤渣
溶液与滤渣 反应,生成
反应,生成 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;以石墨为阳极、高纯铅为阴极,电解 溶液(溶液呈弱酸性,整个过程中
溶液(溶液呈弱酸性,整个过程中 不参与反应)制备铅,阳极的电极反应式为
不参与反应)制备铅,阳极的电极反应式为___________ ,当电路中转移 电子时,阴极理论上增重
电子时,阴极理论上增重___________ g。
 、芒硝
、芒硝 等。
等。
已知:①铅蓄电池的含铅废料主要成分为
 、
、 、
、 、
、 。
。②
 是一种无机强酸。
是一种无机强酸。回答下列问题:
(1)为了加快酸溶的速率,可采取的方法有
 被
被 还原时发生反应的离子方程式为
还原时发生反应的离子方程式为 ,可以选择的试剂为
,可以选择的试剂为A.酸性高锰酸钾溶液 B.稀硝酸
C.
 溶液 D.
溶液 D.
(2)向滤渣
 中加入
中加入 溶液实现脱硫,滤渣
溶液实现脱硫,滤渣 为
为a.稀盐酸 b.稀硫酸
c.氯化钡溶液 d.氢氧化钠溶液
(3)一般采用
 溶液与滤渣
溶液与滤渣 反应,生成
反应,生成 、
、 和
和 ,该反应的化学方程式为
,该反应的化学方程式为 溶液(溶液呈弱酸性,整个过程中
溶液(溶液呈弱酸性,整个过程中 不参与反应)制备铅,阳极的电极反应式为
不参与反应)制备铅,阳极的电极反应式为 电子时,阴极理论上增重
电子时,阴极理论上增重
您最近一年使用:0次
10 . 氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。
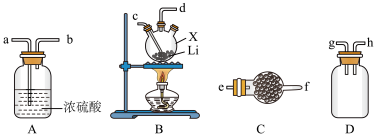
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为_______ (用小写字母和“→”表示),装置A的作用是_______ 。
(3)装置B中仪器X的名称是_______ ,装置C盛装的试剂是_______ 。实验开始后,向X中通入NH3与加热仪器X的先后顺序为_______ 。
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为_______ ,检验该气体产物的方法是_______ 。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
| A.浓氨水、CaO | B.NH4Cl固体、Ca(OH)2固体 |
| C.浓氨水 | D.NH4NO3固体、NaOH固体 |
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为
(3)装置B中仪器X的名称是
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为
您最近一年使用:0次



