名校
1 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为___________ g。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到___________ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:___________ 。
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____ +_________。
+_________。
该反应完毕的现象标志是___________ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是___________ 。
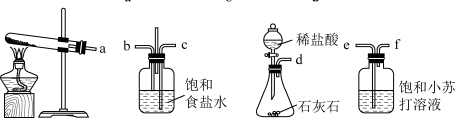
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
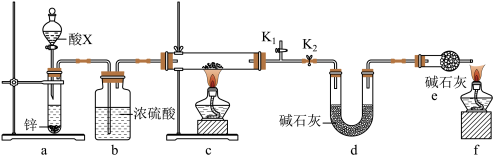
①装置a中所加的酸X是___________ (填化学式)。
②通过测定下列物理量,能达到实验目的的是___________ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是___________ 。
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:
_______Cu2++_______Br-+_______SO2+_______H2O=______CuBr↓+_____
 +_________。
+_________。该反应完毕的现象标志是
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2:关闭K1②检查装置的气密性③连接仪器④关闭K2,打开K1,通氢气一段时间。
您最近一年使用:0次
名校
2 . 某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
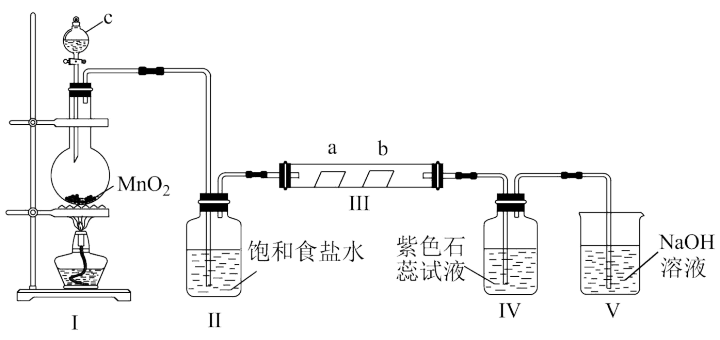
(1)装置Ⅰ中仪器c的名称是___________ ,实验室以二氧化锰和浓盐酸制备氯气的化学方程式为___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)若产生的Cl2足量,实验过程中装置Ⅳ中的实验现象是___________ 。
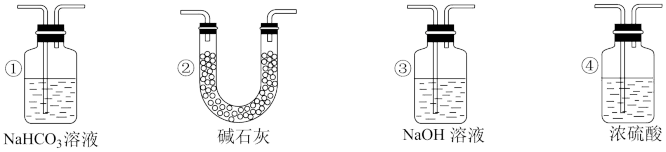
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的___________ 装置(填序号)。
(5)除了Cl2能够对自来水杀菌消毒外,工业中还常用高铁酸钾(K2FeO4)作为高效、多功能的自来水处理剂,高铁酸钾与水反应时,能生成Fe(OH)3胶体吸附杂质净水,同时还产生一种气体,写出该原理的离子方程式___________ ,每生成1mol该气体,K2FeO4转移的电子数目为___________ NA。

(1)装置Ⅰ中仪器c的名称是
(2)装置Ⅱ的作用是
(3)若产生的Cl2足量,实验过程中装置Ⅳ中的实验现象是
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的

(5)除了Cl2能够对自来水杀菌消毒外,工业中还常用高铁酸钾(K2FeO4)作为高效、多功能的自来水处理剂,高铁酸钾与水反应时,能生成Fe(OH)3胶体吸附杂质净水,同时还产生一种气体,写出该原理的离子方程式
您最近一年使用:0次
2021-12-18更新
|
293次组卷
|
2卷引用:河南省郑州市部分中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
3 . 含氮物质是中学化学中的一类常见物质,在人们的生产、生活活动中有重要作用,并产生了深远的影响。
(1)实验室中,采用一定浓度的 溶液和
溶液和 溶液作为反应物,通过加热可制备少量
溶液作为反应物,通过加热可制备少量 ,反应的离子方程式是
,反应的离子方程式是_______ ,收集 的方法是
的方法是_______ (填标号)。
(2)“侯氏制碱法”是中国人的骄傲。某学习小组模拟“侯氏制碱法”原理,在实验室中制备少量 ,使用的装置如图:
,使用的装置如图:
装置接口正确的连接顺序为_______ (填接口序号),由该装置可知,该实验中制备 的试剂是
的试剂是_______ (填化学式)。
(3)该学习小组在实验中,将 溶液滴入
溶液滴入 的
的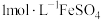 溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①实验目的:通过实验探究溶液产生棕色的原因。
②查阅资料:常温下,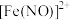 在溶液中能稳定存在,溶液为棕色,受热分解释放出
在溶液中能稳定存在,溶液为棕色,受热分解释放出 。
。
③提出猜想:溶液中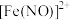 的棕色掩盖了
的棕色掩盖了 的黄色。
的黄色。
④设计实验、验证猜想
⑤现象分析、交流讨论滴加 溶液变红,说明溶液中存在的离子是
溶液变红,说明溶液中存在的离子是_______ (写离子符号),若猜想成立,则“实验2”还应有的现象是_______ 。溶液变棕色的离子方程式是_______ 、 。
。
⑥优化实验:请你设计一个简单的实验,验证“猜想”是否成立。实验设计:_______ ,预期的实验现象及结论:_______ 。
(1)实验室中,采用一定浓度的
 溶液和
溶液和 溶液作为反应物,通过加热可制备少量
溶液作为反应物,通过加热可制备少量 ,反应的离子方程式是
,反应的离子方程式是 的方法是
的方法是
(2)“侯氏制碱法”是中国人的骄傲。某学习小组模拟“侯氏制碱法”原理,在实验室中制备少量
 ,使用的装置如图:
,使用的装置如图:
装置接口正确的连接顺序为
 的试剂是
的试剂是(3)该学习小组在实验中,将
 溶液滴入
溶液滴入 的
的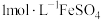 溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。①实验目的:通过实验探究溶液产生棕色的原因。
②查阅资料:常温下,
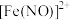 在溶液中能稳定存在,溶液为棕色,受热分解释放出
在溶液中能稳定存在,溶液为棕色,受热分解释放出 。
。③提出猜想:溶液中
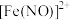 的棕色掩盖了
的棕色掩盖了 的黄色。
的黄色。④设计实验、验证猜想
| 实验序号 | 操作方法 | 现象 |
| 1 | 取上述滴有 溶液的棕色混合液,向其中滴加稀 溶液的棕色混合液,向其中滴加稀 溶液 溶液 | 溶液迅速变为红色 |
| 2 | 取上述棕色混合液,按如图所示加热 | 试管口处有红棕色气体逸出 |
 溶液变红,说明溶液中存在的离子是
溶液变红,说明溶液中存在的离子是 。
。⑥优化实验:请你设计一个简单的实验,验证“猜想”是否成立。实验设计:
您最近一年使用:0次
2022-03-13更新
|
288次组卷
|
2卷引用:广东省碧桂园学校2021-2022学年高三下学期 3月综合能力测试化学试题
解题方法
4 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为_______ 。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到_______ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□ +□_____。
+□_____。_______ ,该反应完毕的现象标志是_______ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是_______ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
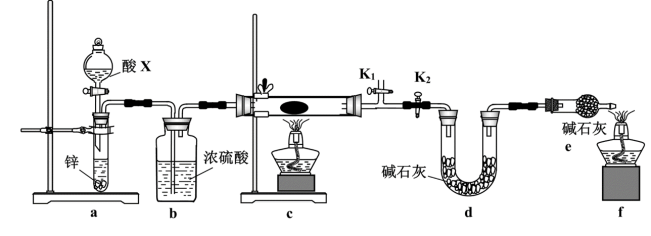
①装置a中所加的酸X是_______ (填化学式)。
②通过测定下列物理量,能达到实验目的的是_______ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是_______ 。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□
 +□_____。
+□_____。(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是
您最近一年使用:0次
5 . 根据下列实验设计,回答问题:
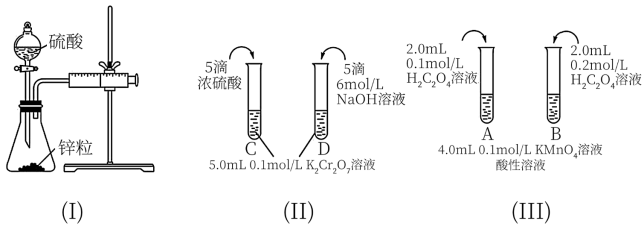
(1)利用实验(Ⅰ)探究锌与0.1 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:___________ 。
(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知: (橙色)
(橙色)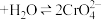 (黄色)
(黄色)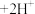 推测D试管中实验现象为
推测D试管中实验现象为___________ ,用平衡移动原理解释原因:___________ 。
(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为___________ ,推测该实验设计能否达到实验目的并描述判断理由:___________ 。
(4)某小组也用酸性KMnO4溶液和草酸( )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:
①实验i、实验ii可得出的结论是___________ 。
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
提供试剂:0.01 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。
补全实验iii的操作:向试管中先加入5 0.01
0.01 酸性
酸性 溶液,
溶液,___________ ,最后加入5 0.1
0.1 草酸溶液。
草酸溶液。

(1)利用实验(Ⅰ)探究锌与0.1
 硫酸和2
硫酸和2 硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:
硫酸反应的速率,可以测定收集一定体积氢气所用的时间。检查该装置气密性的操作是:(2)实验(Ⅱ)探究浓度对化学化学平衡的影响。
已知:
 (橙色)
(橙色)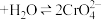 (黄色)
(黄色)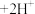 推测D试管中实验现象为
推测D试管中实验现象为(3)实验(Ⅲ)目的是探究浓度对反应速率的影响,实验中反应离子方程式为
(4)某小组也用酸性KMnO4溶液和草酸(
 )溶液进行实验,实验操作及现象如下表:
)溶液进行实验,实验操作及现象如下表:| 编号 | 实验操作 | 实验现象 |
| i | 向一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入1滴3 溶液,再加入1滴3 硫酸和9滴蒸馏水,最后加入5 硫酸和9滴蒸馏水,最后加入5 0.1 0.1 草酸溶液 草酸溶液 | 前10 内溶液紫色无明显变化,后颜色逐渐变浅,30 内溶液紫色无明显变化,后颜色逐渐变浅,30 后几乎变为无色 后几乎变为无色 |
| ii | 向另一支试管中先加入5 0.01 0.01 酸性 酸性 溶液,再加入10滴3 溶液,再加入10滴3 硫酸,最后加入5 硫酸,最后加入5 0.1m 0.1m 草酸溶液 草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
②关于实验ii中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的
 对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。
对反应有催化作用。利用提供的试剂设计实验iii,验证猜想。提供试剂:0.01
 酸性
酸性 溶液,0.1
溶液,0.1 草酸溶液,3
草酸溶液,3 硫酸,
硫酸, 溶液,
溶液, 固体,蒸馏水。
固体,蒸馏水。补全实验iii的操作:向试管中先加入5
 0.01
0.01 酸性
酸性 溶液,
溶液, 0.1
0.1 草酸溶液。
草酸溶液。
您最近一年使用:0次
2021-11-05更新
|
379次组卷
|
4卷引用:广东省广州市2022-2023学年高二上学期期中考试化学试题
6 . 某小组为探究 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
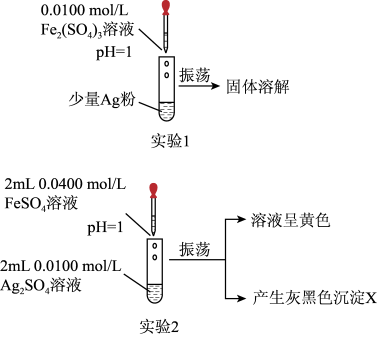
(1)实验1:如图所示,可得出的实验结论是___________ 。该实验不选用 的原因是
的原因是___________ 。
(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:___________ 。
②请用离子方程式解释产生红棕色气体的原因:___________ 。
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。
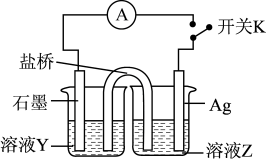
①溶液Y为___________ 。
②为实现该实验目的,接下来的操作及现象为___________ 。
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知,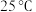 下,
下,  (白色)
(白色) 
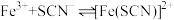 (红色)
(红色) 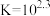
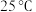 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液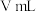 ,用
,用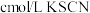 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗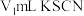 标准溶液。
标准溶液。
①判断滴定终点现象为___________ ;
②实验2试管中反应的平衡常数
___________ 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因:___________ 。
 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
(1)实验1:如图所示,可得出的实验结论是
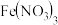 的原因是
的原因是(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:
②请用离子方程式解释产生红棕色气体的原因:
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。

①溶液Y为
②为实现该实验目的,接下来的操作及现象为
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知,
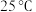 下,
下,  (白色)
(白色) 
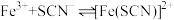 (红色)
(红色) 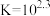
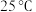 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液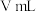 ,用
,用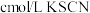 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗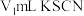 标准溶液。
标准溶液。①判断滴定终点现象为
②实验2试管中反应的平衡常数

③不取用实验1反应后所得清液测定反应的平衡常数的原因:
您最近一年使用:0次
解题方法
7 . 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可用下图装置由氯气与一氧化氮在常温常压下合成。 ,打开
,打开 、
、 ,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭
,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭 ,打开
,打开 ,打开分液漏斗塞子,向装置a中滴入适量稀硝酸。待装置C中某一现象发生时,关闭
,打开分液漏斗塞子,向装置a中滴入适量稀硝酸。待装置C中某一现象发生时,关闭 ,打开
,打开 ,在三颈烧瓶中制备亚硝酰氯。
,在三颈烧瓶中制备亚硝酰氯。
请回答:
(1)写出铜与稀硝酸反应的离子方程式:___________ 。
(2)写出亚硝酰氯与NaOH溶液反应生成亚硝酸钠的化学方程式:___________ 。
(3)仪器a的名称是___________ ,装置B的作用是___________ 。
(4)步骤划线处,装置C出现的现象是___________ 。
(5)下列说法不正确的是___________。
(6)若制得的NOCl中含有少量 杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mLNaOH溶液中,加入几滴
杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mLNaOH溶液中,加入几滴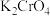 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的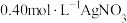 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗 溶液50.00mL。则样品的纯度为
溶液50.00mL。则样品的纯度为___________ %(保留1位小数)。
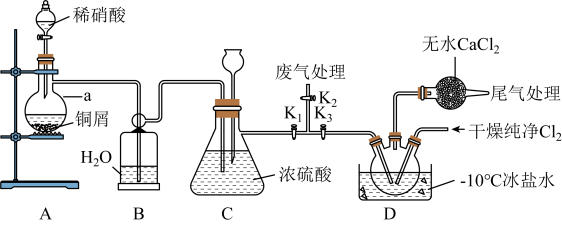
 ,打开
,打开 、
、 ,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭
,通入一段时间的氯气,直至三颈烧瓶中充满黄绿色气体,关闭 ,打开
,打开 ,打开分液漏斗塞子,向装置a中滴入适量稀硝酸。待装置C中某一现象发生时,关闭
,打开分液漏斗塞子,向装置a中滴入适量稀硝酸。待装置C中某一现象发生时,关闭 ,打开
,打开 ,在三颈烧瓶中制备亚硝酰氯。
,在三颈烧瓶中制备亚硝酰氯。请回答:
(1)写出铜与稀硝酸反应的离子方程式:
(2)写出亚硝酰氯与NaOH溶液反应生成亚硝酸钠的化学方程式:
(3)仪器a的名称是
(4)步骤划线处,装置C出现的现象是
(5)下列说法不正确的是___________。
| A.从安全或避免环境污染方面考虑,宜在通风橱内进行实验 |
| B.若不慎亚硝酰氯接触到皮肤,及时用流动清水反复冲洗 |
C.浓硫酸和无水 仅起阻止水蒸气进入,避免亚硝酰氯水解的作用 仅起阻止水蒸气进入,避免亚硝酰氯水解的作用 |
| D.冰盐水温度可达-10℃,装置D三颈烧瓶中充满黄色气体NOCl |
 杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mLNaOH溶液中,加入几滴
杂质,为测定产品纯度进行如下实验:称取1.6625g样品溶于50.00mLNaOH溶液中,加入几滴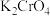 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的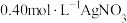 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗 溶液50.00mL。则样品的纯度为
溶液50.00mL。则样品的纯度为
您最近一年使用:0次
解题方法
8 . 实验室制备 并探究其性质及应用的方案如下。回答下列问题:
并探究其性质及应用的方案如下。回答下列问题:
(1)制备 (部分固定装置略)
(部分固定装置略)
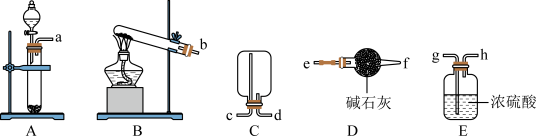
①制备二氧化硫可以选择装置_______ (填大写字母),其反应的化学方程式为_______ 。
②利用图中装置收集一瓶干燥的 ,其连接顺序:发生装置
,其连接顺序:发生装置
_______ (按气流方向,填小写字母)。
(2)制备大苏打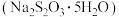
已知 在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和
在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和 。
。
①将 通入装有
通入装有 、
、 混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入
混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入 气体,当溶液中再次出现
气体,当溶液中再次出现_______ 现象时,反应基本结束。
②将①反应后的溶液蒸发浓缩,冷却结晶,过滤,洗涤,_______ ,可得到 固体。
固体。
③为提高结晶效果,冷却结晶时可往溶液中加入_______ 。
 并探究其性质及应用的方案如下。回答下列问题:
并探究其性质及应用的方案如下。回答下列问题:(1)制备
 (部分固定装置略)
(部分固定装置略)
①制备二氧化硫可以选择装置
②利用图中装置收集一瓶干燥的
 ,其连接顺序:发生装置
,其连接顺序:发生装置
(2)制备大苏打
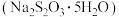

已知
 在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和
在35℃以上的干燥空气中容易失去结晶水,难溶于乙醇.其水溶液在弱酸性条件下易反应生成S和 。
。①将
 通入装有
通入装有 、
、 混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入
混合溶液的圆底烧瓶中,溶液颜色变化依次为无色、黄色、无色。继续通入 气体,当溶液中再次出现
气体,当溶液中再次出现②将①反应后的溶液蒸发浓缩,冷却结晶,过滤,洗涤,
 固体。
固体。③为提高结晶效果,冷却结晶时可往溶液中加入
您最近一年使用:0次
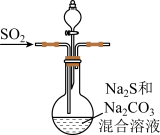
9 . 硫代硫酸钠(Na2S2O3)是重要的化工原料易溶于水,在中性或碱性环境下稳定,在酸性溶液水,分解产生S、SO2。
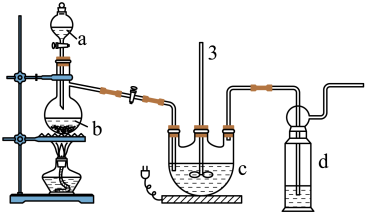
Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为_____ 。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是_____ 。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_____ 。
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品_____ 。
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O
 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)
ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O
(5)根据实验①的现象,初步判断最终Fe3+被S2O 还原为Fe2+,通过
还原为Fe2+,通过_____ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅰ的现象:_____ 。
(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是_____ 。
(7)进一步探究Ag+和S2O 反应。
反应。
实验③中白色絮状沉淀最后变为黑色沉淀(Ag2S)的化学方程式如下,填入合适的物质和系数:_____ 。
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和_____ 有关(写出两条)。

Ⅰ.Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示,其C中试剂为Na2S和Na2SO3的混合液。
(1)b中反应的离子方程式为
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是
(4)制备得到的Na2S2O3中可能含有Na2SO3、Na2SO4等杂质。设计实验,检测产品中是否存在Na2SO4:取少量产品
Ⅱ.探究Na2S2O3与金属阳离子的氧化还原反应。
资料:ⅰ.Fe3++3S2O

 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)ⅱ.Ag2S2O3为白色沉淀,Ag2S2O3可溶于过量的S2O

| 装置 | 编号 | 试剂X | 实验现象 |
 | ① | Fe(NO3)3溶液 | 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
| ② | AgNO3溶液 | 先生成白色絮状沉淀,振荡后,沉淀溶解,得到无色溶液 |
(5)根据实验①的现象,初步判断最终Fe3+被S2O
 还原为Fe2+,通过
还原为Fe2+,通过(6)同浓度氧化性:Ag+>Fe3+。实验②中Ag+未发生氧化还原反应的原因是
(7)进一步探究Ag+和S2O
 反应。
反应。| 装置 | 编号 | 试剂X | 实验现象 |
 | ② | AgNO3溶液 | 先生成白色絮状沉淀,沉淀很快变成黄色、棕色,最后为黑色沉淀。 |
Ag2S2O3+_____=Ag2S+_____
(8)根据以上实验,Na2S2O3与金属阳离子发生氧化还原反应和
您最近一年使用:0次
名校
解题方法
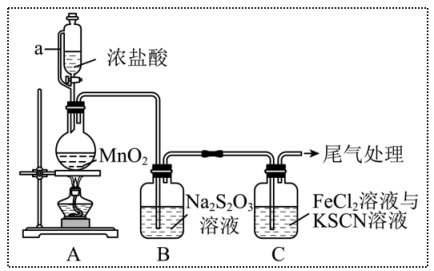
10 . 某同学用如图装置制备Cl2并探究其性质。查阅资料知:
i. 酸性条件下与H+迅速反应生成S和SO2
酸性条件下与H+迅速反应生成S和SO2
ii. 有较强的还原性,
有较强的还原性, 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_______ ;尾气处理用_______ (填化学式)溶液吸收。
(2)装置A中制备Cl2的化学方程式为_______ 。
(3)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是_______ 。
(4)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_______ 。
(5)装置C中溶液颜色先变为血红色,一段时间后褪色。某同学对褪色原因提出假设:
①假设1:Fe3+被Cl2氧化为更高价态;
②假设2:_______ ;
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,_______ (写出操作及现象)说明假设2成立。

i.
 酸性条件下与H+迅速反应生成S和SO2
酸性条件下与H+迅速反应生成S和SO2ii.
 有较强的还原性,
有较强的还原性, 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)装置A中制备Cl2的化学方程式为
(3)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是
(4)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(5)装置C中溶液颜色先变为血红色,一段时间后褪色。某同学对褪色原因提出假设:
①假设1:Fe3+被Cl2氧化为更高价态;
②假设2:
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,
您最近一年使用:0次



