解题方法
1 . 二氧化氯 是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于
是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于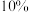 时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:
时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:
(1)实验室可用下图所示装置(夹持仪器已省略)制备 水溶液:
水溶液:
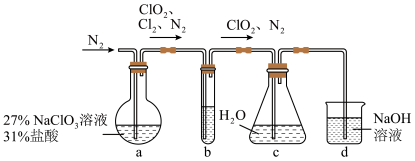
①装置 的反应产物中
的反应产物中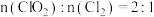 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
②装置 中盛放的试剂可能是
中盛放的试剂可能是___________ (填字母)。
A.饱和食盐水 B.浓硫酸 C.饱和 溶液 D.饱和
溶液 D.饱和 溶液
溶液
③在整个实验过程中持续通入 的目的是
的目的是___________ 。
(2) 不仅可消毒杀菌,还可脱除水体中的
不仅可消毒杀菌,还可脱除水体中的 等还原性物质。
等还原性物质。
①向含 的溶液中通入
的溶液中通入 产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的
产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的 溶液,产生白色沉淀。写出
溶液,产生白色沉淀。写出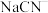 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
②写出 将水体中的
将水体中的 氧化成
氧化成 ,同时本身被还原为
,同时本身被还原为 的离子方程式:
的离子方程式:___________ 。
(3)碘量法测定二氧化氯水溶液(含少量 )中
)中 和
和 的浓度的主要实验步骤如下:
的浓度的主要实验步骤如下:
步骤①:向锥形瓶中加入 蒸馏水、
蒸馏水、 溶液(足量),再向其中加入
溶液(足量),再向其中加入 某二氧化氯水溶液(发生反应:
某二氧化氯水溶液(发生反应: ,
, )。
)。
步骤②:用 标准溶液滴定(
标准溶液滴定( )至浅黄色,再加入
)至浅黄色,再加入 淀粉溶液,继续滴定至蓝色刚好消失,消耗
淀粉溶液,继续滴定至蓝色刚好消失,消耗 标准溶液
标准溶液 。
。
步骤③:向步骤②的溶液中加入 硫酸溶液酸化,发生反应:
硫酸溶液酸化,发生反应: 。
。
步骤④:重复步骤②操作,第二次滴定又消耗 的
的 溶液
溶液 。
。
由上述数据可计算出该二氧化氯水溶液中 的浓度为
的浓度为___________ (保留四位有效数字,下同)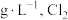 的浓度为
的浓度为___________  。
。
 是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于
是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于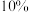 时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:
时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:(1)实验室可用下图所示装置(夹持仪器已省略)制备
 水溶液:
水溶液:
①装置
 的反应产物中
的反应产物中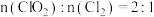 ,发生反应的离子方程式为
,发生反应的离子方程式为②装置
 中盛放的试剂可能是
中盛放的试剂可能是A.饱和食盐水 B.浓硫酸 C.饱和
 溶液 D.饱和
溶液 D.饱和 溶液
溶液③在整个实验过程中持续通入
 的目的是
的目的是(2)
 不仅可消毒杀菌,还可脱除水体中的
不仅可消毒杀菌,还可脱除水体中的 等还原性物质。
等还原性物质。①向含
 的溶液中通入
的溶液中通入 产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的
产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的 溶液,产生白色沉淀。写出
溶液,产生白色沉淀。写出 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:②写出
 将水体中的
将水体中的 氧化成
氧化成 ,同时本身被还原为
,同时本身被还原为 的离子方程式:
的离子方程式:(3)碘量法测定二氧化氯水溶液(含少量
 )中
)中 和
和 的浓度的主要实验步骤如下:
的浓度的主要实验步骤如下:步骤①:向锥形瓶中加入
 蒸馏水、
蒸馏水、 溶液(足量),再向其中加入
溶液(足量),再向其中加入 某二氧化氯水溶液(发生反应:
某二氧化氯水溶液(发生反应: ,
, )。
)。步骤②:用
 标准溶液滴定(
标准溶液滴定( )至浅黄色,再加入
)至浅黄色,再加入 淀粉溶液,继续滴定至蓝色刚好消失,消耗
淀粉溶液,继续滴定至蓝色刚好消失,消耗 标准溶液
标准溶液 。
。步骤③:向步骤②的溶液中加入
 硫酸溶液酸化,发生反应:
硫酸溶液酸化,发生反应: 。
。步骤④:重复步骤②操作,第二次滴定又消耗
 的
的 溶液
溶液 。
。由上述数据可计算出该二氧化氯水溶液中
 的浓度为
的浓度为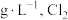 的浓度为
的浓度为 。
。
您最近一年使用:0次
解题方法
2 . 锂被誉为“高能金属”,以废旧锂离子电池的正极材料(主要含有 及少量
及少量 、
、 等)为原料制备
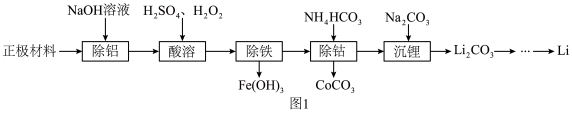
等)为原料制备 的一种工艺流程如图1所示。
的一种工艺流程如图1所示。
回答下列问题:
(1)“除铝”时所得溶液中含铝微粒为___________ (填化学式,下同)。
(2)“酸溶”时,若用浓盐酸代替 和
和 的混合液,则有一种黄绿色气体生成,该反应的还原剂为
的混合液,则有一种黄绿色气体生成,该反应的还原剂为___________ 。
(3)该流程中涉及过滤,实验室过滤时玻璃棒的作用为___________ 。
(4)写出“除钴”过程中发生反应的离子方程式:___________ 。
(5)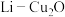 电池是近年来发明的一种低成本高效电池,该电池首先通过
电池是近年来发明的一种低成本高效电池,该电池首先通过 与
与 反应产生
反应产生 ,然后通过还原反应再生,电池结构如图2所示。
,然后通过还原反应再生,电池结构如图2所示。
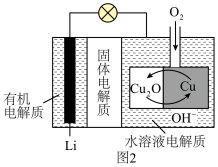
①正极反应式为___________ 。
②每转移 电子,理论上消耗
电子,理论上消耗___________ 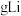 。
。
(6)锂—空气二次电池的反应原理为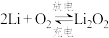 ,其放电时的工作原理如图3所示。
,其放电时的工作原理如图3所示。
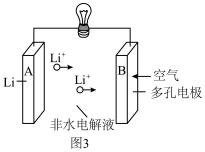
①充电时阳极电极反应式为___________ 。
②放电时,若B极增重 ,则通过外电路电子的物质的量为
,则通过外电路电子的物质的量为___________  。
。
 及少量
及少量 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图1所示。
的一种工艺流程如图1所示。
回答下列问题:
(1)“除铝”时所得溶液中含铝微粒为
(2)“酸溶”时,若用浓盐酸代替
 和
和 的混合液,则有一种黄绿色气体生成,该反应的还原剂为
的混合液,则有一种黄绿色气体生成,该反应的还原剂为(3)该流程中涉及过滤,实验室过滤时玻璃棒的作用为
(4)写出“除钴”过程中发生反应的离子方程式:
(5)
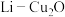 电池是近年来发明的一种低成本高效电池,该电池首先通过
电池是近年来发明的一种低成本高效电池,该电池首先通过 与
与 反应产生
反应产生 ,然后通过还原反应再生,电池结构如图2所示。
,然后通过还原反应再生,电池结构如图2所示。
①正极反应式为
②每转移
 电子,理论上消耗
电子,理论上消耗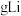 。
。(6)锂—空气二次电池的反应原理为
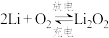 ,其放电时的工作原理如图3所示。
,其放电时的工作原理如图3所示。
①充电时阳极电极反应式为
②放电时,若B极增重
 ,则通过外电路电子的物质的量为
,则通过外电路电子的物质的量为 。
。
您最近一年使用:0次
解题方法
3 . 硫酸镍一般用于电镀、催化剂制备和医药制造等领域。电镀污泥中主要含有Cr2O3、CuO、NiO、Al2O3、Fe2O3和SiO2等物质。一种从电镀污泥制备回收金属铜和制备硫酸镍晶体的工艺流程如图1,回答下列问题:
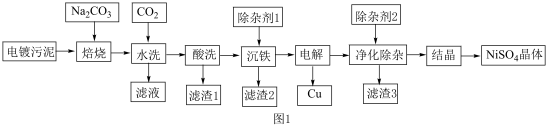
已知:①“焙烧”时Cr2O3和Al2O3分别转化为Na2CrO4、NaAlO2
②Na2CrO4溶液中存在平衡: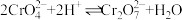
(1)“焙烧”时,Cr2O3参与反应的化学方程式为___________ 。
(2)提高“酸洗”的速率的措施为___________ 、___________ (写出两种措施)。
(3)“酸洗”后,滤渣1的化学式为___________ 。
(4)“滤液”主要成分是含有少量重金属阳离子的Na2CrO4溶液,除杂装置如图2所示
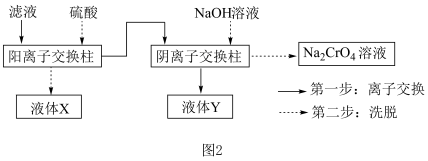
已知:图中离子交换柱原理为HR+M+ MR+H+;2ROH+CrO
MR+H+;2ROH+CrO
 R2CrO4+2OH-
R2CrO4+2OH-
则液体X的溶质主要是___________ (填化学式),液体Y是___________ (填名称)。
(5)为确定硫酸镍晶体中含有的结晶水,称取纯化后的硫酸镍晶体5.26g,加热至完全失去结晶水,固体减重2.16g,则该晶体的化学式为___________ 。

已知:①“焙烧”时Cr2O3和Al2O3分别转化为Na2CrO4、NaAlO2
②Na2CrO4溶液中存在平衡:
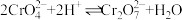
(1)“焙烧”时,Cr2O3参与反应的化学方程式为
(2)提高“酸洗”的速率的措施为
(3)“酸洗”后,滤渣1的化学式为
(4)“滤液”主要成分是含有少量重金属阳离子的Na2CrO4溶液,除杂装置如图2所示

已知:图中离子交换柱原理为HR+M+
 MR+H+;2ROH+CrO
MR+H+;2ROH+CrO
 R2CrO4+2OH-
R2CrO4+2OH-则液体X的溶质主要是
(5)为确定硫酸镍晶体中含有的结晶水,称取纯化后的硫酸镍晶体5.26g,加热至完全失去结晶水,固体减重2.16g,则该晶体的化学式为
您最近一年使用:0次
名校
解题方法
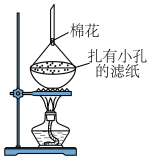
4 . 以海带为原料提取碘单质的流程如下:
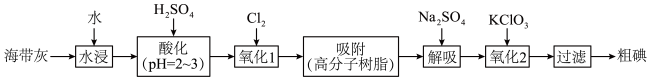
回答下列问题:
(1)为提高“水浸”速率,宜采取的措施有:
 ,不宜过量的原因是
,不宜过量的原因是(2)“过滤”操作需要的玻璃仪器有
(3)“吸附”的目的是
(4)“解吸”中氧化剂、还原剂的物质的量之比为
(5)“氧化2”中
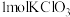 完全反应转移
完全反应转移 电子。与出该反应的离子方程式:
电子。与出该反应的离子方程式:(6)利用如图装置提纯碘。
提纯 的原理是
的原理是
您最近一年使用:0次
2024-01-24更新
|
69次组卷
|
2卷引用:吉林省白城市通榆县第一中学校2023-2024学年高三上学期第四次质量检测 化学试题
名校
解题方法
5 . 1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和 )中提取金属镁的主要步骤如下:
)中提取金属镁的主要步骤如下:
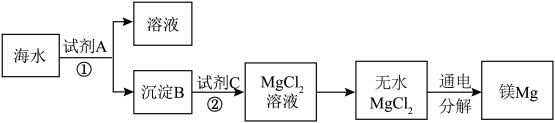
回答下列问题:
(1)Mg在周期表中的位置________ ,试剂A可以选用_______ ,试剂C可选用________ 。
(2)步骤①的离子方程式________ 。
(3)用电子式表示氯化镁的形成过程___________ 。
(4)无水 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为:
,该反应的化学方程式为:_________ 。
(5)戴维制镁的化学方程式为_________ 。
(6)配平下列反应的方程式。
①_____ 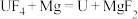
②_____ 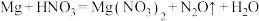
 )中提取金属镁的主要步骤如下:
)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置
(2)步骤①的离子方程式
(3)用电子式表示氯化镁的形成过程
(4)无水
 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为:
,该反应的化学方程式为:(5)戴维制镁的化学方程式为
(6)配平下列反应的方程式。
①
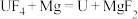
②
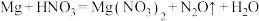
您最近一年使用:0次
名校
6 . 原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。M元素与X同主族,与W同周期。
(1)M元素是___________ (填元素符号)。
(2)Z、W形成的气态氢物的稳定性为___________ >___________ 。(填化学式)
(3)写出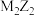 的电子式
的电子式___________ ,写出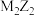 与水反应的离子方程式
与水反应的离子方程式___________ 。
(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________ 。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知① 能与足量
能与足量 浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是
浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是___________ (填化学式)。写出该气体B与氯水反应的离子方程式___________ 。
(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C, 中含有6mol结晶水。对化合物C进行下实验:
中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓 溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量 溶液产生白色沉淀,加盐酸沉淀不溶解
溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为___________ 。
②试写出C与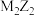 按物质的量比
按物质的量比 在溶液中反应的化学方程式
在溶液中反应的化学方程式___________ 。
(1)M元素是
(2)Z、W形成的气态氢物的稳定性为
(3)写出
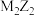 的电子式
的电子式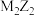 与水反应的离子方程式
与水反应的离子方程式(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①
 能与足量
能与足量 浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是
浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是(6)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物C,
 中含有6mol结晶水。对化合物C进行下实验:
中含有6mol结晶水。对化合物C进行下实验:a.取C的溶液加入过量浓
 溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.另取C的溶液,加入过量
 溶液产生白色沉淀,加盐酸沉淀不溶解
溶液产生白色沉淀,加盐酸沉淀不溶解①写出C的化学式为
②试写出C与
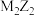 按物质的量比
按物质的量比 在溶液中反应的化学方程式
在溶液中反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 用钛白厂的副产品和氯化钾制备硫酸钾,并得到副产品颜料铁红的流程如图:
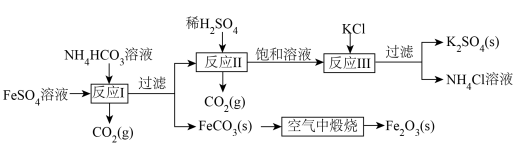
依据该流程回答下列问题:
已知:上述流程中,s表示固体,g表示气体。
(1)配制硫酸亚铁溶液时,通常加入少量的铁粉,加入铁粉的目的是______ ;“反应I”的离子方程式为______ ;如果向硫酸亚铁溶液中直接滴加氢氧化钠溶液,可观察到的现象是______ ,沉淀颜色变化的总反应的化学方程式为______ 。
(2)“空气中煅烧”制取铁红的反应的化学方程式为______ ,还原剂是______ (填化学式)。
(3)“反应Ⅲ”的离子方程式为______ ,该反应原理类似氨碱法制小苏打,利用了相同条件下物质溶解性差异的特点,其中______ (填名称)的溶解度相对其他物质比较小,可以以固体形式析出。

依据该流程回答下列问题:
已知:上述流程中,s表示固体,g表示气体。
(1)配制硫酸亚铁溶液时,通常加入少量的铁粉,加入铁粉的目的是
(2)“空气中煅烧”制取铁红的反应的化学方程式为
(3)“反应Ⅲ”的离子方程式为
您最近一年使用:0次
解题方法
8 . 高铁酸钾(K2FeO4)是一种高效多功能的绿色消毒剂,某兴趣小组欲利用废铁屑(主要成分为Fe,还含有少量 和
和 )制取高铁酸钾,其工艺流程图如下。
)制取高铁酸钾,其工艺流程图如下。
(1)“滤渣”的主要成分为___________ 。
(2)“操作1”所需的玻璃仪器包括___________ 。
(3)写出 的电子式
的电子式___________ 。
(4)加入饱和 溶液时发生反应
溶液时发生反应 ,试解释该反应能发生的原因
,试解释该反应能发生的原因___________ 。
(5) 处理水时,不仅能杀菌消毒,还能形成
处理水时,不仅能杀菌消毒,还能形成___________ (填化学式)吸附水中悬浮杂质而净化水。
(6)高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体。试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式___________ 。
(7)若生成 的反应原理可表示为:
的反应原理可表示为: ,当反应中转移电子总数为
,当反应中转移电子总数为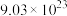 时,生成
时,生成 的物质的量为
的物质的量为___________  。
。
 和
和 )制取高铁酸钾,其工艺流程图如下。
)制取高铁酸钾,其工艺流程图如下。
(1)“滤渣”的主要成分为
(2)“操作1”所需的玻璃仪器包括
(3)写出
 的电子式
的电子式(4)加入饱和
 溶液时发生反应
溶液时发生反应 ,试解释该反应能发生的原因
,试解释该反应能发生的原因(5)
 处理水时,不仅能杀菌消毒,还能形成
处理水时,不仅能杀菌消毒,还能形成(6)高铁酸钾在碱性条件下稳定,在中性潮湿环境中会产生红褐色的物质,并释放出一种能使带火星的木条复燃的气体。试写出高铁酸钾溶解在中性溶液中与水反应的离子方程式
(7)若生成
 的反应原理可表示为:
的反应原理可表示为: ,当反应中转移电子总数为
,当反应中转移电子总数为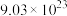 时,生成
时,生成 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
2024-01-06更新
|
108次组卷
|
2卷引用:吉林省白山市2023-2024学年高一上学期1月期末考试化学试题
名校
解题方法
9 . 草酸亚铁晶体(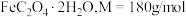 )是一种黄色难溶于水可溶于稀硫酸的固体,具有较强还原性,受热易分解,是生产电池、涂料以及感光材料的原材料。某化学活动小组分别设计了相应装置进行草酸亚铁的制备及其性质实验。回答下列问题:
)是一种黄色难溶于水可溶于稀硫酸的固体,具有较强还原性,受热易分解,是生产电池、涂料以及感光材料的原材料。某化学活动小组分别设计了相应装置进行草酸亚铁的制备及其性质实验。回答下列问题:
I.制备草酸亚铁晶体(装置如图所示):
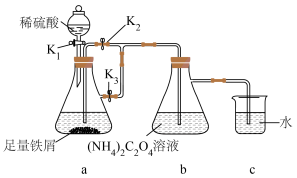
(1)从b中获得产品的操作为_______ 。
(2)装置c的作用为_______ 。
(3)实验过程:待a中反应一段时间后,需要对开关进行的操作为_______ 。
II.草酸亚铁晶体热分解产物的探究:
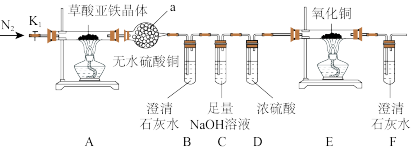
(4)盛放无水硫酸铜的装置a的装置名称为_______ ;
(5)装置C的作用为_______ ;
(6)从绿色化学考虑,该套装置存在的明显缺陷是_______ ;
(7)实验结束后,E中黑色固体变为红色,B、F中澄清石灰水变浑浊,a中无水硫酸铜变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为_______ 。
Ⅲ.运用热重分析法推测产物
称取 草酸亚铁晶体(
草酸亚铁晶体(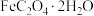 )加热分解,得到剩余固体质量随温度变化的曲线如图所示:
)加热分解,得到剩余固体质量随温度变化的曲线如图所示:
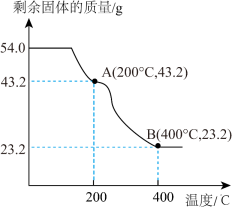
(8)已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为_______ 。
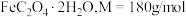 )是一种黄色难溶于水可溶于稀硫酸的固体,具有较强还原性,受热易分解,是生产电池、涂料以及感光材料的原材料。某化学活动小组分别设计了相应装置进行草酸亚铁的制备及其性质实验。回答下列问题:
)是一种黄色难溶于水可溶于稀硫酸的固体,具有较强还原性,受热易分解,是生产电池、涂料以及感光材料的原材料。某化学活动小组分别设计了相应装置进行草酸亚铁的制备及其性质实验。回答下列问题:I.制备草酸亚铁晶体(装置如图所示):

(1)从b中获得产品的操作为
(2)装置c的作用为
(3)实验过程:待a中反应一段时间后,需要对开关进行的操作为
II.草酸亚铁晶体热分解产物的探究:

(4)盛放无水硫酸铜的装置a的装置名称为
(5)装置C的作用为
(6)从绿色化学考虑,该套装置存在的明显缺陷是
(7)实验结束后,E中黑色固体变为红色,B、F中澄清石灰水变浑浊,a中无水硫酸铜变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为
Ⅲ.运用热重分析法推测产物
称取
 草酸亚铁晶体(
草酸亚铁晶体(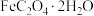 )加热分解,得到剩余固体质量随温度变化的曲线如图所示:
)加热分解,得到剩余固体质量随温度变化的曲线如图所示:
(8)已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为
您最近一年使用:0次
名校
10 . 水合肼(N2H4•H2O)是一种无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl。回答下列问题:
实验一:制备NaClO溶液(实验装置如图所示)

(1)配制100mL10mol•L﹣1的NaOH溶液时,所需玻璃仪器除量筒外还有___________ (填字母)。
A.玻璃棒 B.烧杯 C.100mL容量瓶 D.干燥管 E.胶头滴管 F.锥形瓶
(2)装置M的作用是___________ 。
实验二:制取水合肼(实验装置如图所示)

(3)①仪器A的名称为___________ ,冷凝管的水流方向为 ___________ 。(用“a、b”作答)
②反应过程中需控制反应温度,同时将A中溶液缓慢滴入三颈烧瓶中,如果滴速过快则会导致产品产率降低,写出该过程的化学方程式:___________ ,A中盛装的溶液是 ___________ (填字母)。
A.CO(NH2)2溶液 B.NaOH和NaClO溶液
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分
实验三:测定馏分中水合肼含量
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,取25.00mL该溶液置于锥形瓶中,用0.10mol•L﹣1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在___________ (填“酸式”或“碱式”)滴定管中,本实验滴定终点的现象为 ___________ 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为___________ 。
实验一:制备NaClO溶液(实验装置如图所示)

(1)配制100mL10mol•L﹣1的NaOH溶液时,所需玻璃仪器除量筒外还有
A.玻璃棒 B.烧杯 C.100mL容量瓶 D.干燥管 E.胶头滴管 F.锥形瓶
(2)装置M的作用是
实验二:制取水合肼(实验装置如图所示)

(3)①仪器A的名称为
②反应过程中需控制反应温度,同时将A中溶液缓慢滴入三颈烧瓶中,如果滴速过快则会导致产品产率降低,写出该过程的化学方程式:
A.CO(NH2)2溶液 B.NaOH和NaClO溶液
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分
实验三:测定馏分中水合肼含量
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,取25.00mL该溶液置于锥形瓶中,用0.10mol•L﹣1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4•H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为
您最近一年使用:0次



