解题方法
1 . 现有部分元素的性质与原子或分子结构的相关信息如表所示:
(1)T、X、Y、Z形成的简单离子半径由大到小的顺序是______ 。(用离子符号表示)
(2)元素Y与元素Z相比,金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 填字母序号。
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应的程度很剧烈,而Z单质在加热条件下才能与水反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式______ ,请指出元素T在周期表中的位置_______ 。
(4)元素X与氢元素以原子个数比1:2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32),元素T和氢元素以原子个数比1:1化合形成化合物Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式______ 。
| 元素编号 | 元素性质与原子(或分子)结构的相关信息 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 其离子是第三周期金属元素的离子中半径最小的 |
(2)元素Y与元素Z相比,金属性较强的是
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应的程度很剧烈,而Z单质在加热条件下才能与水反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式
(4)元素X与氢元素以原子个数比1:2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32),元素T和氢元素以原子个数比1:1化合形成化合物Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式
您最近一年使用:0次
解题方法
2 . “声名大振”学习小组围绕新型绿色消毒剂——高铁酸钠( )展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为
)展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为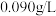 。
。

请回答:
(1)化合物D中的化学键类型是______ 。
(2) 的电子式是
的电子式是______ 。
(3)反应②的离子方程式是______ 。
(4)反应③,F在A中燃烧的反应现象是______ 。
(5)反应⑤的化学方程式是______ 。
(6)请在方框内填入相应物质的化学式,完成反应④的化学方程式,并标明电子转移的方向和数目:______ 。
2 +3
+3 +
+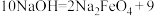
 +5
+5
 )展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为
)展开探究。如图所示物质转化关系为高铁酸钠的一种制备方法及有关性质实验(部分反应产物已略去)。已知A为气态非金属单质,B为金属单质,E为生活中常见的调味品,F在标准状况下密度为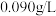 。
。
请回答:
(1)化合物D中的化学键类型是
(2)
 的电子式是
的电子式是(3)反应②的离子方程式是
(4)反应③,F在A中燃烧的反应现象是
(5)反应⑤的化学方程式是
(6)请在方框内填入相应物质的化学式,完成反应④的化学方程式,并标明电子转移的方向和数目:
2
 +3
+3 +
+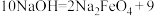
 +5
+5
您最近一年使用:0次
解题方法
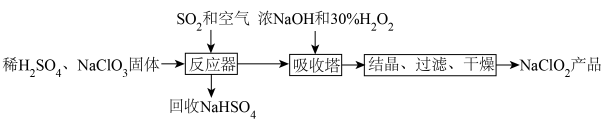
3 . ClO2是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成NaClO2晶体以便储运。亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:
②H2O受热易分解。
(1)向“反应器”中鼓入空气的作用是______ 。
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是_____ (填“氧化剂”或“还原剂”),当有1molH2O2参与该反应时,反应转移的电子数为______ 。
(3)“吸收塔”中需要控制温度不超过20℃,其原因是______ 。
(4)写出“反应器”步骤中生成ClO2的离子方程式______ 。
②H2O受热易分解。
(1)向“反应器”中鼓入空气的作用是
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是
(3)“吸收塔”中需要控制温度不超过20℃,其原因是
(4)写出“反应器”步骤中生成ClO2的离子方程式
您最近一年使用:0次
解题方法
4 . 为探究某矿物X(含三种常见元素)的组成和性质,某兴趣小组设计了如下实验:已知实验中所用试剂均足量,固体B是一种单质和化合物的混合物,请回答如下问题:
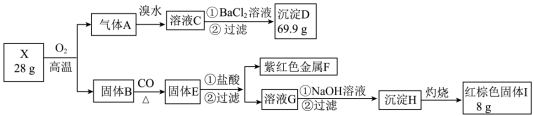
(1)X中所含元素为:___________ 。
(2)溴水是否可以用酸化的双氧水代替,若不可行,请说明理由,若可行,请写出反应的离子方程式:___________ 。
(3)检验溶液G中的金属阳离子的实验方案:___________ 。
(4)溶液G转化为沉淀H的现象___________ 。
(5)X在高温下与氧气充分反应的化学方程式:___________ 。

(1)X中所含元素为:
(2)溴水是否可以用酸化的双氧水代替,若不可行,请说明理由,若可行,请写出反应的离子方程式:
(3)检验溶液G中的金属阳离子的实验方案:
(4)溶液G转化为沉淀H的现象
(5)X在高温下与氧气充分反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 纳米铁可用于制作高密度磁性材料。以铁屑(含少量 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下: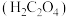 是一种二元酸
是一种二元酸
(1)“酸溶”过程中可以加快反应速率和提高浸出率的方法有_______ 。(写出两种)。
(2)写出“酸溶”时氧化还原反应的离子方程式:_______ 、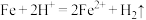 。
。
(3)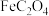 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 混合气体,若产物中
混合气体,若产物中 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为_______ 。
(4)取少量产品分散于水中,_______ (填操作步骤),可验证所得铁粉直径是否为纳米级
(5)纳米铁粉可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。 的去除,原因是
的去除,原因是_______ 。
②该过程中体现了纳米铁粉的_______ 性(填“氧化”或“还原”)。
 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
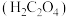 是一种二元酸
是一种二元酸(1)“酸溶”过程中可以加快反应速率和提高浸出率的方法有
(2)写出“酸溶”时氧化还原反应的离子方程式:
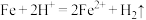 。
。(3)
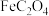 固体经灼烧后得到红棕色固体和
固体经灼烧后得到红棕色固体和 混合气体,若产物中
混合气体,若产物中 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为(4)取少量产品分散于水中,
(5)纳米铁粉可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。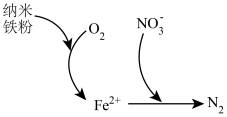
 的去除,原因是
的去除,原因是②该过程中体现了纳米铁粉的
您最近一年使用:0次
名校
解题方法
6 . 工业上以NH3为原料按如下流程制取化合物A。 反应生成Cl-
反应生成Cl-
请回答:
(1)写出NH3催化氧化生成NO的化学方程式________ 。
(2)等物质的量的HNO3与ClF反应除生成A外,另一种产物为HF。
①电子衍射研究表明,气态HF中存在环状六聚体(HF)6,而其他卤素的气态氢化物却不存在,气态HF中存在环状六聚体(HF)6的原因是_____ 。
②下列说法正确的是_____ 。
A.尾气的主要成分是NO,可用NaOH溶液直接吸收 B.ClF中的Cl呈零价
C.化合物A具有强氧化性 D.TiCl4与A反应能生成Ti(NO3)4
(3)①设计实验验证化合物A中含有Cl元素___________ 。
②写出实验过程中涉及的反应方程式___________ 。

 反应生成Cl-
反应生成Cl-请回答:
(1)写出NH3催化氧化生成NO的化学方程式
(2)等物质的量的HNO3与ClF反应除生成A外,另一种产物为HF。
①电子衍射研究表明,气态HF中存在环状六聚体(HF)6,而其他卤素的气态氢化物却不存在,气态HF中存在环状六聚体(HF)6的原因是
②下列说法正确的是
A.尾气的主要成分是NO,可用NaOH溶液直接吸收 B.ClF中的Cl呈零价
C.化合物A具有强氧化性 D.TiCl4与A反应能生成Ti(NO3)4
(3)①设计实验验证化合物A中含有Cl元素
②写出实验过程中涉及的反应方程式
您最近一年使用:0次
名校
解题方法
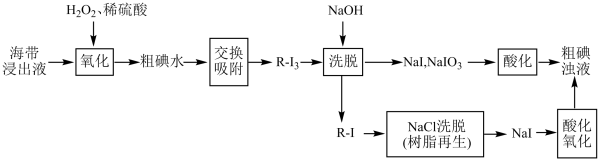
7 . 下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。 可被其它更易被吸附的阴离子替代)对
可被其它更易被吸附的阴离子替代)对 有很强的交换吸附能力;②步骤“交换吸附”发生的反应:
有很强的交换吸附能力;②步骤“交换吸附”发生的反应: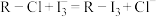 。
。
请回答:
(1)写出海带浸出液被氧化生成粗碘水过程中的反应方程式:__________ 。
(2)下列说法正确的是__________。
(3)“氧化”过程不能加入过量 ,原因是
,原因是__________ 。
(4)流程中的中间产物 可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。
可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。
a.蓝色出现,并伴有大量气泡:__________ ;
b.蓝色消失:
(5)设计实验方案验证氧化过程得到粗碘水中碘元素除 外可能的存在形式。(不考虑其它杂质阴离子)
外可能的存在形式。(不考虑其它杂质阴离子)__________ 。
 可被其它更易被吸附的阴离子替代)对
可被其它更易被吸附的阴离子替代)对 有很强的交换吸附能力;②步骤“交换吸附”发生的反应:
有很强的交换吸附能力;②步骤“交换吸附”发生的反应: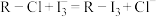 。
。请回答:
(1)写出海带浸出液被氧化生成粗碘水过程中的反应方程式:
(2)下列说法正确的是__________。
A.已知 的VSEPR模型为 的VSEPR模型为 ,推测 ,推测 为sp杂化 为sp杂化 |
B.可用KI溶液提取 中的碘单质 中的碘单质 |
C.该制备流程中“洗脱”、“酸化”、“ 洗脱”均涉及到氧化还原反应 洗脱”均涉及到氧化还原反应 |
D.“酸化氧化”过程若选择 为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则 为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则 与 与 的物质的量比应不少于 的物质的量比应不少于 |
(3)“氧化”过程不能加入过量
 ,原因是
,原因是(4)流程中的中间产物
 可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。
可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。a.蓝色出现,并伴有大量气泡:
b.蓝色消失:

(5)设计实验方案验证氧化过程得到粗碘水中碘元素除
 外可能的存在形式。(不考虑其它杂质阴离子)
外可能的存在形式。(不考虑其它杂质阴离子)
您最近一年使用:0次
解题方法
8 .  是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成
是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成 晶体以便储运。亚氯酸钠(
晶体以便储运。亚氯酸钠( )是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成
)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成 。亚氯酸钠晶体的一种生产工艺如下:
。亚氯酸钠晶体的一种生产工艺如下:

已知:① 浓度过高时易发生分解爆炸,一般需稀释至含量10%以下。
浓度过高时易发生分解爆炸,一般需稀释至含量10%以下。
② 受热易分解
受热易分解
(1)向“反应器”中鼓入空气的作用是___________ 。
(2)“吸收塔”的作用是将产生的 转化为
转化为 ,在此过程中加入的
,在此过程中加入的 是作用
是作用_______ (填“氧化剂”或“还原剂”),当有 参与该反应时,反应转移的电子数为
参与该反应时,反应转移的电子数为_________ 。
(3)“吸收塔”中需要控制温度不超过20℃,其原因是___________ 。
(4) 在温度高于60℃时易分解生成
在温度高于60℃时易分解生成 和NaCl,写出该化学方程式
和NaCl,写出该化学方程式________ 。
(5)写出“反应器”步骤中生成 的离子方程式
的离子方程式___________ 。
(6)为测定所得 (摩尔质量
(摩尔质量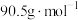 )产品的质量分数,进行如下实验:
)产品的质量分数,进行如下实验:
步骤I:准确称取所得亚氯酸钠样品1.000g于烧杯中,用适量蒸馏水和略过量的KI晶体,再滴加适量的稀硫酸,充分反应。(反应方程式为: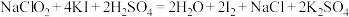 )
)
步骤Ⅱ:将所得溶液转移至250mL容量瓶中,稀释定容得溶液A;准确移取25.00mL溶液A于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液作指示剂,用 的
的 标准溶液与之反应,至恰好完全反应时消耗
标准溶液与之反应,至恰好完全反应时消耗 溶液22.00mL。(反应方程式为:
溶液22.00mL。(反应方程式为: )
)
计算该产品中 的质量分数
的质量分数_______ (保留小数点后两位)。
 是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成
是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成 晶体以便储运。亚氯酸钠(
晶体以便储运。亚氯酸钠( )是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成
)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成 。亚氯酸钠晶体的一种生产工艺如下:
。亚氯酸钠晶体的一种生产工艺如下:
已知:①
 浓度过高时易发生分解爆炸,一般需稀释至含量10%以下。
浓度过高时易发生分解爆炸,一般需稀释至含量10%以下。②
 受热易分解
受热易分解(1)向“反应器”中鼓入空气的作用是
(2)“吸收塔”的作用是将产生的
 转化为
转化为 ,在此过程中加入的
,在此过程中加入的 是作用
是作用 参与该反应时,反应转移的电子数为
参与该反应时,反应转移的电子数为(3)“吸收塔”中需要控制温度不超过20℃,其原因是
(4)
 在温度高于60℃时易分解生成
在温度高于60℃时易分解生成 和NaCl,写出该化学方程式
和NaCl,写出该化学方程式(5)写出“反应器”步骤中生成
 的离子方程式
的离子方程式(6)为测定所得
 (摩尔质量
(摩尔质量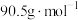 )产品的质量分数,进行如下实验:
)产品的质量分数,进行如下实验:步骤I:准确称取所得亚氯酸钠样品1.000g于烧杯中,用适量蒸馏水和略过量的KI晶体,再滴加适量的稀硫酸,充分反应。(反应方程式为:
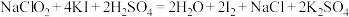 )
)步骤Ⅱ:将所得溶液转移至250mL容量瓶中,稀释定容得溶液A;准确移取25.00mL溶液A于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液作指示剂,用
 的
的 标准溶液与之反应,至恰好完全反应时消耗
标准溶液与之反应,至恰好完全反应时消耗 溶液22.00mL。(反应方程式为:
溶液22.00mL。(反应方程式为: )
)计算该产品中
 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.为比较 和
和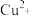 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察___________ 的快慢,定性比较得出结论;
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是___________ 。
(3)查阅资料得知:将作为催化剂的 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从催化剂的角度 分析,这两个氧化还原反应的离子方程式分别是: 和
和___________ 。
Ⅱ.某化学实验小组利用酸性 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
(4)实验中反应的离子方程式为___________ 。
(5)
___________ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是___________ 。
(6)2号实验中,用 表示的反应速率为
表示的反应速率为___________ (反应后溶液的总体积变化忽略不计)。
 和
和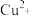 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
(2)定量分析。如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。
实验中需要测量的数据是
(3)查阅资料得知:将作为催化剂的
 溶液加入
溶液加入 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中 均参加了反应,试从
均参加了反应,试从 和
和Ⅱ.某化学实验小组利用酸性
 溶液与
溶液与 溶液反应研究影响反应速率的因素。实验过程中通过测定
溶液反应研究影响反应速率的因素。实验过程中通过测定 溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:
溶液褪色所需的时间来比较化学反应速率的大小。实验数据如下:| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | x |
  溶液/mL 溶液/mL | 5 | 10 | 10 | 5 |
  溶液/mL 溶液/mL | 5 | 5 | 10 | 10 |
| 时间/s | 20 | 10 | 5 | ― |
(5)

(6)2号实验中,用
 表示的反应速率为
表示的反应速率为
您最近一年使用:0次
名校
10 . 高铁酸钾(K2FeO4)是一种新型高效无毒的多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
I.制备K2FeO4

(1)写出A中发生反应的化学方程式:___________ 。
(2)除杂装置B中的试剂为___________ 。
(3)请写出装置C中制备K2FeO4的离子方程式___________ 。
II.探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明K2FeO4能氧化Cl-而产生Cl2设计以下方案:
(4)方案1中溶液变红可知溶液a中含有Fe3+,该离子的产生___________ (填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的,理由是___________ 。
(5)方案2可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是排除ClO-的干扰。根据K2FeO4的制备实验得出:氧化性Cl2___________ FeO (填“>”或“<”),而方案2实验表明,Cl2和FeO
(填“>”或“<”),而方案2实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(6)资料表明,酸性溶液中的氧化性FeO >MnO
>MnO ,验证实验如下:
,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象___________ (填“能”或“不能”)证明氧化性FeO >MnO
>MnO 。请说明理由:
。请说明理由:___________ 。
I.制备K2FeO4

(1)写出A中发生反应的化学方程式:
(2)除杂装置B中的试剂为
(3)请写出装置C中制备K2FeO4的离子方程式
II.探究K2FeO4的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明K2FeO4能氧化Cl-而产生Cl2设计以下方案:
| 方案1 | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案2 | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量溶液b,滴加盐酸,有Cl2产生 |
(4)方案1中溶液变红可知溶液a中含有Fe3+,该离子的产生
(5)方案2可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是排除ClO-的干扰。根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案2实验表明,Cl2和FeO
(填“>”或“<”),而方案2实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(6)资料表明,酸性溶液中的氧化性FeO
 >MnO
>MnO ,验证实验如下:
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象
 >MnO
>MnO 。请说明理由:
。请说明理由:
您最近一年使用:0次



