名校
解题方法
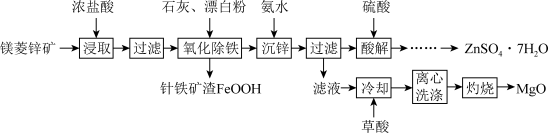
1 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ 。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”时,加入氨水调节pH的范围是_______ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 制得的ZnSO4•7H2O在烘干时需减压烘干的原因是_______ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:_______ 。
| 阳离子 | Fe3+ | Fe2+ | Zn2+ | Mg2+ | Ca2+ |
| 开始沉淀 | 2.7 | 7.6 | 6.2 | 9.4 | 13 |
| 完全沉淀 | 3.7 | 9.6 | 8.2 | 12.4 | _______ |
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”时,加入氨水调节pH的范围是
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次
名校
解题方法
2 . 以银锰精矿(主要含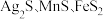 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: 的氧化性强于
的氧化性强于 ;
;
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①“浸锰"过程中,发生反应: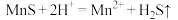 ,则可推断:
,则可推断: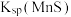
____ (填“ ”或“
”或“ ”)
”)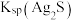 。
。
②在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量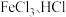 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以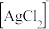 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______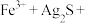 _______
_______ _______
_______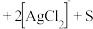 。
。
②结合平衡移动原理,解释浸出剂中 的作用:
的作用:_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有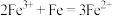 和
和_______ 。
(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图_____ ;基态铁原子核外共有_____ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是_______ 。
③碳与其他元素一起能形成多种酸或酸根。 的空间构型是
的空间构型是_______ 。
④类卤素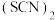 分子中
分子中 键与
键与 键的数目比
键的数目比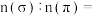
_______ 。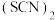 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸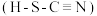 的沸点低于异硫氰酸
的沸点低于异硫氰酸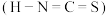 的沸点,其原因是
的沸点,其原因是_______ 。
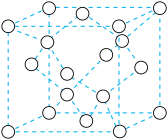
⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体: 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
_______ pm(写出表达式即可)。
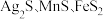 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: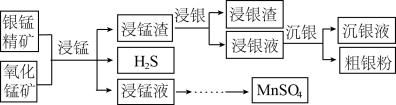
 的氧化性强于
的氧化性强于 ;
;(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①“浸锰"过程中,发生反应:
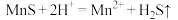 ,则可推断:
,则可推断: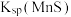
 ”或“
”或“ ”)
”)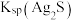 。
。②在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
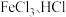 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以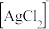 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______
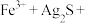 _______
_______ _______
_______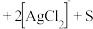 。
。②结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有
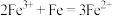 和
和(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是③碳与其他元素一起能形成多种酸或酸根。
 的空间构型是
的空间构型是④类卤素
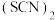 分子中
分子中 键与
键与 键的数目比
键的数目比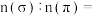
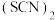 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸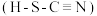 的沸点低于异硫氰酸
的沸点低于异硫氰酸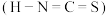 的沸点,其原因是
的沸点,其原因是⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体:
 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
您最近一年使用:0次
解题方法
3 .  是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为
是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为 、Fe2O3、
、Fe2O3、 、
、 )和FeO制备
)和FeO制备 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 等金属阳离子。回答下列问题:
等金属阳离子。回答下列问题:
(1)酸浸。 与FeO反应的离子方程式:
与FeO反应的离子方程式:___________ 。
(2)滤渣1中主要含有___________ (填化学式)。
(3)保持温度、浸取时间不变,能提高锰元素浸出率的措施有___________ 。
(4)除杂。已知:室温下,Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol/L),需调节溶液pH范围为____ 。
(5)焙烧。在热解步骤获得 ,写出焙烧生成
,写出焙烧生成 的反应为
的反应为___________ 。
(6)碘与锰(II)形成的某种化合物晶胞结构及参数如图所示。___________ 。
②其晶体密度的计算表达式为___________ g·cm-3(阿伏加德罗常数的值用NA表示)。
 是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为
是一种锂离子电池的正极材料。用高锰酸钾废渣(主要成分为 、Fe2O3、
、Fe2O3、 、
、 )和FeO制备
)和FeO制备 的工艺流程如下:
的工艺流程如下:
 、
、 、
、 、
、 等金属阳离子。回答下列问题:
等金属阳离子。回答下列问题:(1)酸浸。
 与FeO反应的离子方程式:
与FeO反应的离子方程式:(2)滤渣1中主要含有
(3)保持温度、浸取时间不变,能提高锰元素浸出率的措施有
(4)除杂。已知:室温下,Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol/L),需调节溶液pH范围为
(5)焙烧。在热解步骤获得
 ,写出焙烧生成
,写出焙烧生成 的反应为
的反应为(6)碘与锰(II)形成的某种化合物晶胞结构及参数如图所示。

②其晶体密度的计算表达式为
您最近一年使用:0次
解题方法
4 . 二氯化二硫 用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是
用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是 的制备过程,请回答下列问题:
的制备过程,请回答下列问题:
已知:i. ,
, 。
。
ii.常温下, 是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
iii.相关物质的熔沸点:
I. 的制备
的制备
如图所示:___________ ;A中反应的离子方程式为___________ ;装置B的试剂是___________ 。
(2)实验操作的先后顺序:
i.组装仪器并检验装置的气密性,加入药品。
ii.打开 ,通入氮气,通冷凝水,关闭
,通入氮气,通冷凝水,关闭___________ 。
iii.加热 中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至
中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至 。
。
iv.一段时间后停止滴加浓盐酸、关闭___________ ,打开K3,最后在D中收集到浅黄色液体。
(3)装置G的作用为___________ 。
(4)D装置中水浴温度应控制为___________ 。
II.侧定 产品的纯度。(杂质不参与反应)
产品的纯度。(杂质不参与反应)
(5)①向 样品中加入适量蒸馏水,加热蒸出全部气体,用足量的
样品中加入适量蒸馏水,加热蒸出全部气体,用足量的 溶液充分吸收、再用
溶液充分吸收、再用 盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液
盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液 在指示剂变色范围内)滴定剩余的
在指示剂变色范围内)滴定剩余的 ,达到滴定终点时消耗盐酸溶液
,达到滴定终点时消耗盐酸溶液 。
。
②做对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗盐酸溶液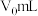 。样品纯度为
。样品纯度为___________ 。
 用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是
用于橡胶的低温硫化剂和数接剂:冶金工业用作金、银等贵稀金属的萃取剂。以下是 的制备过程,请回答下列问题:
的制备过程,请回答下列问题:已知:i.
 ,
, 。
。ii.常温下,
 是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。
是一种易挥发浅黄色的油状液体,在空气中可剧烈水解,产生白雾并伴有刺激性气味;2S2Cl2+2H2O=SO2↑+3S↓+4HCl。iii.相关物质的熔沸点:
| 物质 | S |  |  |
| 熔点/℃ | 112.8 | -77 | -121 |
| 沸点/℃ | 444.6 | 137 | 59 |
 的制备
的制备如图所示:

(2)实验操作的先后顺序:
i.组装仪器并检验装置的气密性,加入药品。
ii.打开
 ,通入氮气,通冷凝水,关闭
,通入氮气,通冷凝水,关闭iii.加热
 中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至
中三颈烧瓶使硫黄熔化,滴加浓盐酸,继续加热装置C至 。
。iv.一段时间后停止滴加浓盐酸、关闭
(3)装置G的作用为
(4)D装置中水浴温度应控制为
II.侧定
 产品的纯度。(杂质不参与反应)
产品的纯度。(杂质不参与反应)(5)①向
 样品中加入适量蒸馏水,加热蒸出全部气体,用足量的
样品中加入适量蒸馏水,加热蒸出全部气体,用足量的 溶液充分吸收、再用
溶液充分吸收、再用 盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液
盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液 在指示剂变色范围内)滴定剩余的
在指示剂变色范围内)滴定剩余的 ,达到滴定终点时消耗盐酸溶液
,达到滴定终点时消耗盐酸溶液 。
。②做对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗盐酸溶液
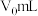 。样品纯度为
。样品纯度为
您最近一年使用:0次
5 . 工业上以碳酸锰矿(主要含MnCO3,还含有SiO2、Al2O3、FeCO3等杂质)为原料制备MnO2的工艺流程如下图所示。
已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
回答下列问题:
(1)“酸浸”前将碳酸锰矿粉碎的目的是___________ 。
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为___________ 。
(3)滤渣2的主要成分为Al(OH)3和___________ ,应“调pH”时应控制pH范围为___________ 。
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是___________ 。要使Mn2+沉淀完全(通常认为溶液中离子浓度小于1.0×10-5mol/L为沉淀完全),溶液中CO 的浓度应大于
的浓度应大于___________ 。[25℃时,Ksp(MnCO3)=2.0×10-11]。
(5)“氧化焙烧”的化学方程式为___________ 。
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是___________ 。(忽略流程中锰元素的损失)。

已知:常温下,溶液中金属离子开始沉淀和完全沉淀时的pH如表所示。
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.3 |
完全沉淀pH | 3.7 | 9.7 | 5.2 | 9.8 |
(1)“酸浸”前将碳酸锰矿粉碎的目的是
(2)“氧化”时MnO2将Fe2+氧化成Fe3+的离子方程式为
(3)滤渣2的主要成分为Al(OH)3和
(4)“沉锰”得到MnCO3,该过程需控制在较低温度下的原因是
 的浓度应大于
的浓度应大于(5)“氧化焙烧”的化学方程式为
(6)若以125kg该碳酸锰矿为原料制备MnO2,得到产品质量为87kg,则该碳酸锰矿的纯度是
您最近一年使用:0次
解题方法
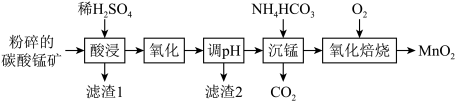
6 . 钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2•6H2O粗品的工艺流程图如下:
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的 如下表:
如下表:
请回答下列问题:
(1)上述工艺流程图中操作a的名称为___________ 。
(2)Co的价电子排布式________________ 。
(3)写出“浸出”时Co2O3发生反应的离子方程式:___________ 。
(4)加入 的作用是
的作用是___________ 。
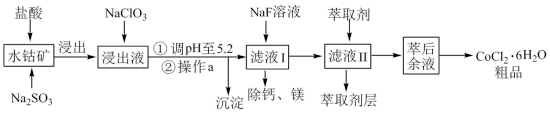
(5)萃取剂对金属离子的萃取率与 关系如图。使用萃取剂最适宜的
关系如图。使用萃取剂最适宜的
______ (填字母)。

已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的
 如下表:
如下表:| 沉淀物 |  |  |  |  |  |
开始沉淀时的 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀时的 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)上述工艺流程图中操作a的名称为
(2)Co的价电子排布式
(3)写出“浸出”时Co2O3发生反应的离子方程式:
(4)加入
 的作用是
的作用是(5)萃取剂对金属离子的萃取率与
 关系如图。使用萃取剂最适宜的
关系如图。使用萃取剂最适宜的
A.接近2.0 B.接近3.0 C.接近5.0
您最近一年使用:0次
7 . 三氯氧钒(VOCl3,M=173.5g/mol)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。已知三氯氧钒为黄色液体,密度为1.84g/cm3,熔点为-77℃,沸点为126℃,遇水会迅速水解生成HCl和一种氧化物。某小组同学利用如图装置以氯气、V2O5和碳粉为原料制备三氯氧钒。

回答下列问题:
(1)仪器X的名称为___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)管式炉中发生反应生成CO的化学方程式为___________ 。
(4)装置D的作用为___________ 。
(5)实验过程中正确的加热顺序为___________ (填序号)。
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(6)若管式炉中加入 和
和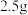 的碳粉,通入足量氯气充分反应后,在装置B的烧瓶中最终收集到
的碳粉,通入足量氯气充分反应后,在装置B的烧瓶中最终收集到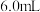 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为___________ (保留3位有效数字)。

回答下列问题:
(1)仪器X的名称为
(2)装置A中发生反应的离子方程式为
(3)管式炉中发生反应生成CO的化学方程式为
(4)装置D的作用为
(5)实验过程中正确的加热顺序为
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(6)若管式炉中加入
 和
和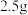 的碳粉,通入足量氯气充分反应后,在装置B的烧瓶中最终收集到
的碳粉,通入足量氯气充分反应后,在装置B的烧瓶中最终收集到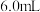 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
您最近一年使用:0次
解题方法
8 . 金属钼具有高强度、高熔点、耐磨抗腐性等优点,用于制火箭、卫星的合金构件。钼酸钠晶体(Na2MoO4·2H2O)是一种重要的金属缓蚀剂。利用钼矿(主要成分MoS2,还含少量钙、镁等元素)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
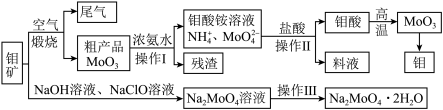
(1)Na2MoO4·2H2O中钼元素的价态为___________ ,煅烧产生的尾气引起的环境危害主要是:___________ 。
(2)用浓氨水溶解粗产品的离子方程式是___________ ,由图中信息可以判断MoO3是___________ 氧化物(填“酸性”“碱性”或“两性”)。
(3)操作Ⅰ是___________ ,操作Ⅱ所得的钼酸要水洗,检验钼酸是否洗涤干净的方法是___________ 。
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出。
①请配平以下化学反应:_________
NaClO+___________MoS2+___________NaOH=__________Na2MoO4+___________Na2SO4+___________NaCl+___________H2O。
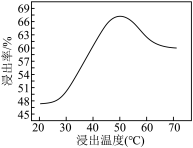
②钼的浸出率随着温度变化如图,浸出反应属于___________ 反应(放热或吸热)。

(1)Na2MoO4·2H2O中钼元素的价态为
(2)用浓氨水溶解粗产品的离子方程式是
(3)操作Ⅰ是
(4)采用NaClO氧化钼矿的方法将矿石中的钼浸出。
①请配平以下化学反应:
NaClO+___________MoS2+___________NaOH=__________Na2MoO4+___________Na2SO4+___________NaCl+___________H2O。
②钼的浸出率随着温度变化如图,浸出反应属于

您最近一年使用:0次
解题方法
9 . 铁的化合物有广泛用途,如三草酸合铁(Ⅲ)酸钾晶体 是一种光敏材料,也可作催化剂;碳酸亚铁(
是一种光敏材料,也可作催化剂;碳酸亚铁( )可作补血剂等。以废铁屑(含
)可作补血剂等。以废铁屑(含 及少量
及少量 和
和 )为原料制备以上物质的流程如下:
)为原料制备以上物质的流程如下:

已知:①25℃, ,
, ,
, 。
。
②金属离子浓度 时,可认为该金属离子已沉淀完全。
时,可认为该金属离子已沉淀完全。
③ 为可溶于水、难溶于乙醇的翠绿色晶体。
为可溶于水、难溶于乙醇的翠绿色晶体。
回答下列问题:
(1)滤液Ⅰ中含有 、
、 ,检验
,检验 所用的试剂为
所用的试剂为___________ 溶液(填化学式)。
(2)室温下,若滤液Ⅰ中 为2.0
为2.0 ,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中
,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中 至少应大于
至少应大于___________  。
。
(3)将滤液Ⅱ与饱和 溶液混合,发生反应的离子方程式为
溶液混合,发生反应的离子方程式为___________ 。已知饱和 溶液的
溶液的 大于11,是否能用饱和
大于11,是否能用饱和 溶液代替饱和
溶液代替饱和 溶液来制备
溶液来制备 ?
?___________ (填“是”或“否”)。
(4)滤液Ⅰ与足量空气发生反应的离子方程式为___________ 。甲同学认为该步反应用稀 溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是
溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是___________ 。
(5)用乙醇洗涤翠绿色晶体而不用水洗涤的目的为___________ 。
 是一种光敏材料,也可作催化剂;碳酸亚铁(
是一种光敏材料,也可作催化剂;碳酸亚铁( )可作补血剂等。以废铁屑(含
)可作补血剂等。以废铁屑(含 及少量
及少量 和
和 )为原料制备以上物质的流程如下:
)为原料制备以上物质的流程如下:
已知:①25℃,
 ,
, ,
, 。
。②金属离子浓度
 时,可认为该金属离子已沉淀完全。
时,可认为该金属离子已沉淀完全。③
 为可溶于水、难溶于乙醇的翠绿色晶体。
为可溶于水、难溶于乙醇的翠绿色晶体。回答下列问题:
(1)滤液Ⅰ中含有
 、
、 ,检验
,检验 所用的试剂为
所用的试剂为(2)室温下,若滤液Ⅰ中
 为2.0
为2.0 ,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中
,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中 至少应大于
至少应大于 。
。(3)将滤液Ⅱ与饱和
 溶液混合,发生反应的离子方程式为
溶液混合,发生反应的离子方程式为 溶液的
溶液的 大于11,是否能用饱和
大于11,是否能用饱和 溶液代替饱和
溶液代替饱和 溶液来制备
溶液来制备 ?
?(4)滤液Ⅰ与足量空气发生反应的离子方程式为
 溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是
溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是(5)用乙醇洗涤翠绿色晶体而不用水洗涤的目的为
您最近一年使用:0次
名校
解题方法
10 . 用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
表中a、b的值分别为:a=___________ 、b=___________
(2)该反应的离子方程式为___________ 。
(3)若t1<t2,则根据实验①和②得到的结论是___________ 。
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=___________ ,其反应速率变化如图,其中x1~x2时间内速率变快的主要原因可能是:产物Mn2+是反应的催化剂、___________ 。

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶的体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
(3)若t1<t2,则根据实验①和②得到的结论是
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
您最近一年使用:0次



