解题方法
1 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备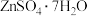 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取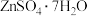 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: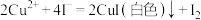 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
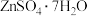 和
和 的部分实验步骤如下:
的部分实验步骤如下: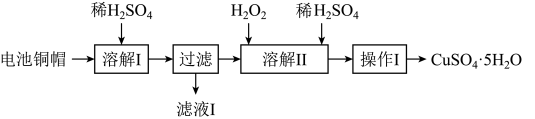
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取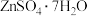 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
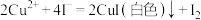 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
2 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图装置制备 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为___________ 。
a.浓硫酸 b.足量 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液
请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):___________ 。
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为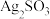 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
相关反应为:① ,
,
② 。
。
流程如下: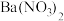 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法___________ 。
(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是___________ ,可进一步证实B中含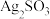 。
。
实验三:探究 的产生途径。
的产生途径。
猜想1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
猜想2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:___________ 。
(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率___________ (填“快”或“慢”)。
(6)实验探究可知, 在
在___________ (选填“酸性”“中性”“碱性”)溶液中更易被氧化为 。
。
 与
与 溶液的反应。
溶液的反应。实验一:用如图装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的
 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为a.浓硫酸 b.足量
 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为
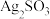 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。相关反应为:①
 ,
,②
 。
。流程如下:

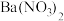 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为
 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是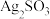 。
。实验三:探究
 的产生途径。
的产生途径。猜想1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。猜想2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加
 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有
 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率(6)实验探究可知,
 在
在 。
。
您最近一年使用:0次
2024-05-05更新
|
344次组卷
|
2卷引用:辽宁省实验中学2022-2023学年高一下学期期中测试化学试题
解题方法
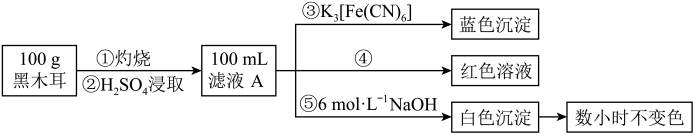
3 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。日常生活中可通过食物摄入铁元素,例如黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取 黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】
研究黑木耳中铁的含量:称取 黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质___________ (填“难”或“易”)溶于水。
(2)取少量滤液于试管中,滴入 溶液,溶液变红。则滤液中铁元素的存在形式有
溶液,溶液变红。则滤液中铁元素的存在形式有 、
、___________ (填离子符号)。
(3)滤液与Fe生成A的离子方程式为___________ 。
(4)由A转化为B可加入的试剂X可以是___________ (填标号)。
a.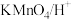 b.
b. c.
c.
(5)由C转化成D的现象:白色沉淀迅速变为灰绿色,最终变为___________ 。C转化成D的化学方程式为___________ 。
(6)将 黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到
黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到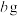 红棕色固体。若流程中加入的铁反应掉
红棕色固体。若流程中加入的铁反应掉 ,则该黑木耳中铁元素的质量分数为
,则该黑木耳中铁元素的质量分数为___________ (用含a、b、c的代数式表示)。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取
 黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。【研究与实践活动二】
研究黑木耳中铁的含量:称取
 黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。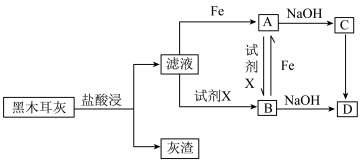
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质
(2)取少量滤液于试管中,滴入
 溶液,溶液变红。则滤液中铁元素的存在形式有
溶液,溶液变红。则滤液中铁元素的存在形式有 、
、(3)滤液与Fe生成A的离子方程式为
(4)由A转化为B可加入的试剂X可以是
a.
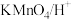 b.
b. c.
c.
(5)由C转化成D的现象:白色沉淀迅速变为灰绿色,最终变为
(6)将
 黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到
黑木耳中的铁元素经流程A→C→D进行完全转化,将D经过一系列处理,得到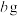 红棕色固体。若流程中加入的铁反应掉
红棕色固体。若流程中加入的铁反应掉 ,则该黑木耳中铁元素的质量分数为
,则该黑木耳中铁元素的质量分数为
您最近一年使用:0次
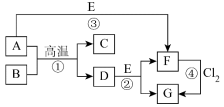
4 . (Ⅰ)已知A为常见的金属单质。B俗称磁性氯化铁。根据如图所示的关系:
B:_______ D:_______ 。
(2)写出③的离子方程式:_______ 。
(3)写出④的化学方程式:_______ 。
(4)写出⑤的化学方程式:_______ 。
(5)写出E→F的现象_______ 。
写出E→F的化学方程式_______ 。
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。
ⅲ. 与铁氰化钾(
与铁氰化钾(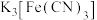 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。
为确定黑木耳中含有铁元素,甲同学设计实验方案如图。_______ 。
(7)步骤④检验 所用试剂是
所用试剂是_______ 溶液。
(8)下列有关上述实验得出的结论正确的是_______ (填字母符号)。
a.黑木耳中一定含 和
和
b.滤液A中一定含 和
和
c.白色沉淀中一定含
为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(10)步骤⑦中观察到的实验现象是_______ ,反应的离子方程式是_______ 。

B:
(2)写出③的离子方程式:
(3)写出④的化学方程式:
(4)写出⑤的化学方程式:
(5)写出E→F的现象
写出E→F的化学方程式
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的
 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。ⅲ.
 与铁氰化钾(
与铁氰化钾(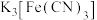 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。为确定黑木耳中含有铁元素,甲同学设计实验方案如图。
(7)步骤④检验
 所用试剂是
所用试剂是(8)下列有关上述实验得出的结论正确的是
a.黑木耳中一定含
 和
和
b.滤液A中一定含
 和
和
c.白色沉淀中一定含

为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
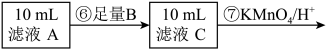
| A.Na | B.Zn | C.Fe | D.Cu |
(10)步骤⑦中观察到的实验现象是
您最近一年使用:0次
解题方法
5 . 部分元素的单质及其化合物(或其溶液)的转化关系如图。已知A是生活中使用广泛的金属单质,常温下B是无色无味的液体,E是胃酸的主要成分。
(1)写出下列物质的化学式:E___________ ;G___________ 。
(2)反应①的化学方程式为___________ ;反应②的离子方程式为___________ 。
(3)F溶液常温下呈浅绿色,该溶液中金属阳离子为___________ (填离子符号),反应④中氧化剂和还原剂的物质的量之比为___________ 。
(4)Cl2通入到石灰乳中可以制成一种常用的消毒剂,其有效成分为___________ (填化学式)。
(1)写出下列物质的化学式:E
(2)反应①的化学方程式为
(3)F溶液常温下呈浅绿色,该溶液中金属阳离子为
(4)Cl2通入到石灰乳中可以制成一种常用的消毒剂,其有效成分为
您最近一年使用:0次
名校
解题方法
6 . 已知海水中溴元素主要以Br形式存在,工业上从海水中提取溴的流程如下:____________ 。
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:_____________ 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是____________ 。
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:_________ 。
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为________ 。
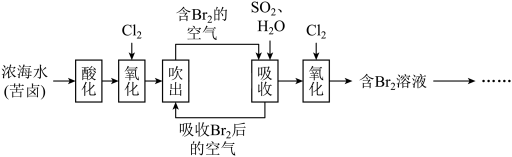
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是

| A.NaOH | B.FeCl2 | C.Na2SO3 | D.H2O |
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为
您最近一年使用:0次
名校
7 . 表中是元素周期表的一部分,请参照元素①~③在表中的位置,回答下列问题:
(1)②与氢气化合产物的电子式是______________ 。
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为_____________ 。
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程____________ 。
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为____________ 。
(5)下列事实能判断①和②的金属性强弱的是___________ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是__________ 。
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为_________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ |
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为
(5)下列事实能判断①和②的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为
您最近一年使用:0次
8 . (I)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别 胶体和
胶体和 溶液的方法是
溶液的方法是__________ 。
(2)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式__________ ,现象为__________ 。
(3)绿矾( )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
①为防止 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量___________ 。
②甲同学取 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为__________ 。乙同学认为甲同学的实验不够严谨,该组同学在 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是__________ 。
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有 和
和 ,且
,且 。
。
(4)从废液中可回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:___________ (填物质名称)。
②物质X为___________ 。
A. B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。
①对反应后的溶液分析错误的是___________ 。
A.溶液中一定含有
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有 ,则可能有固体析出
,则可能有固体析出
D.溶液若有 剩余,则一定没有固体析出
剩余,则一定没有固体析出
②若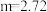 ,则充分反应后得到
,则充分反应后得到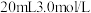 氯化亚铁溶液和
氯化亚铁溶液和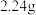 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)鉴别
 胶体和
胶体和 溶液的方法是
溶液的方法是(2)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式(3)绿矾(
 )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。①为防止
 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量②甲同学取
 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有
 和
和 ,且
,且 。
。(4)从废液中可回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案: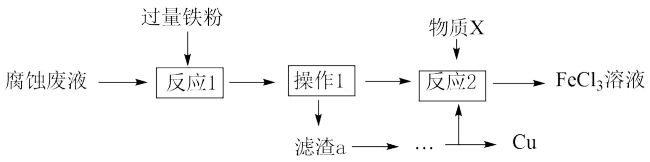
②物质X为
A.
 B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液
 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。①对反应后的溶液分析错误的是
A.溶液中一定含有

B.若有固体剩余,则固体中一定含有铁
C.若溶液中有
 ,则可能有固体析出
,则可能有固体析出D.溶液若有
 剩余,则一定没有固体析出
剩余,则一定没有固体析出②若
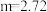 ,则充分反应后得到
,则充分反应后得到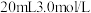 氯化亚铁溶液和
氯化亚铁溶液和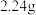 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解题方法
9 . 现有部分元素的性质与原子或分子结构的相关信息如表所示:
(1)T、X、Y、Z形成的简单离子半径由大到小的顺序是______ 。(用离子符号表示)
(2)元素Y与元素Z相比,金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 填字母序号。
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应的程度很剧烈,而Z单质在加热条件下才能与水反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式______ ,请指出元素T在周期表中的位置_______ 。
(4)元素X与氢元素以原子个数比1:2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32),元素T和氢元素以原子个数比1:1化合形成化合物Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式______ 。
| 元素编号 | 元素性质与原子(或分子)结构的相关信息 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 其离子是第三周期金属元素的离子中半径最小的 |
(2)元素Y与元素Z相比,金属性较强的是
a.Y单质的熔点比Z单质的低
b.Y的化合价比Z的低
c.常温下Y单质与水反应的程度很剧烈,而Z单质在加热条件下才能与水反应
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既含离子键又含非极性共价键的常见化合物,写出该化合物的化学式
(4)元素X与氢元素以原子个数比1:2化合时,形成可用于火箭燃料的化合物W(W的相对分子质量为32),元素T和氢元素以原子个数比1:1化合形成化合物Q与W发生氧化还原反应生成X的单质和的T另一种氢化物,请写出Q与W反应的化学方程式
您最近一年使用:0次
解题方法
10 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: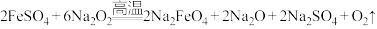 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
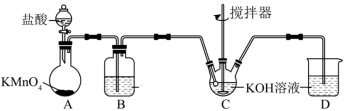
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成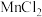 和
和 ,其化学方程式为
,其化学方程式为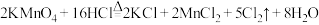 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
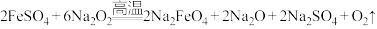 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成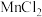 和
和 ,其化学方程式为
,其化学方程式为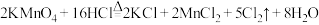 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次



