名校
1 . 下列物质应用和所涉及的反应均正确且有对应关系的是
| 选项 | 物质应用 | 涉及反应 |
| A | 纯碱溶液浸泡锅炉水垢 |  |
| B | 硫化氢除去水中的 | 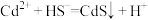 |
| C | 四氯化钛溶液制备二氧化钛水合物 | 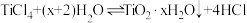 |
| D | 酸性 溶液滴定双氧水 溶液滴定双氧水 | 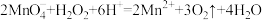 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
2 . 下列古诗或古文中的描述与化学方程式对应关系不正确的是
A.丹砂烧之成水银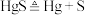 |
B.爆竹声中一岁除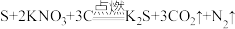 |
C.炉火照天地红星乱紫烟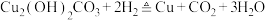 |
D.曾青得铁化为铜 |
您最近半年使用:0次
名校
解题方法
3 . 氧化性:Br2 > Fe3+> I2,向含 a mol FeI2和 a mol BaCl2的混合溶液中缓慢通入 b mol Br2,并不断搅拌,溶液中离子的物质的量随 Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化)。则下列说法不正确的是
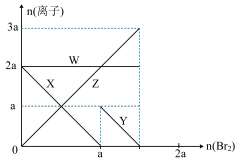

| A.离子的还原性 I-> Fe2+> Br- |
| B.四条线与溶液中离子的对应关系是: X-Fe2+、Y-I-、Z-Br-、W-Cl- |
| C.当4a =3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+):c(Br-) = 1:2:8 |
| D.当3a≤2b时,发生的离子方程式:2Fe2++ 4I-+ 3Br2=2Fe3++ 2I2+6Br- |
您最近半年使用:0次
2020-04-21更新
|
305次组卷
|
2卷引用:浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题
解题方法
4 . 碱金属和碱土金属元素分别位于元素周期表的ⅠA族和ⅡA族,它们的化合物应用广泛。历史上曾以NaCl为原料生产NaOH作为化学工业开端的标志。 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如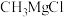 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。
碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如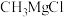 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
A.侯氏制碱法中的物质转化: |
B.由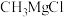 制备乙酸的物质转化: 制备乙酸的物质转化: |
C.电解饱和NaCl溶液的阴极反应: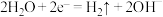 |
D. 与 与 共熔的反应: 共熔的反应: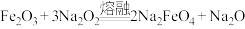 |
您最近半年使用:0次
解题方法
5 .  是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺流程如图所示。
水合物的工艺流程如图所示。
 是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺流程如图所示。
水合物的工艺流程如图所示。
| A.反应釜1需在隔绝空气条件下进行 |
| B.适当升温和搅拌,可提高反应釜中的反应速率 |
C.进入反应釜1和2的 的物质的量之比宜为2∶1 的物质的量之比宜为2∶1 |
D.实验室进行“滤液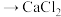 水合物”的操作为加热浓缩、冷却结晶、过滤等 水合物”的操作为加热浓缩、冷却结晶、过滤等 |
您最近半年使用:0次
6 . 周期表第ⅤA族元素及其化合物用途广泛。 在强碱性条件下能被NaClO氧化生成肼(
在强碱性条件下能被NaClO氧化生成肼( ),常温下
),常温下 呈液态,是常用的火箭燃料。
呈液态,是常用的火箭燃料。 的燃烧热为624kJ/mol,
的燃烧热为624kJ/mol, 可被NaClO氧化生成
可被NaClO氧化生成 ,也可被
,也可被 氧化生成
氧化生成 ,
, 是一种弱酸,酸性与醋酸相当。
是一种弱酸,酸性与醋酸相当。 与
与 高温条件下可制备半导体材料砷化镓,
高温条件下可制备半导体材料砷化镓, 的沸点为55℃。下列化学反应或说法不正确的是
的沸点为55℃。下列化学反应或说法不正确的是
 在强碱性条件下能被NaClO氧化生成肼(
在强碱性条件下能被NaClO氧化生成肼( ),常温下
),常温下 呈液态,是常用的火箭燃料。
呈液态,是常用的火箭燃料。 的燃烧热为624kJ/mol,
的燃烧热为624kJ/mol, 可被NaClO氧化生成
可被NaClO氧化生成 ,也可被
,也可被 氧化生成
氧化生成 ,
, 是一种弱酸,酸性与醋酸相当。
是一种弱酸,酸性与醋酸相当。 与
与 高温条件下可制备半导体材料砷化镓,
高温条件下可制备半导体材料砷化镓, 的沸点为55℃。下列化学反应或说法不正确的是
的沸点为55℃。下列化学反应或说法不正确的是A.制备 时,应将 时,应将 缓缓通入NaClO溶液中 缓缓通入NaClO溶液中 |
B. 与 与 反应方程式为 反应方程式为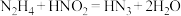 |
C.向 溶液中通入HCl可以制得 溶液中通入HCl可以制得 |
D. 燃烧的热化学方程式为: 燃烧的热化学方程式为: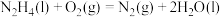  |
您最近半年使用:0次
7 . 氯溴酸在医药和石化工业上有广泛用途,模拟工业制备氢溴酸的流程如图所示。下列说法不正确的是
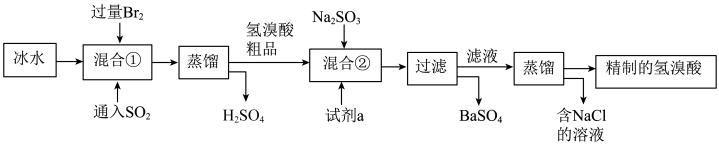

A.混合①使用冰水的目的是防止 和HBr挥发 和HBr挥发 |
B. 可除去氢溴酸粗品中的 可除去氢溴酸粗品中的 ,发生的离子反应为 ,发生的离子反应为 |
| C.蒸馏时,加完“滤液”后,先通冷凝水,再点燃酒精灯加热 |
D.工业氢溴酸常带有淡淡的黄色,可能是因为含有 |
您最近半年使用:0次
8 . 铁的单质及其化合物用途广泛,下列相关的离子方程式书写正确的是
A.用KSCN溶液检验 : : |
B.硫酸亚铁溶液中滴加双氧水: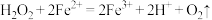 |
C.NaClO碱性条件下制备绿色消毒剂 : : |
D.用 溶液刻蚀Cu电路板: 溶液刻蚀Cu电路板: |
您最近半年使用:0次
9 . 宏观辨识与微观探析是化学核心素养之一、下列物质性质与用途对应的离子方程式书写正确的是
A. 氧化海带灰酸性浸出液提取碘: 氧化海带灰酸性浸出液提取碘: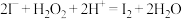 |
B. 与水反应用作潜水艇氧气来源: 与水反应用作潜水艇氧气来源: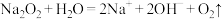 |
C.绿矾处理含 的酸性废水: 的酸性废水: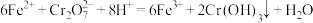 |
D.向 溶液中通入氨气可制备抗酸药 溶液中通入氨气可制备抗酸药 : :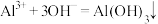 |
您最近半年使用:0次
10 . 草酸晶体(H2C2O4⋅2H2O)用途广泛,易溶于水,其制备及纯度测定实验如下。
I.制备
步骤1:将mg淀粉溶于水与少量硫酸加入反应器中,保持85~90℃约30min,然后逐渐降温至60℃左右。
步骤2:控制反应温度在55~60℃条件下,边搅拌边缓慢滴加含有适量催化剂的混酸(65%硝酸与98%硫酸),主要反应为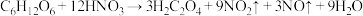 。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体
。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体 。
。
Ⅱ.纯度测定
称取制得的草酸晶体 ,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是
,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是
I.制备
步骤1:将mg淀粉溶于水与少量硫酸加入反应器中,保持85~90℃约30min,然后逐渐降温至60℃左右。
步骤2:控制反应温度在55~60℃条件下,边搅拌边缓慢滴加含有适量催化剂的混酸(65%硝酸与98%硫酸),主要反应为
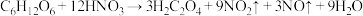 。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体
。严格控制混酸的滴加速度,防止发生副反应。3h左右,冷却,减压过滤得粗品,精制得草酸晶体 。
。Ⅱ.纯度测定
称取制得的草酸晶体
 ,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是
,配成100.00mL溶液。取出20.00mL,用cmol·L-1酸性KMnO4标准溶液滴定,重复2~3次,滴定终点时,平均消耗标准溶液VmL。根据上述实验,下列说法正确的是| A.配制溶液时容量瓶底部残留少量水,会导致所配溶液浓度偏低 |
| B.滴加“混酸”速度过快,不影响草酸晶体的产率 |
| C.锥形瓶用草酸溶液润洗,所测产品纯度会偏低 |
| D.滴定终点读数时仰视,所测产品纯度偏高 |
您最近半年使用:0次



