名校
解题方法
1 . 下列有关化学反应速率的实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向2支盛有5mL不同浓度Na2SO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 | 探究浓度对化学反应速率的影响 |
| B | 两支试管,都加入 的酸性 的酸性 溶液,再同时向两支试管分别加入 溶液,再同时向两支试管分别加入 的 的 溶液和 溶液和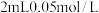 的 的 溶液,观察高锰酸钾溶液褪色所需时间 溶液,观察高锰酸钾溶液褪色所需时间 | 探究草酸浓度对反应速率影响 |
| C |  在锥形瓶内各盛有  锌粒 锌粒 颗粒大小基本相同 颗粒大小基本相同 ,然后通过分液漏斗分别加入 ,然后通过分液漏斗分别加入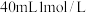 和 和 的硫酸。比较两者收集 的硫酸。比较两者收集 氢气所用的时间 氢气所用的时间 | 探究硫酸浓度对反应速率影响 |
| D | 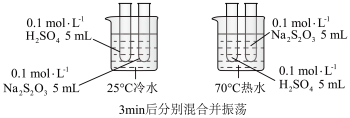 | 探究温度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2 . 硫化钠在造纸工业中用作纸张的蒸煮剂,在制药工业中用于生产解热药,还可用于制备硫代硫酸钠、多硫化钠等。久置的 固体会潮解、变质、颜色变黄。某实验小组为探究
固体会潮解、变质、颜色变黄。某实验小组为探究 固体在空气中变质后的固体成分进行了如下实验。下列说法正确的是
固体在空气中变质后的固体成分进行了如下实验。下列说法正确的是
已知:硫化钠溶液能溶解单质硫,生成多硫化钠( )。。多硫化物的溶液颜色通常为黄色。
)。。多硫化物的溶液颜色通常为黄色。 与酸反应生成S和
与酸反应生成S和 。
。
 固体会潮解、变质、颜色变黄。某实验小组为探究
固体会潮解、变质、颜色变黄。某实验小组为探究 固体在空气中变质后的固体成分进行了如下实验。下列说法正确的是
固体在空气中变质后的固体成分进行了如下实验。下列说法正确的是| 实验步骤 | 实验操作 | 实验现象 | |
| 操作I | 取适量久置于空气中的 固体,分为两份 固体,分为两份 | ①一份加入 溶解 溶解 | 搅拌后,固体表面的少量淡黄色固体消失 |
| ②另一份加水溶解 | 搅拌后,固体完全溶解,得到略带黄色的溶液。取略带黄色的溶液,滴加稀硫酸,产生淡黄色浑浊M | ||
| 操作II | 向②中固体溶解得到的略带黄色的溶液中加入过量的 溶液 溶液 | 得到灰黑色悬浊液 | |
| 操作III | 将灰黑色悬浊液离心分离 | 离心管底部出现深褐色沉淀,溶液中出现淡黄色浑浊 | |
| 操作IV | 向上述离心分离获得的溶液中加入足量的氯化钡溶液 | 产生大量白色沉淀 | |
| 操作V | 过滤,用无水乙醇洗涤;然后加入稀盐酸,将产生的气体通入少量酸性高锰酸钾溶液中 | 固体部分溶解,酸性高锰酸钾溶液褪色 | |
 )。。多硫化物的溶液颜色通常为黄色。
)。。多硫化物的溶液颜色通常为黄色。 与酸反应生成S和
与酸反应生成S和 。
。| A.①中黄色固体和②中黄色溶液的化学成分相同 |
B.②中现象淡黄色浑浊M不一定是 与稀硫酸反应产生 与稀硫酸反应产生 |
C.操作II中发生反应的离子方程式为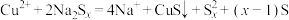 |
| D.实验室可用稀硝酸和硫化亚铁反应制备硫化氢 |
您最近半年使用:0次
名校
3 . 向多硫化钠固体中滴加稀硫酸,产生臭鸡蛋气味的气体,试管A中产生浅黄色固体,试管B中产生黑色沉淀,试管C中溶液变为浅绿色并产生浅黄色固体,试管D中溶液褪色,生成一种常见的最高价含氧酸和一种无氧强酸(省略尾气处理装置)。下列叙述错误的是


| A.试管B中黑色沉淀为CuS |
B.试管D中现象可证明还原性: |
| C.若反应一直持续,试管C中可能会有黑色沉淀生成 |
D.试管A中发生反应的化学方程式: |
您最近半年使用:0次
2023-10-09更新
|
158次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
名校
4 . 工业上由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备高纯碳酸锰。其主要工艺流程如图:
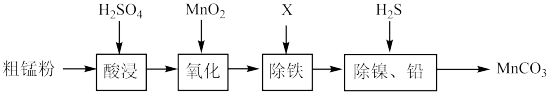
下列有关说法不正确 的是

下列有关说法
| A.可以通过搅拌的方式提高“酸浸”时粗锰粉的浸取率 |
| B.向酸浸后的滤液中加入MnO2,反应的离子方程式为:Mn4++2Fe2+=2Fe3++Mn2+ |
| C.除铁时加入的物质X作用是调节溶液的pH值,使Fe3+转化为Fe(OH)3沉淀而除去 |
| D.取除铁后的滤液,加入几滴KSCN溶液,无明显现象证明Fe3+已除尽 |
您最近半年使用:0次
2022-04-15更新
|
844次组卷
|
5卷引用:江苏省盐城市阜宁中学等四校2021-2022学年高一下学期期中考试化学试题
江苏省盐城市阜宁中学等四校2021-2022学年高一下学期期中考试化学试题江苏省海州高级中学2021-2022学年高一下学期期中考试化学试题(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题江苏省常熟市海虞高级中学2021-2022学年高一下学期线上期中考试化学试题(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
5 . NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
下列判断不正确的是
| 装置图 | 试剂X | 实验现象 | |
 | ① | 0.2mol•L-1盐酸 | 产生黄绿色气体 |
| ② | 0.2mol•L-1KI-淀粉溶液 | 溶液变蓝 | |
| ③ | 0.2mol•L-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
| ④ | 0.2mol•L-1AlCl3溶液 | 产生白色沉淀 | |
| A.实验①中发生的主要反应是ClO-+Cl-+2H+=Cl2↑+H2O |
| B.实验②中发生的主要反应是ClO-+2I-+2H+=Cl-+I2+H2O |
| C.实验③中该条件下氧化性强弱ClO-<Fe3+ |
| D.实验④中ClO-与Al3+相互促进水解 |
您最近半年使用:0次
名校
6 . 用低品铜矿(主要含CuS、FeO)制备 的一种工艺流程如下:
的一种工艺流程如下:
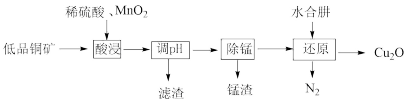
下列说法正确的是
 的一种工艺流程如下:
的一种工艺流程如下:

下列说法正确的是
A.“酸浸”过程中CuS发生反应的离子方程式为: |
B.已知酸浸液中含 ,为检验是否含有 ,为检验是否含有 ,可先加入KSCN溶液,再加氯水观察现象 ,可先加入KSCN溶液,再加氯水观察现象 |
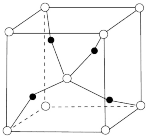
C.1个 晶胞(如图)中含4个氧原子 晶胞(如图)中含4个氧原子 |
D.水合肼浓度过大, 产率下降,可能的原因是 产率下降,可能的原因是 进一步被还原成单质铜 进一步被还原成单质铜 |
您最近半年使用:0次
2022-09-03更新
|
279次组卷
|
3卷引用:江苏省海安市2022-2023学年高三上学期期初学业质量监测化学试题
7 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如图1所示:
的一种制备方法如图1所示: 可将
可将 氧化成
氧化成 。下列说法错误的是
。下列说法错误的是
 的一种制备方法如图1所示:
的一种制备方法如图1所示: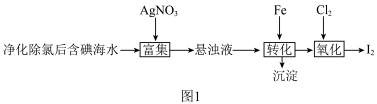
 可将
可将 氧化成
氧化成 。下列说法错误的是
。下列说法错误的是A.“转化”反应的离子方程式为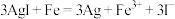 |
B.“转化”产生的沉淀可用 处理后循环使用 处理后循环使用 |
C.“氧化”时,应控制 的量,过多或过少,都会降低单质碘的收率 的量,过多或过少,都会降低单质碘的收率 |
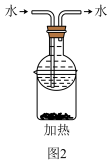
| D.获得的粗碘可采用图2装置进行纯化 |
您最近半年使用:0次
2024-01-10更新
|
91次组卷
|
2卷引用:河南省周口市项城市2023-2024学年上学期高三1月阶段测试理综试题
名校
解题方法
8 . 四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为−25℃,沸点为136.4℃。某实验小组设计如图装置(部分加热和夹持装置省略),用Cl2与碳粉、TiO2制备TiCl4。下列说法正确的是
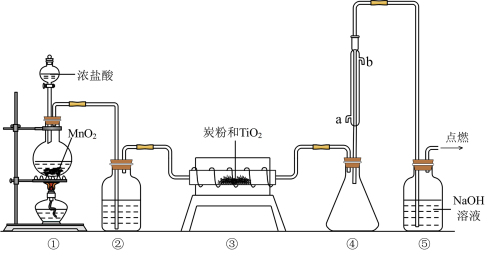

| A.②中应盛装饱和食盐水 |
| B.冷凝管处冷凝水应该由b进a出 |
| C.反应结束时,应先停止①处的加热,后停止③处的加热 |
| D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置 |
您最近半年使用:0次
2023-03-18更新
|
174次组卷
|
2卷引用:湖北省云学新高考联盟学校2022-2023学年高一下学期3月联考化学试题
名校
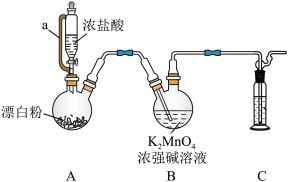
9 . 某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: 下列说法中错误的是
下列说法中错误的是

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
 下列说法中错误的是
下列说法中错误的是A.装置A中制备Cl2的化学方程式为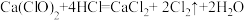 |
| B.装置A中a的作用是平衡压强,使液体顺利滴下 |
| C.在装置A、B之间加装盛有饱和食盐水的洗气瓶,可以提高高锰酸钾的产率 |
| D.装置C中可盛放澄清石灰水,吸收未反应的氯气 |
您最近半年使用:0次
2023-01-14更新
|
219次组卷
|
2卷引用:山东省济南市历城第二中学2022-2023学年高一上学期期末考试化学试题
2022高三·全国·专题练习
10 . 某实验小组用如图所示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是
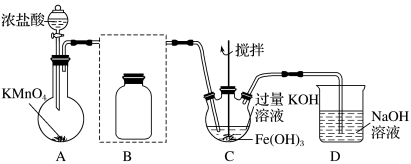

| A.B瓶应盛放饱和食盐水除去Cl2中混有的HCl |
| B.C瓶中KOH过量更有利于高铁酸钾的生成 |
| C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2 |
| D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒等特点为一体的优良的水处理剂 |
您最近半年使用:0次



