名校
解题方法
1 . 利用工业废气NO生产 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中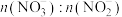 都为
都为 。下列说法错误的是
。下列说法错误的是
 的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中
的流程如图所示。已知装置Ⅰ和装置Ⅱ反应后溶液中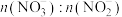 都为
都为 。下列说法错误的是
。下列说法错误的是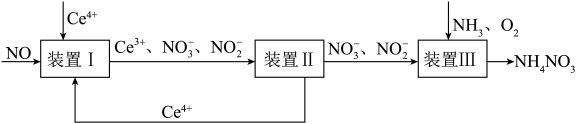
A.装置Ⅰ中若有 参与反应,则转移 参与反应,则转移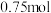 电子 电子 |
B.装置Ⅰ中反应为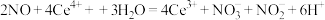 |
C.装置Ⅲ中氧化剂和还原剂的物质的量之比为 |
D.装置Ⅲ中 和 和 的体积比 的体积比 时,可实现原子利用率最大化 时,可实现原子利用率最大化 |
您最近一年使用:0次
解题方法
2 . 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2)。工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,发生的反应为aFeCl2 +bO2 + cH2O dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是
 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是| A.a+b+d=7 |
| B.该反应中,每消耗3.2gO2,同时生成32 g Fe2O3 |
| C.该反应中,HCl既是氧化产物也是还原产物 |
| D.将生成的气体通入碳酸氢钙溶液中,会有碳酸钙沉淀生成 |
您最近一年使用:0次
名校
解题方法
3 . 某矿石的主要成分为MgCO3,还含有CaO、SiO2、Fe3O4、Al2O3及少量其它杂质。某工厂采用该矿石为主要原料生产碱式碳酸镁,流程如下(已知:温度低于700℃时,SiO2不会与CaO等反应)。下列有关说法不正确的是
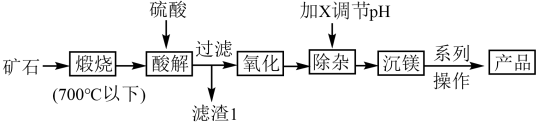

A.煅烧过程所发生的主要化学反应方程式为: |
| B.滤渣1的成分是SiO2 |
C.氧化步骤发生反应的离子方程式可以是: |
| D.加X调pH的X是氢氧化钠 |
您最近一年使用:0次
名校
解题方法
4 . 某离子反应涉及H+、Bi3+、 、
、 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断正确的是
)随反应进行逐渐增大。下列判断正确的是
 、
、 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断正确的是
)随反应进行逐渐增大。下列判断正确的是| A.该反应的还原产物为Bi3+ |
| B.氧化剂与还原剂的物质的量之比为2:5 |
| C.反应后溶液的酸性明显增强 |
| D.若有1 mol氧化剂参加反应,转移电子的物质的量为2 mol |
您最近一年使用:0次
名校
解题方法
5 . 一种以镉废渣(含CdO及少量ZnO、CuO和FeO)为原料制备镉(Cd)的流程如下:
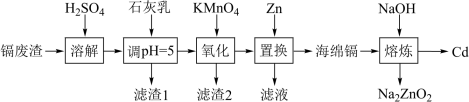
已知: 在酸性环境中被还原为
在酸性环境中被还原为 ,在弱酸性、弱碱性溶液中被还原为
,在弱酸性、弱碱性溶液中被还原为 ,在碱性环境中被还原为
,在碱性环境中被还原为 ;部分阳离子以氢氧化物形式沉淀时溶液pH如下。
;部分阳离子以氢氧化物形式沉淀时溶液pH如下。
下列说法正确的是

已知:
 在酸性环境中被还原为
在酸性环境中被还原为 ,在弱酸性、弱碱性溶液中被还原为
,在弱酸性、弱碱性溶液中被还原为 ,在碱性环境中被还原为
,在碱性环境中被还原为 ;部分阳离子以氢氧化物形式沉淀时溶液pH如下。
;部分阳离子以氢氧化物形式沉淀时溶液pH如下。 |  |  | |
| 开始沉淀时的pH | 2.7 | 6.3 | 3.8 |
| 完全沉淀时的pH | 3.2 | 8.3 | 5.0 |
| A.“调pH=5”可除去Fe和Cu等杂质 |
B.滤渣2的成分中含有 |
C.“置换”后滤液溶质主要成分是 和 和 |
| D.“熔炼”过程中有气体产生 |
您最近一年使用:0次
6 . 利用工业废气NO生产NH4NO3的流程如图所示。已知装置I和装置II反应后溶液中n(NO ):n(NO
):n(NO )都为1:1。下列说法错误的是
)都为1:1。下列说法错误的是

 ):n(NO
):n(NO )都为1:1。下列说法错误的是
)都为1:1。下列说法错误的是
A.装置I中反应为2NO+4Ce4++3H2O=4Ce3++NO +NO +NO +6H+ +6H+ |
| B.装置I中若有5.6L(标准状况)NO参与反应,则转移1mol电子 |
| C.装置III中氧化剂和还原剂的物质的量之比为1:2 |
| D.装置III中NH3和O2的体积比3:1时,可实现原子利用率最大化 |
您最近一年使用:0次
2023-12-03更新
|
154次组卷
|
2卷引用:山东省潍坊市昌乐第一中学2023-2024学年高三上学期12月月考化学试题
7 . 氧锰化合物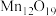 是制备环保催化剂(OMS-2)的原料。以
是制备环保催化剂(OMS-2)的原料。以 (含少量
(含少量 )为原料制备
)为原料制备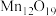 的流程如下:
的流程如下:
已知:
① 的溶解度随着温度降低而减小,
的溶解度随着温度降低而减小, 中氧显-2价,含+3、+4价锰。
中氧显-2价,含+3、+4价锰。
②几种金属离子生成氢氧化物沉淀的pH如下表。
下列叙述错误的是
 是制备环保催化剂(OMS-2)的原料。以
是制备环保催化剂(OMS-2)的原料。以 (含少量
(含少量 )为原料制备
)为原料制备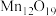 的流程如下:
的流程如下:
已知:
①
 的溶解度随着温度降低而减小,
的溶解度随着温度降低而减小,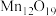 中氧显-2价,含+3、+4价锰。
中氧显-2价,含+3、+4价锰。②几种金属离子生成氢氧化物沉淀的pH如下表。
| 氢氧化物 |  |  |  |
| 开始沉淀/pH | 7.5 | 2.3 | 8.8 |
| 完全沉淀/pH | 9.7 | 3.7 | 10.4 |
A.用稀盐酸和 溶液检验产品是否洗净 溶液检验产品是否洗净 |
| B.操作X包括过滤、洗涤、干燥 |
| C.“除铁”中3.7≤a<8.8 |
D.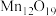 中+3、+4价锰的质量之比为1∶5 中+3、+4价锰的质量之比为1∶5 |
您最近一年使用:0次
2023-09-12更新
|
48次组卷
|
2卷引用:山东省济宁市微山县第二中学2023-2024学年高三上学期第三次月考化学试题
名校
解题方法
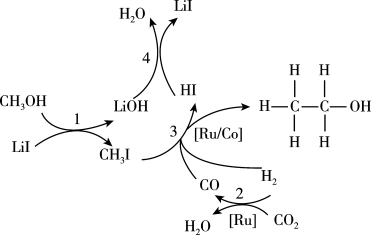
8 . 利用 与
与 合成
合成 的反应主要历程如图所示。下列说法正确的是
的反应主要历程如图所示。下列说法正确的是
 与
与 合成
合成 的反应主要历程如图所示。下列说法正确的是
的反应主要历程如图所示。下列说法正确的是
A. 没有参加化学反应 没有参加化学反应 |
| B.合成过程中涉及极性共价键、非极性共价键的断裂和形成 |
C.若用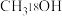 替代 替代 ,则可生成 ,则可生成 |
D.合成 的总反应方程式为: 的总反应方程式为: |
您最近一年使用:0次
2023-04-28更新
|
469次组卷
|
2卷引用:山东省淄博市第六中学2022-2023学年高二6月月考化学试题
名校
9 . 在实验室中从废旧钴酸锂离子电池的正极材料(在铝箔上涂覆活性物质 )中回收钴、锂的操作流程如图:
)中回收钴、锂的操作流程如图:
 )中回收钴、锂的操作流程如图:
)中回收钴、锂的操作流程如图: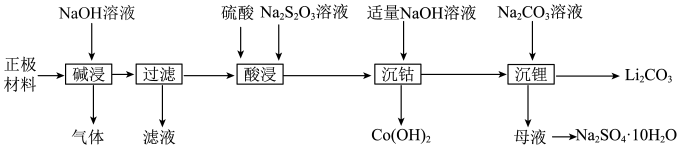
| A.拆解废旧电池获取正极材过程中能量的主要转化方式为化学能→热能→电能 |
B.“滤液”主要成分是 |
C.“酸浸”时消耗 、 、 、 、 物质的量之比为6:1:3 物质的量之比为6:1:3 |
D.若用盐酸替代硫酸、 溶液可同样达到“酸浸”的目的,但产生 溶液可同样达到“酸浸”的目的,但产生 污染环境 污染环境 |
您最近一年使用:0次
2023-04-25更新
|
262次组卷
|
2卷引用:山东省菏泽市第一中学2023-2024学年高一下学期第二次月考化学试题
10 . MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图。下列说法正确的是
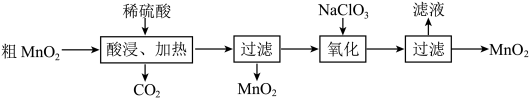

| A.Mn元素位于元素周期表的ds区 |
| B.加热的目的是加快反应速率,促进CO2的逸出 |
C.“氧化”时的离子方程式为3Mn2++ClO +3H2O=3MnO2↓+Cl-+6H+ +3H2O=3MnO2↓+Cl-+6H+ |
| D.将“滤液”进行蒸发结晶可得到纯净的NaCl |
您最近一年使用:0次
2023-03-31更新
|
107次组卷
|
2卷引用:山东省名校联盟2022-2023学年高二下学期3月质量检测联合调考化学(B2)试题



