名校
1 . 氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____ KClO3+____ HCl(浓) → ____ KCl+____ ClO2↑+____ Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________ (填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________ 。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______ 倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________ 。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
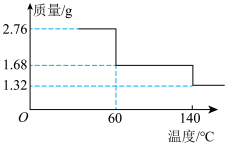
①试确定60 ℃时CaO2·xH2O中x=________ 。
②该样品中CaO2的质量分数为________ 。(保留一位小数)
(1) 请补充空白并配平化学方程式。
(2) 浓盐酸在反应中显示出来的性质是
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。

①试确定60 ℃时CaO2·xH2O中x=
②该样品中CaO2的质量分数为
您最近一年使用:0次
名校
2 . 高铁酸钾 (K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-=2FeO42- +3Cl-+5H2O,干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑ 下列有关说法不正确的是
| A.低温下,高铁酸钾的溶解度比高铁酸钠更小 |
| B.湿法制备中每生成1mol Na2FeO4 转移3mol电子 |
| C.干法制备中还原剂与氧化剂的物质的量之比为1:3 |
| D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
您最近一年使用:0次
名校
3 . 在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是


| A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O |
| B.反应Ⅱ的氧化剂是Fe3+ |
| C.反应Ⅲ是氧化还原反应 |
| D.黄铁矿催化氧化中NO作催化剂 |
您最近一年使用:0次
2019-09-04更新
|
773次组卷
|
16卷引用:宁夏回族自治区青铜峡市高级中学2021届高三上学期第二次月考化学试题
宁夏回族自治区青铜峡市高级中学2021届高三上学期第二次月考化学试题四川省成都市2020届高三高中毕业班摸底测试化学试题河北省衡水市衡水中学2019-2020学年高三上学期期中考试化学试题(已下线)考点03 氧化还原反应-2020年高考化学命题预测与模拟试题分类精编四川省成都南开为明学校2019-2020学年高二上学期期中考试化学试题广东省韶关市田家炳中学2020-2021学年高一上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期11月测试化学试题四川省绵阳市南山中学双语学校2020-2021学年高二下学期6月月考化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题(已下线)第4周 晚练题-备战2022年高考化学周测与晚练(新高考专用)江西省景德镇市2022届高三第一次模拟化学试题黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题黑龙江省大庆铁人中学2021-2022学年高一下学期第一次月考化学试题陕西省汉中中学2021-2022学年高二下学期6月月考化学试题辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题(已下线)题型7 氧化还原反应原理在实际生产中的应用
11-12高一下·河北衡水·期末
名校
4 . “三效催化转化器”可将汽车尾气中的有毒气体转化为无污染的气体,下图为该反应的微观示意图(末配平),其中不同符号的球代表不同种原子。下列说法不正确的是
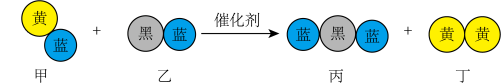

| A.该反应属于氧化还原反应 |
| B.配平后甲、乙、丙的化学计量数均为2 |
| C.甲和丙中同种元素化合价不可能相同 |
| D.丁物质一定是非金属单质 |
您最近一年使用:0次
2019-03-03更新
|
459次组卷
|
9卷引用:宁夏回族自治区银川市六盘山市高级中学2020-2021学年高一上学期第二次月考化学试题
真题
名校
5 . 若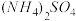 在强热时分解的产物是
在强热时分解的产物是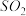 、
、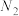 、
、 和
和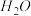 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为
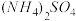 在强热时分解的产物是
在强热时分解的产物是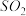 、
、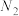 、
、 和
和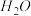 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
您最近一年使用:0次
2019-01-30更新
|
1491次组卷
|
28卷引用:2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)
2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年云南省玉溪一中高二上学期期中考试化学(理)试卷(已下线)2011-2012年江西省吉安一中高一上学期期中考试化学试卷(已下线)2012届福建省厦门市翔安一中高三11月份月考化学试卷(已下线)2012届山东省济宁市鱼台二中高三11月月考化学试卷(已下线)2011-2012学年四川省巴中市四县中高一上期期末联考化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷(已下线)2015届黑龙江省哈师大附中高三第一次月考化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷甘肃省兰州市第一中学2018届高三8月月考化学试题山西省康杰中学2018届高三上学期第一次月考化学试卷【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题河北省易县中学2018-2019学年高二下学期期末考试化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷2020届高三化学总复习考点强化练习:物质及其变化(已下线)【浙江新东方】36新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题微专题(三)——氧化还原反应方程式的配平与书写
6 . 【化学选修-化学与技术】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______________ 剂。
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:___________________________ 。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是_________________________________________________ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
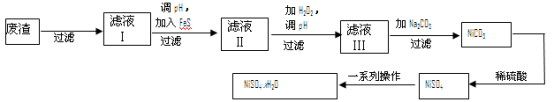
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为______________ 。
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是______________ ,调pH的目的是________________ 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是_______________________________________________________ 。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作
(2)自然界中Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。写出过程中的离子方程式:
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,加H2O2的目的是
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2019-01-30更新
|
545次组卷
|
2卷引用:2015届宁夏银川市第九中学高三下学期第一次模考理综化学试卷
7 . 氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下
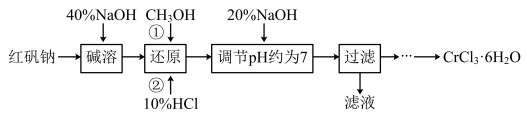
已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式___________________________ ,所加40‰NaOH不宜过量太多的原因是_________________________________ 。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式______________________ ,反应后从剩余溶液中分离出CH3OH的实验方法是___________ 。
(3)使用下列用品来测定溶液的pH,合理的是___________ (填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,___________ ,过滤,___________ ,低温干燥,得到CrC3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为___________ 。

已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为
您最近一年使用:0次
2019-01-30更新
|
159次组卷
|
2卷引用:【市级联考】宁夏回族自治区吴忠市2019届高三上学期期末考试化学试题
解题方法
8 . 铁是应用最广泛的金属,铁的卤化物、氧化物等均为重要化合物。回答下列问题。
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是___________ 。
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)___________
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为___________ ,该氧化物中的Fe分别为Fe2+、Fe3+,计算n(Fe2+):n(Fe3+)= ___________
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe H2
H2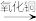 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4 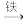 Cu。
Cu。
若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是___________
A.相等 B.①多 C.②多 D.无法判断
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1___________ (填“大于”、“可能大于”、“等于”或“可能等于”)m2
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为___________ mol
(1)FeCl3溶液吸可以吸收烟气中的SO2,该反应的离子方程式是
(2)已知反应:3Br2 + 6FeCl2 = 4FeCl3 + 2FeBr3,向1L 0.4mol/L的FeBr2溶液中通入6.72LCl2(标准状况),写出该反应的离子方程式(用总方程式表示)
(3)已知铁的某种氧化物化学式为FexO(x<1),铁元素的质量分数为76.3%,则FexO中x值(精确至0.01)为
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe
 H2
H2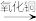 Cu,②CuO
Cu,②CuO  CuSO4
CuSO4 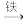 Cu。
Cu。若实验过程中,根据规范的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是
A.相等 B.①多 C.②多 D.无法判断
(5)在铁与铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1 g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2 g,则m1
(6)以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为
您最近一年使用:0次
19-20高三上·宁夏吴忠·阶段练习
名校
9 . 以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用 硫酸渣制备铁红(Fe2O3)的过程如下:
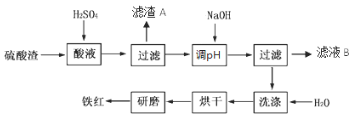
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为_________________ ;“滤渣A”主要成分的化学式为______________ 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+ 14Fe3++____ H2O== 15Fe2++2 SO42-+____ _____
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为____________________ 。
(4)氧化过程中能否用硝酸代替空气________________ (用能或否填空)为什么?__________
(5)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____________ (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)_______________ 。
(6)如何验证已经洗涤干净____________________________________________________ 。

(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+ 14Fe3++
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
(4)氧化过程中能否用硝酸代替空气
(5)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是
| 沉淀物 | Fe(OH)3 | A1(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(6)如何验证已经洗涤干净
您最近一年使用:0次
名校
10 . 某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl— 六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是:
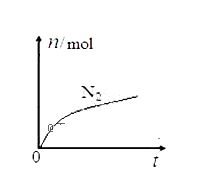
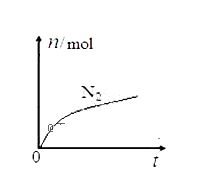
| A.该反应的还原剂是Cl— |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为3:2 |
| D.反应后溶液的酸性明显减弱 |
您最近一年使用:0次



