10-11高三上·福建厦门·阶段练习
名校
1 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:2010年福建省厦门市杏南中学高三上学期10月月考化学卷
(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
名校
解题方法
2 . 三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________ 。滤渣1的主要成分为______________ (填化学式)。
(2)酸浸时双氧水的作用有___________ 。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________ 。
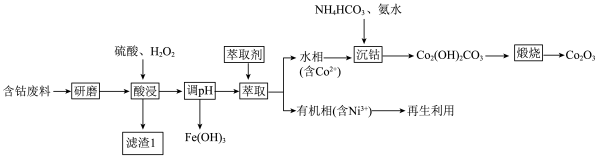
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________ 。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH。则放电时正极的电极反应式为__________ 。
(4)沉钴时发生反应的离子方程式为_______ 。煅烧时发生反应的化学方程式为_______ 。
(1)研磨的目的是
(2)酸浸时双氧水的作用有

(3)在实验室里,萃取操作要用到的玻璃仪器主要有
(4)沉钴时发生反应的离子方程式为
您最近一年使用:0次
2018-11-19更新
|
568次组卷
|
4卷引用:宁夏回族自治区银川一中2021届高三上学期第一次月考理综化学试题
名校
3 . 二氧化氯是一种黄绿色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒。
(1)在进行饮用水消毒时,ClO2可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,据此说明ClO2具有________ 性。
(2)液氯也常用作自来水消毒。已知ClO2、Cl2的还原产物均为Cl-,则相同物质的量的ClO2的消毒效率是Cl2的_____ 倍。(消毒效率指单位物质的量的物质的得电子数)
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,使碘游离出来。已知:8HCl + 2ClO2 + 10KI === 5I2 + 10KCl + 4H2O。
操作Ⅱ: 加入一定量的Na2S2O3溶液。(已知:2Na2S2O3+I2===Na2S4O6+2NaI)
请回答:
①操作Ⅰ中反应的离子方程式是___________________________________________ 。
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是_______ mg·L-1。
(1)在进行饮用水消毒时,ClO2可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,据此说明ClO2具有
(2)液氯也常用作自来水消毒。已知ClO2、Cl2的还原产物均为Cl-,则相同物质的量的ClO2的消毒效率是Cl2的
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,使碘游离出来。已知:8HCl + 2ClO2 + 10KI === 5I2 + 10KCl + 4H2O。
操作Ⅱ: 加入一定量的Na2S2O3溶液。(已知:2Na2S2O3+I2===Na2S4O6+2NaI)
请回答:
①操作Ⅰ中反应的离子方程式是
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是
您最近一年使用:0次
名校
4 . 已知M2On2-离子可与R2-离子反应,R2- 被氧化为R单质,M2On2-的还原产物中M为+3价;又已知100mL c(M2On2- )=0.2 mol·L-1的溶液可与100mL c(R2- )=0.6 mol·L-1的溶液恰好完全反应,则n值为( )
| A.4 | B.5 | C.6 | D.7 |
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分,表中所列的字母分别代表某一元素。
(1)A的的最高价氧化物对应水化物的电子式为__________ 。
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为_____________ ;Na2FeO4是工业常用的消毒剂,利用R 制备Na2FeO4的原理如下,请补齐缺少的物质,并配平反应方程式的系数:___ Fe(OH)3 + ___R(________) + ___ NaOH = ____ Na2FeO4 + ___ NaCl + ____H2O
(3)气态氢化物沸点:D_____ E;元素形成的简单离子的半径:A _____ D(填“>”,“<”或“=”)
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明______________________________________________________________ 。
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:

①写出 G 转化为 K 的化学方程式________________________________________ 。
②写出 L 转化为 M 的离子方程式________________________________________ 。
| B | C | D | |||||
| A | E | F | |||||
(1)A的的最高价氧化物对应水化物的电子式为
(2)R是由表中已标出的A~F 中某三种元素组成的化合物,是常见家用消毒剂的主要成分,其化学名称为
(3)气态氢化物沸点:D
(4)E 的某种氧化物通入F 单质的水溶液中,并不能增大F 单质水溶液的漂白性,请结合方程式说明
(5)由表中未标出的某种金属元素的单质G ,可以发生如图所示的转化:

①写出 G 转化为 K 的化学方程式
②写出 L 转化为 M 的离子方程式
您最近一年使用:0次
2018-11-01更新
|
164次组卷
|
3卷引用:【全国百强校】宁夏回族自治区银川市第一中学2019届高三上学期第三次月考理科综合化学试题
名校
6 . 离子反应和氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为______________ 。
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式________ 。
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是____ 、______ 。
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式_______ ;
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式
您最近一年使用:0次
名校
7 . 某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____ I-+____ IO3—+____ H+ =____ I2+____ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________ 。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______ ,上述操作正确的顺序是:_______ (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________ 。
②b中反应所消耗的KI的物质的量是____________ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所消耗的KI的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)
您最近一年使用:0次
8 . 碲(Te)位于元素周期表第ⅥA族,该元素组成的物质可用作石油裂化的催化剂、电镀液的光亮剂、玻璃的着色材料及合金材料的添加剂等。精炼铜的阳极混含有Cu2Te、Au、Ag等,利用下列工艺流程可回收碲:
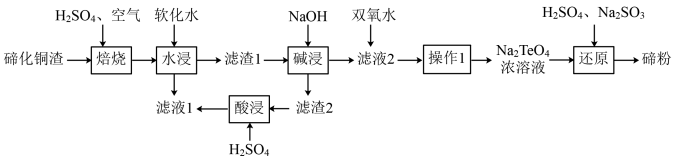
已知:TeO2熔点733℃,微溶于水,可溶于强酸和强碱。回答下列问题:
(1)Te与S的简单氢化物的稳定性强弱顺序为:__________ (用氢化物的化学式表示)。
(2)“焙烧”的化学方程式__________ (碲主要以TeO2形式存在)。
(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:________ 。“滤液1”的溶质有________ 。
(4)“滤渣1”进行“碱浸”的目的是________
(5)“滤液2”加入双氧水,能否改用氯水或氯气,说明原因:_________
(6)“还原”制备碲粉的氧化产物是_________
(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,分析“滤渣2”进行“酸浸”的意义:________

已知:TeO2熔点733℃,微溶于水,可溶于强酸和强碱。回答下列问题:
(1)Te与S的简单氢化物的稳定性强弱顺序为:
(2)“焙烧”的化学方程式
(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:
(4)“滤渣1”进行“碱浸”的目的是
(5)“滤液2”加入双氧水,能否改用氯水或氯气,说明原因:
(6)“还原”制备碲粉的氧化产物是
(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,分析“滤渣2”进行“酸浸”的意义:
您最近一年使用:0次
2018-05-13更新
|
498次组卷
|
2卷引用:【全国百强校】湖南省长沙市长郡中学2018届高考押题卷(三)理综化学试题
名校
解题方法
9 . 硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝基的炸药等。有机化工中也用硝酸与丙烯或乙烯、乙二醇作用制取草酸。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式_______________________________ 。
②写出过量铁与稀硝酸反应的离子方程式_______________________________ 。
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比__________________ 。
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为_________ g。
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:____ Al+___NO3-+___OH-==___AlO2-+___N2↑+_________。
②上述反应中,还原剂与还原产物的物质的量之比是____ ,反应中转移电子0.3mol,标准状况下生成N2是___________ mL。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式
②写出过量铁与稀硝酸反应的离子方程式
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:
②上述反应中,还原剂与还原产物的物质的量之比是
您最近一年使用:0次
2018-01-26更新
|
425次组卷
|
4卷引用:宁夏银川一中2017-2018学年高一上学期期末考试化学试题
名校
10 . 某化学反应的反应物和产物如下:KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是______________ 。
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是______ 。
(3)在下面的化学式上标出电子转移的方向和数目:
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O_____________ 。
(4)通常用碳酸氢钠的饱和溶液除去CO2中混有的少量HCl气体,反应的离子方程式是_________________________________________ 。不用碳酸钠稀溶液除杂的原因是(用离子方程式表示)____________________________________ 。
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是
(3)在下面的化学式上标出电子转移的方向和数目:
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
(4)通常用碳酸氢钠的饱和溶液除去CO2中混有的少量HCl气体,反应的离子方程式是
您最近一年使用:0次



